外泌体lncRNA H19在miR-7/KLF4/VEGF调控人肺腺癌细胞迁移和侵袭中的作用研究
王林 易基群 江高峰
【摘要】目的 探討外泌体长链非编码RNA H19(lncRNA H19)调控人肺腺癌细胞迁移和侵袭作用及机制。方法 收集确诊肺腺癌并经影像学诊断已发生远处转移患者(转移组)或无远处转移患者(非转移组)以及正常人群(正常对照组)各30例外周血标本,分离单核细胞获得血浆上清液分离外泌体,同时取培养人肺腺癌细胞系A549细胞时收集的培养上清液分离外泌体,实时荧光定量PCR(qRT-PCR)法检测并比较组间外泌体lncRNA H19 mRNA表达差异。并采用慢病毒介导的lncRNA H19特异性小干扰RNA(shRNA)构建稳定敲低lncRNA H19的人肺腺癌A549细胞模型,荧光素酶验证lncRNA H19通过吸附结合微RNA-7(miR-7),划痕实验、Transwell实验检测稳定敲低lncRNA H19对A549细胞迁移、侵袭能力的影响,蛋白免疫印迹法检测稳定敲低lncRNA H19对miR-7及其下游的信号通路蛋白Kruppel样因子4(KLF4)和血管内皮生长因子(VEGF)蛋白表达水平的影响。结果 外泌体被成功分离。与非转移组肺腺癌患者相比,转移组肺腺癌患者外周血外泌体lncRNA H19 mRNA表达增加(P < 0.01)。A549细胞中,与对照细胞相比,稳定敲低lncRNA H19细胞的外泌体lncRNA H19 mRNA表达减少(P < 0.01)。 细胞划痕实验和Transwell实验显示,敲低lncRNA H19的A549细胞迁移和侵袭的能力下降。野生型 lncRNA H19 与 miRNA-7共转染后A549细胞荧光度值下降(P < 0.01),突变型lncRNA H19与miRNA共转染后A549细胞荧光度值未见明显变化(P > 0.05)。A549细胞中,稳定敲低lncRNA H19后KLF4和VEGF蛋白表达水平均有所下调(P均< 0.05)。结论 外泌体lncRNA H19可能在肺腺癌细胞迁移和侵袭过程中发挥作用,且这种作用可能与竞争性结合miR-7及KLF4/VEGF信号通路有关。
【关键词】长链非编码核糖核酸H19;微核糖核酸-7;侵袭;迁移
Regulatory effect of exosomes lncRNA H19 on migration and invasion of human lung adenocarcinoma cells through miR-7/KLF4/VEGF signaling pathway Wang Lin, Yi Jiqun, Jiang Gaofeng. Department of Oncology, Guangzhou Red Cross Hospital, Medical College of Jinan University, Guangzhou 510220, China
Corresponding author, Wang Lin, E-mail: Wanglin476@ext.jnu.edu.cn
【Abstract】Objective To investigate the effect and mechanism of exosomes long non-coding RNA H19 (lncRNA H19) on the migration and invasion of human lung adenocarcinoma cells. Methods Peripheral blood samples were collected from 30 lung adenocarcinoma patients with distant metastasis (metastasis group), 30 patients without distant metastasis (non-metastasis group) and 30 healthy controls (normal control group). The exosomes were isolated from plasma supernatant obtained from separating monocytes, and the exosomes were separated from culture supernatant collected from human lung adenocarcinoma cell line A549. The expression levels of exosomes lncRNA H19 mRNA were detected and compared among three groups by real-time fluorescence quantitative PCR (qRT-PCR). A549 cell models with stable H19 knockdown were constructed by lentivirus-mediated H19 shRNA. The binding between lncRNA H19 and microRNA-7 (miR-7) was verified by luciferase assay. The effect of stable lncRNA H19 knockdown upon the migration and invasion of A549 cells was evaluated by wound healing test and Transwell chamber test. The effect of stable lncRNA H19 knockdown upon the expression levels of KLF4 and VEGF proteins was assessed by Western blot. Results The exosomes were successfully isolated. Compared with the non-metastasis group, the expression level of lncRNA H19 mRNA in the peripheral blood exosomes in the metastasis group was significantly up-regulated (P < 0.01). Compared with the control cells, the expression level of lncRNA H19 mRNA in the exosomes of A549 cells with stable lncRNA H19 knockdown was significantly down-regulated (P < 0.01). Wound healing test and Transwell chamber test demonstrated that the migration and invasion of A549 cells were significantly decreased after lncRNA H19 knockdown. The fluorescent intensity of A549 cells was significantly decreased after wild-type lncRNA H19 was co-transfected with miR-7 (P < 0.01), whereas the fluorescent intensity of A549 cells did not significantly change after the co-transfection of mutant lncRNA H19 and miR-7 (P >
0.05). The expression levels of KLF4 and VEGF in the A549 cells were significantly down-regulated after stable lncRNA H19 knockdown (both P < 0.05). Conclusion Exosomes lncRNA H19 may play a role in the migration and invasion of lung adenocarcinoma cells, which is probably correlated with the competitive binding with miR-7 and the miR-7/KLF4/VEGF signaling pathway.
【Key words】Long non-coding RNA H19; MicroRNA-7; Invasion; Metastasis
非小细胞肺癌(NSCLC)约占所有肺癌的80%,肺腺癌属于NSCLC。癌细胞迁移被认为肿瘤晚期的主要特征[1]。因此,对肺腺癌细胞侵袭机制的更好理解将有助于开发更多的治疗策略。外泌体的作用被认为是传递细胞间信号交流,肿瘤细胞分泌外泌体中携带大量致癌成分可以刺激肿瘤细胞迁移的发生发展[2]。研究表明,肿瘤外泌体可以通过改变肿瘤微环境、上皮细胞-间充质转化(EMT)和肿瘤微血管生成等多方面促进肿瘤进程[3-4]。近年来针对外泌体中长链非编码RNA(lncRNA)的作用越来越受到重视。LncRNA H19在不同癌种类型和细胞背景中发挥的作用也不尽相同[5-6]。到目前为止,lncRNA H19在肺癌细胞迁移和侵袭中的作用仍然不尽为人所知。一般认为,lncRNA在细胞中发挥“分子海绵”的作用,可大量吸附并抑制微RNA(miR)对靶基因的作用。前期研究显示,lncRNA H19可以通过吸附miR-7,并参与调控肿瘤微环境和血管异常化等,影响肿瘤转移前微环境形成[7-8]。肿瘤的转移和生长主要依赖新生血管的形成。然而,目前关于lncRNA H19参与肺癌侵袭迁移的机制鲜有報道。本研究探讨外泌体lncRNA H19与miR-7的关系以及其在肺腺癌迁移侵袭中的作用及机制,现报告如下。
材料与方法
一、实验试剂
主要有RPMI-1640培养基(美国Gibco),胎牛血清(美国Gibco),外泌体提取试剂盒(德国Qiagen),Lipo3000转染试剂盒(美国Life),TRIzol总RNA抽提试剂(美国Life),逆转录试剂盒(日本TaKaRa),实时荧光定量PCR(qRT-PCR)试剂盒(日本TaKaRa),双荧光素酶报告基因试剂盒(美国Promega),GM130抗体(美国Affnity),CD63抗体(美国Affinity),Kruppel样因子4(KLF4)抗体(美国Affinity),血管内皮生长因子(VEGF)抗体(美国Affinity),甘油醛-3-磷酸脱氢酶(GAPDH)抗体(美国CST),HRP-山羊抗兔二抗(博奥龙)。本研究所使用的引物由上海捷瑞生物工程有限公司合成。
二、细胞培养
人肺腺癌细胞系A549细胞(南部战区总医院肿瘤科张为民教授惠赠)用含10%胎牛血清的RPMI-1640培养基,于37 ℃、5%CO2、饱和湿度培养箱内培养,每48 h更换培养液1次。培养瓶中的细胞生长到80% ~ 95% 融合时进行细胞传代或收集细胞铺板培养。
三、外泌体分离及鉴定
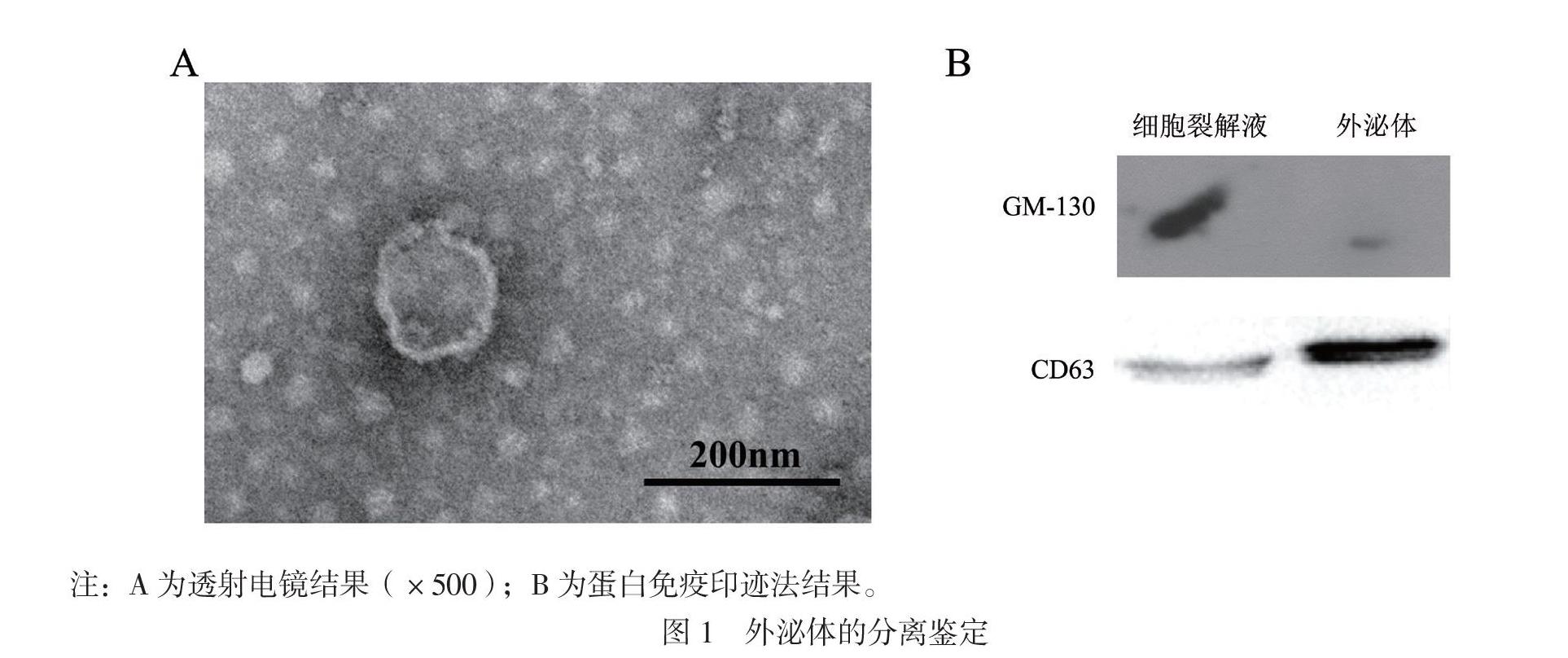
收集广州市红十字会医院确诊肺腺癌并经影像学诊断已发生远处转移患者(转移组)或无远处转移患者(非转移组)以及正常人群(正常对照组)各30例外周血标本。本研究经广州市红十字会医院医学研究伦理委员会批准(批件号2019-146-01),入组患者均已签署知情同意书。取患者外周血标本分离单核细胞获得血浆上清液,同时取培养A549细胞时收集的培养上清液,具体步骤按照试剂盒说明书执行。将提取外泌体按要求稀释至100 μg/100 μL。利用透射电镜对外泌体进行形态学鉴定,利用蛋白免疫印迹法分析外泌体的CD63和GM-130表达情况。
四、qRT-PCR
根据TRIzol试剂盒说明书从外泌体中提取总RNA。进行qRT-PCR测定以评估lncRNA H19 mRNA的表达,引物设计如下:lncRNA H19正向5-ATCGGTGCCTCAGCGTTCGG-3、反向5-C
TGTCCTCGCCGTCACACCG-3,GAPDH正向5-C
AAGAGCACAAGAGGAAGAGAG-3、反向5-CTA
CATGGCAACTGTGAGGAG-3。通过公式计算Ct值,具体为Ct = CtlncRNA H19-CtGAPDH,将lncRNA H19 mRNA表达水平标准化,每组设3个复孔,实验独立重复3次。
五、LncRNA H19 shRNA慢病毒的构建
将含有绿色荧光蛋白(GFP)报告基因的慢病毒载体LV-008(永诺生物)用于表达靶向lncRNA H19(5-CCAACATCAAAGACACCAT-3)和干扰对照(5-TGGTTTACATGTCGACTAA-3)序列的短发夹RNA(shRNA)。用包装载体将LV-008-shH19质粒转染到人胚肾细胞HEK 293T细胞(南部战区总医院肿瘤科张为民教授惠赠)中。转染72 h收集含有感染慢病毒的上清液,100 000×g超速离心2 h浓缩慢病毒,并重悬于磷酸盐缓冲液中。将A549细胞接种在24孔板中,并在5 ~ 10 μg/mL聚凝胺存在下用慢病毒感染,后用2 μg/mL嘌呤霉素筛选lncRNA H19敲低细胞10 ~ 15 d。
六、双荧光素酶报告基因检测
利用在线数据库RNAhybrid (https://bibiserv.cebitec.uni-bielefeld.de/rnahybrid/)预测分析结合位点结果(图5A),设计PCR引物,正向5-CAGGGACATGGCAGGGGACACAGGACAG-3,反向5-CGCCAGGTCCGGTGGACGTGACAAGCAGG-3。PCR产物经纯化回收后,连接到双荧光素酶报告基因pmirGLO质粒中,在野生型载体基础上,将结合位点GGCGGCGAG突变为CCGCCGCTC,并构建突变型载体。野生型和突变型分别命名为:pmirGLO-H19-WT和pmirGLO-H19-MUT,将各构建载体与miR-7共转染293T细胞。采用美国 Promega公司的双荧光素酶报告基因检测系统,依据实验说明进行操作,计算萤火虫荧光素酶值与海肾荧光值的比值反应荧光素酶活性。每组设3个复孔,实验独立重复3次。
七、划痕实验及Transwell实验
分离提取野生型或稳定干扰lncRNA H19的A549细胞外泌体,用其处理A549细胞12 h后,消化细胞,取对数生长期细胞,接种于6孔板,每孔约5×105个,待细胞达90%以上融合时,使用200 μL微量枪头均匀笔直划出划痕进行划痕实验。更换无血清培养液2 mL,置于37 ℃、5%CO2培养箱培养,于12、24 h倒置显微镜下拍照。将50 μL浓度为10%的Matrigel铺于Transwell小室底部,将外泌体处理后的A549细胞加入Transwell小室中,下室加入600 ?L含10%胎牛血清的完全培养基,置于培养箱中培养24 h。弃Transwell小室培养基,磷酸盐缓冲液洗3次,使用冰甲醇固定15 min,0.1%结晶紫溶液染色20 min,取出Transwell小室,用棉签擦去上室内的细胞和基质胶,显微镜下观察Transwell小室底部下室侧附着的细胞。每组设3个复孔,实验独立重复3次。
八、蛋白免疫印迹法分析
用磷酸盐缓冲液洗涤后,将细胞重新悬浮并加入裂解液(50 mmol/L Tris缓冲液,100 mmol/LNaCl,1%NP-40裂解液和0.5%脱氧胆酸盐,1 mmol/L苯甲基磺酰基)4 ℃中裂解20 min。然后通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,并转到聚二氟乙烯膜(德国Millipore)上。将膜在含有5%(质量/体积)脱脂奶粉的Tris-HCl缓冲盐溶液(TBST,含0.05%吐温20)封闭1 h,并与第一抗体(1∶1000)一起孵育2 h,然后洗涤3 h。用TBST洗涤3次,每次10 min,然后与二抗(1∶5000)孵育1 h。后用TBST洗涤3次,每次10 min,通过增强化学发光法(ECL, 瑞典Amersham Pharmacia Biotech)显色后化学发光成像系统成像,Band Scan图像分析软件进行积分光密度值分析。每组设3个复孔,实验独立重复3次。
九、统计学处理
使用SPSS 18.0进行分析,正态分布计量资料以表示,组间比较采用t检验。P < 0.05为差异有统计学意义。
结果
一、外泌体提取鉴定
透射电子显微镜下外泌体为直径40 ~ 100 nm的圆形囊泡样结构,见图1A。蛋白免疫印迹法检测外泌体跨膜标记分子GM130(高尔基体表面相关的分子,不会随囊泡转运至外泌体)与外泌体表面标记分子CD63的表达显示:与细胞裂解液相比,外泌体高表达CD63,低表达GM-130,见图1B。以上结果显示,外泌体被成功分离。
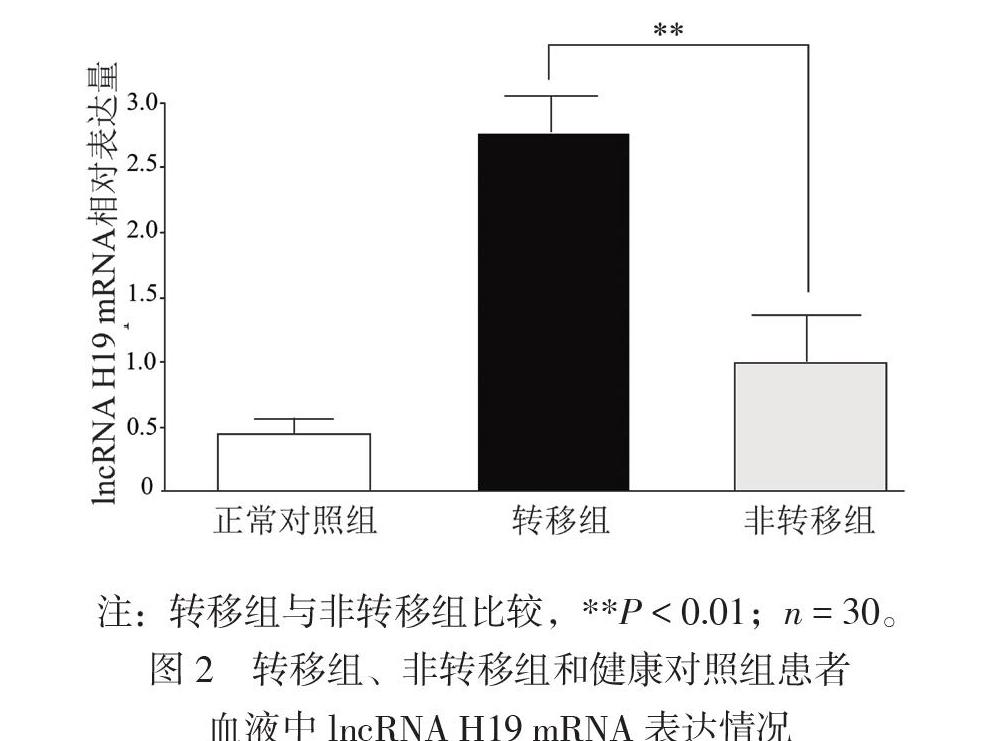
二、转移组、非转移组肺腺癌患者和正常对照组患者外周血外泌体lncRNA H19 mRNA表达情况
因lncRNA H19表达差异在肿瘤发生发展已明确,且本文重点研究其在肿瘤转移过程中作用,故后续分析仅在转移组与未发生转移组之间进行比较,结果显示与非转移组肺腺癌患者相比,转移组肺腺癌患者外周血外泌体中lncRNA H19 mRNA表达增加(t = 2.776,P < 0.01),提示lncRNA H19高表达可能与肺腺癌转移密切相关,见图2。
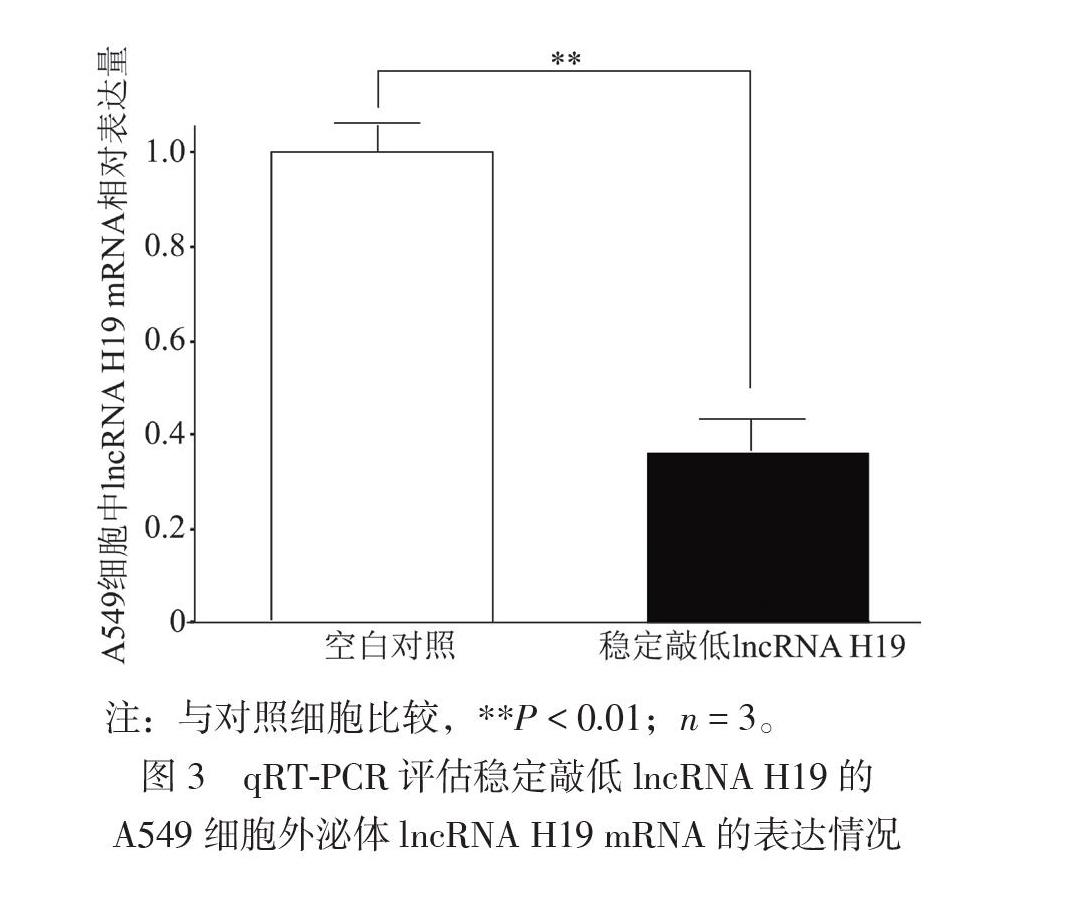
三、稳定敲低lncRNA H19的A549细胞构建
A549细胞中,与对照细胞相比,稳定敲低lncRNA H19细胞的外泌体中lncRNA H19 mRNA表達量减少约65%(t = 4.912,P < 0.01),见图3。
四、稳定敲低lncRNA H19对A549细胞迁移和侵袭能力的影响
细胞划痕实验和Transwell实验显示敲低lncRNA H19的A549细胞迁移和侵袭的能力下降,见图4。
五、双荧光素酶报告基因验证lncRNA H19和miR-7相互结合
在线数据库RNAhybrid预测结合位点结果见图5A。双荧光素酶报告基因检测结果显示,野生型 lncRNA H19 与 miR-7共转染后A549细胞荧光素酶相对活性下降(t = 5.347,P < 0.001),然而突变型lncRNA H19与miR共转染后A549细胞后荧光素酶相对活性未见明显变化(t = 0.676,P = 0.536),表明 lncRNA H19 与 miR-7之间存在特异性结合,见图5B。
六、敲除外泌体H19导致下游信号蛋白的变化
A549细胞中,稳定敲低lncRNA H19后KLF4 (t = 4.614,P < 0.01)和VEGF(t = 3.976, P < 0.05)蛋白表达水平均有所下调,见图6。
讨论
转移是肺癌治疗领域的重要挑战,更好地了解肿瘤转移的分子机制可能会发现更有效的治疗策略。外泌体作为细胞交流的信号传递者,含有大量的lncRNA,在细胞中起到miR分子的“海绵吸附”作用,从而解除miR对靶基因的抑制作用[7-9]。
本研究顯示,临床中发生转移的肺腺癌患者血清中外泌体lncRNA H19 mRNA表达比未发生转移的肺腺癌患者明显升高,这表明外泌体源性lncRNA H19与肺癌发生转移有密切关系。进一步的研究表明,外泌体中包含lncRNA H19,通过竞争性内源RNA方式吸附miR-7的表达,从而解除miR-7对KLF4的翻译抑制,并激活KLF4/VEGF信号通路进而参与调控细胞迁移和侵袭。
外泌体被认为是造成原发性肿瘤微环境改变的重要通讯介质[10-13]。外泌体是粒径为30 ~ 150 nm的小囊泡。这些小囊泡通过胞吐方式被释放到细胞外环境中并造成受体细胞相关表型改变[14-15]。因此,外泌体作为细胞间通讯的有效介质,在肿瘤发生中具有关键作用。多项研究显示肿瘤细胞分泌外泌体增多,且易于从血液中分离。细胞外泌体是近年来发现的一类细胞间信号传递的关键媒介,这种由细胞主动分泌的微小囊泡,可将细胞内大量信息物质打包,由一个细胞传递至另一个细胞,从而对靶细胞的性质进行跨细胞调控[16]。肿瘤细胞来源的外泌体通过转运具有生物功能的相关分子如蛋白质、miR和lncRNA等来调节靶细胞[17-20]。本研究中,稳定敲低表达外泌体lncRNA H19的A549细胞后,其迁移和侵袭能力下降。
LncRNA和miR的作用方式很多,其中之一就是lncRNA可以作为一种竞争性内源性RNA与miR相互作用,即所谓海绵吸附作用,参与靶基因的表达调控[20-21]。本研究显示,外泌体lncRNA H19通过竞争性结合miR-7,而miR-7能够通过靶向KLF4基因,KLF4是VEGF的转录激活因子[22-23]。稳定敲低外泌体lncRNA H19能够显著影响KLF4和VEGF的mRNA和蛋白表达水平,并抑制肿瘤细胞迁移和侵袭。
综上所述,肺癌细胞分泌的外泌体中含有lncRNA H19,它通过竞争性吸附miR-7,从而解除miR-7对KLF4的翻译抑制,并激活KLF4/VEGF信号通路进而参与调控细胞迁移和侵袭,敲低外泌体lncRNA H19可抑制肺腺癌细胞的迁移和侵袭。lncRNA H19可能在肺腺癌发展中起重要作用,可考虑作为转移性肺腺癌诊断和治疗研究的潜在靶点。值得注意的是,本研究仅涉及单一肿瘤细胞,其他不同肺癌细胞尤其是不同侵袭能力的肺癌细胞中有待进一步加以证实,且外泌体lncRNA H19参与肺癌侵袭转移是否存在其他作用机制仍需后续实验加以验证。
参 考 文 献
[1] Herbst R S, Morgensztern D, Boshoff C. The biology and management of non-small cell lung cancer. Nature, 2018, 553(7689):446-454.
[2] 成林杰, 郭海, 姚巧玲. 外泌体在非小细胞肺癌中的研究进展. 新医学,2021,52(1):5-9.
[3] Estrella Ibarra P, García-Solís P, Solís-Sáinz J C, Cruz-Hernández A. Expression of miRNA in obesity and insulin resistance: a review. Endokrynol Pol, 2021,72(1):73-80.
[4] Chen X, Liang H, Zhang J, Zen K, Zhang C Y. Horizontal transfer of microRNAs: molecular mechanisms and clinical applications. Protein Cell, 2012, 3(1):28-37.
[5] Shi X, Sun M, Liu H, Yao Y, Song Y. Long non-coding RNAs: a new frontier in the study of human diseases. Cancer Lett, 2013, 339(2):159-166.
[6] Jiang X, Yan Y, Hu M, Chen X, Wang Y, Dai Y, Wu D, Wang Y, Zhuang Z, Xia H. Increased level of H19 long noncoding RNA promotes invasion, angiogenesis, and stemness of glioblastoma cells. J Neurosurg, 2016, 2016(1):129-136.
[7] Ell B, Mercatali L, Ibrahim T, Campbell N, Schwarzenbach H, Pantel K, Amadori D, Kang Y. Tumor-induced osteoclast miRNA changes as regulators and biomarkers of osteolytic bone metastasis. Cancer Cell, 2013, 24(4):542-556.
[8] Wortzel I, Dror S, Kenific C M, Lyden D. Exosome-mediated metastasis: communication from a distance. Dev Cell, 2019, 49(3):347-360.
[9] Zhou W, Fong M Y, Min Y, Somlo G, Liu L, Palomares M R, Yu Y, Chow A, OConnor S T, Chin A R, Yen Y, Wang Y, Marcusson E G, Chu P, Wu J, Wu X, Li A X, Li Z, Gao H, Ren X, Boldin M P, Lin P C, Wang S E. Cancer-secreted miR-105 destroys vascular endothelial barriers to promote metastasis. Cancer Cell, 2014, 25(4):501-515.
[10] Chin A R, Wang S E. Cancer tills the premetastatic field: mechanistic basis and clinical implications. Clin Cancer Res, 2016, 22(15):3725-3733.
[11] Sleeman J P. The metastatic niche and stromal progression. Cancer Metastasis Rev, 2012, 31(3-4):429-440.
[12] Liu Y, Cao X. Characteristics and significance of the pre-metastatic Niche. Cancer Cell, 2016, 30(5):668-681.
[13] Chafe S C, Lou Y, Sceneay J, Vallejo M, Hamilton M J, McDonald P C, Bennewith K L, M?ller A, Dedhar S. Carbonic
anhydrase Ⅸ promotes myeloid-derived suppressor cell
mobilization and establishment of a metastatic niche by stimulating G-CSF production. Cancer Res, 2015, 75(6):996-1008.
[14] Pathania A S, Challagundla K B. Exosomal long non-coding RNAs: emerging players in the tumor microenvironment. Mol Ther Nucleic Acids, 2020, 23:1371-1383.
[15] Zhang W, Zhang C, Li W, Deng J, Herrmann A, Priceman S J, Liang W, Shen S, Pal S K, Hoon D S B, Yu H. CD8+ T-cell immunosurveillance constrains lymphoid premetastatic myeloid cell accumulation. Eur J Immunol, 2015, 45(1):71-81.
[16] Melo S A, Luecke L B, Kahlert C, Fernandez A F, Gammon S T, Kaye J, LeBleu V S, Mittendorf E A, Weitz J, Rahbari N, Reissfelder C, Pilarsky C, Fraga M F, Piwnica-Worms D, Kalluri R. Glypican-1 identifies cancer exosomes and detects early pancreatic cancer. Nature, 2015, 523(7559):177-182.
[17] Gabory A, Ripoche M A, Yoshimizu T, Dandolo L. The H19 gene: regulation and function of a non-coding RNA. Cytogenet Genome Res, 2006, 113(1-4):188-193.
[18] Shi X, Sun M, Liu H, Yao Y, Song Y. Long non-coding RNAs: a new frontier in the study of human diseases. Cancer Lett, 2013, 339(2):159-166.
[19] Jiang X, Yan Y, Hu M, Chen X, Wang Y, Dai Y, Wu D, Wang Y, Zhuang Z, Xia H. Increased level of H19 long noncoding RNA promotes invasion, angiogenesis, and stemness of glioblastoma cells. J Neurosurg, 2016, 2016(1):129-136.
[20] Keniry A, Oxley D, Monnier P, Kyba M, Dandolo L, Smits G, Reik W. The H19 lincRNA is a developmental reservoir of miR-675 that suppresses growth and Igf1r. Nat Cell Biol, 2012, 14(7):659-665.
[21] Jia P, Cai H, Liu X, Chen J, Ma J, Wang P, Liu Y, Zheng J, Xue Y. Long non-coding RNA H19 regulates glioma angiogenesis and the biological behavior of glioma-associated endothelial cells by inhibiting microRNA-29a. Cancer Lett, 2016, 381(2):359-369.
[22] Huang H, Wei L, Qin T, Yang N, Li Z, Xu Z. Circular RNA ciRS-7 triggers the migration and invasion of esophageal squamous cell carcinoma via miR-7/KLF4 and NF-κB signals. Cancer Biol Ther, 2019, 20(1):73-80.
[23] Li Y Z, Wen L, Wei X, Wang Q R, Xu L W, Zhang H M, Liu W C. Inhibition of miR-7 promotes angiogenesis in human umbilical vein endothelial cells by upregulating VEGF via KLF4. Oncol Rep, 2016, 36(3):1569-1575.
(收稿日期:2021-04-20)
(本文編辑:林燕薇)

