A型肉毒毒素对面部三叉神经痛大鼠疼痛的改善作用及对炎性介质IL-6、TNF-α表达的影响
庞伟 周琛 陈艳 李志明 张淑燕
【摘要】目的 探討A型肉毒毒素(BTA)对面部三叉神经痛(TN)大鼠疼痛的改善作用及对炎性介质IL-6、TNF-α表达的影响。方法 从50只大鼠中随机取10只为对照组,剩余大鼠用结扎眶下神经的方法建立TN模型,分为模型组、BTA低剂量组(BTA-L组)、BTA高剂量组(BTA-H组)和卡马西平组,每组各10只。BTA-L组、BTA-H组分别以9、18 μL/kg BTA溶液于手术同侧面部须垫处注射,对照组及模型组给予等量生理盐水,卡马西平组以5 mg/kg卡马西平灌胃。检测大鼠疼痛阈值,ELISA法检测血清中IL-6、TNF-α水平,HE染色观察眶下神经组织病理变化;蛋白免疫印迹法检测三叉神经节中核因子κB(NF-κB)p65、磷酸化型NF-κB p65(p-NF-κB p65)、p38丝裂原活化蛋白激酶(p38MAPK)、磷酸化型p38MAPK(p-p38MAPK)蛋白相对表达量。结果 与对照组比较,模型组注射1、2、3周时疼痛阈值降低(P均 < 0.05);与模型组比较,BTA-L组、BTA-H组、卡马西平组注射1、2、3周时疼痛阈值升高,且BTA-L组 < BTA-H组 < 卡马西平组(P均 < 0.05);与对照组比较,模型组血清中IL-6、TNF-α水平及p-NF-κB p65、p-p38MAPK蛋白相对表达量升高(P均< 0.05);与模型组比较,BTA-L组、BTA-H组、卡马西平组血清中IL-6、TNF-α水平及三叉神经节中p-NF-κB p65、p-p38MAPK蛋白相对表达量降低,且卡马西平组 < BTA-H组 < BTA-L组(P均< 0.05);HE染色显示,与模型组比较,BTA-L组、BTA-H组、卡马西平组神经纤维肿胀、排列、炎性细胞浸润等异常改变减轻,其中卡马西平组减轻更显著。结论 BTA可降低炎性介质IL-6、TNF-α水平,减轻炎症反应,改善面部疼痛,可能通过抑制NF-κB、p38MAPK信号通路发挥作用。
【关键词】三叉神经痛;A型肉毒毒素;白介素-6;肿瘤坏死因子-α
Effect of botulinum toxin type A on mitigating pain and the expression of serum inflammatory mediators IL-6 and TNF-α in rat models with facial trigeminal neuralgia Pang Wei, Zhou Chen, Chen Yan, Li Zhiming, Zhang Shuyan. Department of Neurology, the Second Affiliated Hospital of Guangdong Medical University, Zhanjiang 524003, China
Corresponding author, Zhou Chen, E-mail: wangzh324@ 126. com
【Abstract】Objective To evaluate the effect of botulinum toxin A (BTA) on mitigating pain and the expression levels of inflammatory mediators interleukin-6 (IL-6) and tumor necrosis factor-α (TNF-α) in rats with facial trigeminal neuralgia (TN). Methods Ten of the 50 rats were randomly selected into the control group. The infraorbital nerve of the remaining 40 rats was ligated to establish TN models. All TN models were divided into the model group, low-dose BTA (BTA-L) group, high-dose BTA (BTA-H) group and carbamazepine group (n = 10 in each group). In the BTA-L and BTA-H groups, 9 μL/kg and 18 μl/kg BTA were injected into the facial pad on the same side of the operation. An equivalent amount of normal saline was given in the control and model groups. In the carbamazepine group, 5 mg/kg carbamazepine was given by gastric gavage. The pain threshold was measured. The expression levels of serum IL-6 and TNF-α were detected by enzyme-linked immunosorbent assay (ELISA). The pathological changes of infraorbital nerve were observed by hematoxylin eosin (HE) staining. The relative expression levels of nuclear factor-κB (NF-κB)p65, phosphorylated NF-κB p65 (p-NF-κB p65), p38 mitogen-activated protein kinase (p38MAPK) and phosphorylated p38MAPK (p-p38MAPK) proteins in the trigeminal ganglion were quantitatively detected by Western blot. Results Compared with the control group, the pain threshold at 1, 2 and 3 weeks after injection was significantly decreased in the model group (all P < 0.05). Compared with the model group, the pain threshold at 1, 2 and 3 weeks after injection was significantly increased in the BTA-L, BTA-H and carbamazepine groups, with the highest pain threshold in the carbamazepine group, followed by the BTA-H and BTA-L groups (all P < 0.05). Compared with the control group, the expression levels of serum IL-6, TNF-α and the relative expression levels of p-NF-κB p65 and p-P38MAPK proteins were significantly up-regulated in the model group (all P < 0.05). Compared with the model group, the expression levels of serum IL-6, TNF-α and the relative expression levels of p-NF-κB p65 and p-P38MAPK proteins were remarkably down-regulated in the BTA-L, BTA-H and carbamazepine groups, with the highest levels in the BTA-L group, followed by the BTA-H and carbamazepine groups (all P < 0.05). HE staining showed that compared with the model group, the nerve fiber swelling, arrangement, inflammatory cell infiltration and other abnormal changes were alleviated in the BTA-L, BTA-H and carbamazepine groups, especially in the carbamazepine group. Conclusion BTA can down-regulate the expression levels of serum inflammatory mediators IL-6 and TNF-α, mitigate inflammatory response and ease facial pain probably by inhibiting the NF-κB and p38MAPK signaling pathways.
【Key words】Trigeminal neuralgia; Botulinum toxin type A; Interleukin-6; Tumor necrosis factor-α
面部三叉神经痛(TN)指面部三叉神经部位的突发性疼痛,是常见脑神经疾病,多发于中老年人,且女性群体发病率略高于男性,患者以面部一侧三叉神经分布区阵发性疼痛为主要临床表现[1-2]。TN主要有原发性和继发性两大类,且以原发性疼痛较为常见。临床上TN的治疗方式以药物及手术为主,由于药物会使患者产生晕眩、嗜睡和消化不良等不同程度不良反应,手术方式存在局限性等原因,小部分患者无法应用现有治疗方式进行医治[3-4]。A型肉毒毒素(BTA)是肉毒杆菌在繁殖过程中分泌的生物毒性蛋白,可与胆碱能神经末梢SNAP-25等蛋白产生作用,抑制乙酰胆碱释放,减少肌肉收缩和痉挛[5]。研究表明,BTA可通过减少颅内疼痛物质释放、增加镇痛物质合成,对TN大鼠模型具有治疗作用[6]。本实验通过对眶下神经进行结扎,建立TN大鼠模型,明确BTA对大鼠疼痛的改善作用及可能机制。
材料与方法
一、实验材料
1.实验动物
7周龄SPF级SD大鼠50只,雌雄各半,体质量(250±10)g,购自贵州泛特尔生物技术有限公司,生产许可证号:SYXK(黔)2015-004,适应性饲喂5 d。本实验符合动物实验相关伦理规范(伦理号IACYC2017-08)。
2.试剂及仪器
治疗用BTA注射液(兰州生物制品研究所有限责任公司),卡马西平片(北京诺华制药有限公司),Von Frey filaments测试仪(上海玉研科学仪器有限公司),IL-6 ELISA检测试剂盒(上海恒远生物科技有限公司)、TNF-α ELISA检测试剂盒(武汉艾美捷科技有限公司),兔抗大鼠核因子-κB(NF-κB)p65抗体一抗、兔抗大鼠磷酸化型NF-κBp65 (p-NF-κB p65)抗体一抗、兔抗大鼠p38丝裂原活化蛋白激酶(p38MAPK)抗体一抗、兔抗大鼠磷酸化型p38MAPK(p-p38MAPK)抗体一抗(北京百奥莱博科技公司),辣根过氧化物酶标记的山羊抗兔二抗(河北翰林生物科技有限公司),SAF-680T酶标仪(上海巴玖实业有限公司),WMS-1030显微镜(上海豫光仪器有限公司)。
二、实验方法
1.分组及建模
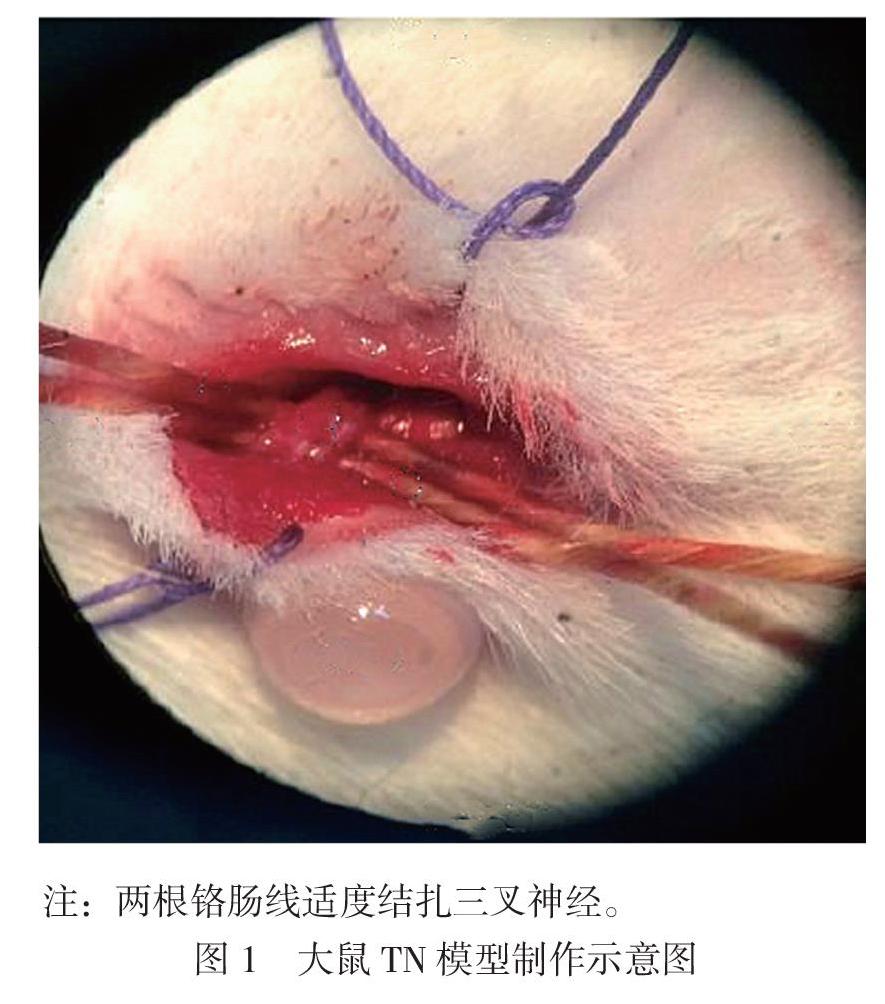
按照随机数表法取10只大鼠为对照组,其余大鼠用结扎眶下神经的方法建立TN模型。参照文献[7]建立TN模型:用2%戊巴比妥钠对大鼠进行腹腔注射,注射量为0.2 mL/100 g,待麻醉后,大鼠呈仰卧位置于实验台上,将头部及四肢固定后,牵出大鼠舌体并拉向一侧,常规碘伏消毒后,于口内第一磨牙沿右侧龈颊边缘方向做1 cm纵向切口,逐层分离周围组织后,暴露眶下神经,以两根铬肠线(5-0) 结扎,两根线之间间隔2 mm左右,结扎力度为镜下神经直径稍变细,但不影响血液循环,见图1。对照组大鼠仅暴露眶下神经,不进行结扎,其余同建模大鼠,所有手术操作均在无菌条件下进行,大鼠出现明显搔脸、攻击、退缩行为表明建模成功。建模结束后,无大鼠死亡,将建模大鼠分为模型组、BTA低剂量组(BTA-L组)、BTA高剂量组(BTA-H组)和卡马西平组,每组各10只,清醒后于鼠笼内常规饲养2周。
2.干 预
按照成人和动物给药剂量换算大鼠给药剂量。卡马西平成人临床剂量为55.5 mg/kg,换算成大鼠等效剂量为5 mg/kg。卡马西平组大鼠给药前,将卡马西平片磨成粉状,用生理盐水配制成5 mg/mL的卡马西平生理盐水溶液,给药时以5 mg/kg卡马西平生理盐水溶液灌胃。BTA成人临床剂量为100 μL/kg,换算成大鼠等效剂量9 μL/kg。BTA-L组、BTA-H组分别以等效剂量、2倍等效剂量给药,即9、18 μL/kg BTA溶液注射于手术同侧面部须垫处3处位置,每处注射10 μL。对照组及模型组给予等量生理盐水进行注射。各组均给药1次,进行后续试验。
3.测定疼痛阈值
分别在建模前、BTA或卡马西平生理盐水溶液及生理盐水注射前、注射1、2、3周时,测定各组大鼠疼痛阈值。大鼠于鼠笼内适应同时,手持Von Frey filaments缓慢靠近大鼠,每隔30 s对手术同侧面部须垫区反复触碰3 ~ 5次,10 min后,使大鼠适应物体触碰及周围环境,待大鼠处于放松状态后,进行疼痛阈值测定。持Von Frey filaments测试仪,用前端纤维丝触碰大鼠手术同侧面部须垫区,刺激力度从0.008 g开始,刺激3次,时间间隔为10 s,若其中≥2次无阳性反应,则增加刺激力度,至大鼠在同一刺激力度下出现2次阳性反应时停止,该刺激力度即为大鼠机械疼痛阈值。若刺激力度达到26 g时,≥2次无阳性反应,则记录疼痛阈值为26 g。
阳性反应标准:①搔脸行为,在触碰部位,连续不少于3次的搔脸行为;②逃跑或攻击行为,表现为避免与刺激物进行接触,被动远离或主动抓咬Von Frey filaments测试仪;③退缩行为,触碰时头部退缩,同时为逃避刺激而躲至一角或物料下方。
4.血清中IL-6、TNF-α水平检测
注射后3周,将各组大鼠尾静脉取血3 mL,经3000 转/分、半径8 cm离心后,取上清,严格按照ELISA检测试剂盒说明书进行操作,于450 nm波长处读取酶标仪吸光度[D(450)]值,根据标准曲线,检测血清中IL-6、TNF-α水平。
5.眶下神经组织病理学观察
采血后,用2%戊巴比妥将大鼠麻醉,使其呈仰卧位固定于实验台上,于大鼠口内第一磨牙沿右侧龈颊边缘方向做1 cm纵向切口,分离周围组织后,暴露眶下神经,切取包含結扎部位在内约5 mm长眶下神经组织,取1/2保存于-80℃,用于蛋白检测。剩余部分置于4%多聚甲醛中固定,石蜡包埋并切片,切片厚度4 μm,取切片,经二甲苯脱蜡并用乙醇吸干水分,用苏木素进行染色3 min后浸入返蓝液中1 min,水洗后于乙醇内脱水,滴加伊红溶液进行染色2 min,自来水洗涤后,用乙醇脱水,二甲苯透明、中性树脂封片,显微镜下观察神经组织病理变化。
6.三叉神经节中NF-κB p65、p-NF-κB p65、p38MAPK、p-p38MAPK蛋白相对表达情况
取各组剩余眶下神经组织,置于1 mL玻璃匀浆器中,并加入2 mL的RIPA裂解液,冰上充分匀浆后,转移至1.5 mL离心管中,经12 000 转/分、半径8 cm离心15 min后,取上清,BCA法测定蛋白浓度。将离心管置于沸水中,使蛋白变性,进行SDS-PAGE电泳;转移至PVDF膜中,加入含5%脱脂奶粉的TBST溶液封闭1 h,分别加入兔抗大鼠NF-κB p65抗体一抗(1∶1000)、兔抗大鼠p-NF-κB p65抗体一抗(1∶1000)、兔抗大鼠p38MAPK抗体一抗(1∶1000)、兔抗大鼠p-p38MAPK抗体一抗(1∶1000),4℃培养箱孵育过夜并洗涤后,次日加入辣根过氧化物酶标记的山羊抗兔二抗(1∶2000),室温孵育2 h并洗涤,加入ECL化学反应液孵育,并曝光显影,测定蛋白条带积分光密度值,以β-actin为内参,测定目的蛋白相对表达量。
三、统计学处理
采用SPSS 20.0进行数据分析,计量资料用表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。重复测量资料先采用重复测量资料方差分析,交互效应有统计学意义时,采用单因素方差分析和LSD-t检验及配对t检验分析单独效应。P < 0.05为差异有统计学意义。
结果
一、各组小鼠疼痛阈值比较
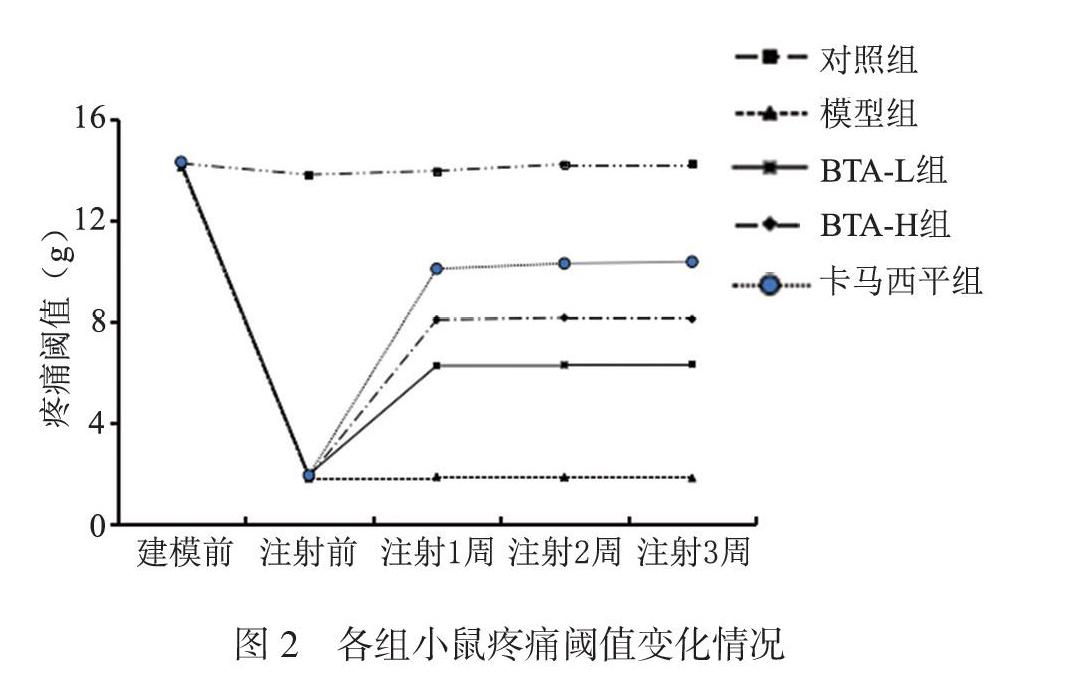
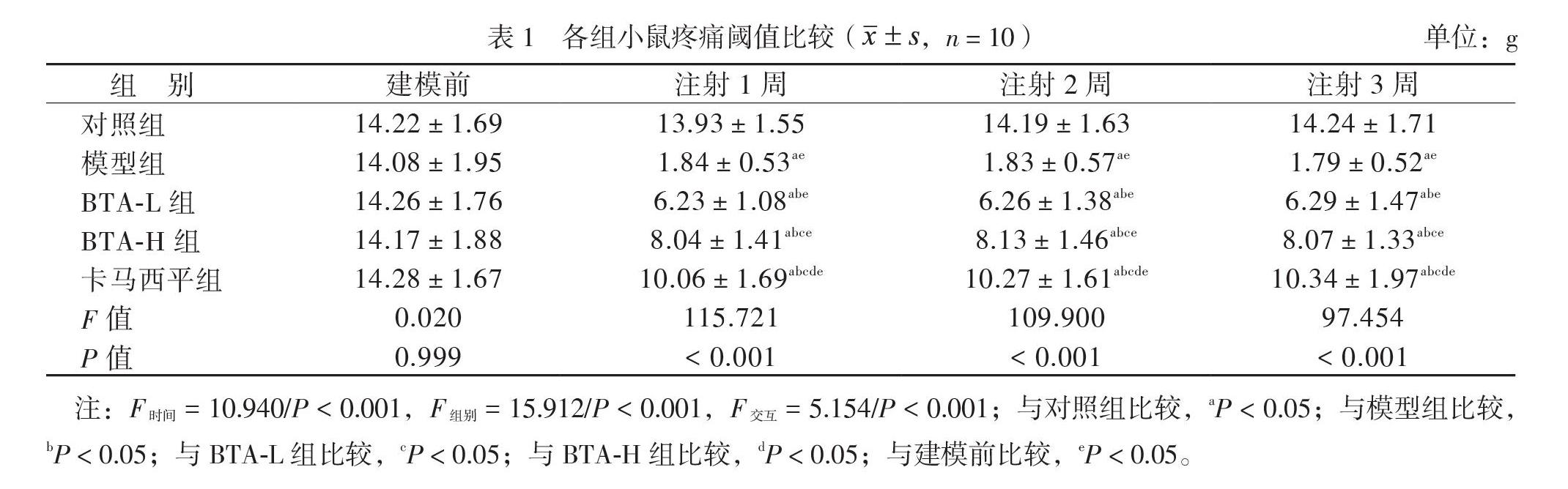
注射1、2、3周时疼痛阈值组间比较,差异有统计学意义(P均< 0.05);建模前疼痛阈值组间比较,差异无统计学意义(P > 0.05)。与对照组比较,模型组注射1、2、3周时疼痛阈值均降低(P均< 0.05);与模型组比较,BTA-L组、BTA-H组、卡马西平组注射1、2、3周时疼痛阈值均升高,且BTA-L组 < BTA-H组 < 卡马西平组(P均< 0.05),見图2、表1。
二、各组小鼠血清中IL-6、TNF-α水平比较
IL-6、TNF-α水平组间比较,差异有统计学意义(P均< 0.05)。与对照组比较,模型组血清中IL-6、TNF-α水平升高(P均< 0.05);与模型组比较,BTA-L组、BTA-H组、卡马西平组血清中IL-6、TNF-α水平降低,且卡马西平组 < BTA-H组 < BTA-L组(P均< 0.05),见表2。
三、眶下神经组织病理学观察
HE染色显示对照组眶下神经纤维呈乳白色,分布较均匀,胞核呈紫色;模型组可见眶下神经纤维明显肿胀,呈苍白色,排列较紊乱,有大量炎性细胞浸润;与模型组比较,BTA-L组、BTA-H组、卡马西平组神经纤维肿胀、排列、炎性细胞浸润等异常改变减轻,其中卡马西平组减轻更明显,见图3。
四、三叉神经节中NF-κB p65、p-NF-κB p65、p38MAPK、p-p38MAPK蛋白相对表达量比较
三叉神经节中p-NF-κB p65、p-p38MAPK蛋白相对表达量组间比较,差异有统计学意义(P均< 0.05);NF-κB、p38MAPK蛋白相对表达量组间比较,差异无统计学意义(P均< 0.05)。与对照组比较,模型组p-NF-κB p65、p-p38MAPK蛋白相对表达量升高(P均< 0.05);与模型组比较,BTA-L组、BTA-H组、卡马西平组三叉神经节中p-NF-κB p65、p-p38MAPK蛋白相对表达量降低,且卡马西平组 < BTA-H组 < BTA-L组(P均< 0.05),见表3、图4。
讨论
原发性TN发病机制尚不明确,现普遍认为是由动、静脉血管压迫引起三叉神经功能障碍,诱发因素主要包括神经损伤、遗传倾向、精神压力及免疫功能障碍等[8]。典型的TN常无法自愈,通过相关药物治疗虽可缓解症状或治愈,但复发率较高,且长期使用对肝、肾不良反应较大,手术治疗虽预后较好,但术后易感染,出现发红流脓等症状。BTA作为神经麻醉剂,可用于治疗眼睑痉挛、面部痉挛及局灶性肌张力障碍,通过麻痹肌肉神经,可阻断运动神经及肌肉之间信息传导,达到使肌肉停止痉挛的目的[9-10]。本研究通过建立大鼠TN模型,明确BTA对TN改善作用及对炎症相关指标的影响,为TN患者炎症改善提供新思路。
炎症是机体对刺激的防御反应,与慢性疼痛的产生密切相关,多项研究均显示,神经性疼痛常伴随炎症反应,临床TN患者组织病理中常观察到在三叉神经节及感觉根内有炎性细胞浸润[11-12]。正常情况下,机体末梢神经中含血管内皮细胞、纤维细胞等多种非神经细胞,以维持机体内稳态,当神经的完整性被破坏而受损时,部分非神经细胞被激活,从而释放IL-6、TNF-α促炎因子等多种物质[13]。IL-6具有多种生物学功能,主要参与炎症反应、细胞免疫等过程,还可作为神经营养因子,诱导神经元的分化;TNF-α不仅可以抑制肿瘤细胞生长,还可影响多种炎症介质的产生和分泌过程。研究表明,BTA可在进入感觉神经末梢后,通过轴突运输到中枢神经系统,发挥镇痛效果[14]。Shi等[15]研究显示,BTA可以通过抑制小胶质细胞活化,抑制TNF-α等炎症相关因子的释放,缓解在慢性关节炎疼痛中发生的神经炎症,作为潜在治疗药物。本研究结果中,BTA可明显提高TN模型大鼠疼痛阈值,降低血清中炎症因子水平,改善眶下神经组织病理变化,且改善效果与浓度成正比。
NF-κB广泛存在于真核细胞内,参与细胞内信号传递,与免疫、炎症基因表达密切相关,参与神经系统的多种生理、病理过程[16]。NF-κB可介导免疫炎症反应,通过调控多种因子的表达参与炎症过程,且在炎症部位高表达。炎症反应中,NF-κB活性增强,当NF-κB活性被抑制而降低时,炎症反应减轻[17]。研究显示,BTA可通过减少小胶质细胞中NF-κB磷酸化发挥抗炎作用,在减少炎症相关因子产生的同时,发挥镇痛作用[18]。p38MAPK是与炎症密切相关的通路,在致炎因子等的作用下可被激活,参与机体多种生理、病理过程。范丽苑等[19]研究显示,在神经损伤及炎症的动物模型中,p38MAPK被激活,参与神经损伤及炎性痛觉形成。p38MAPK可在紫外线、促炎因子等应激因素刺激下发生磷酸化而被激活,进而调控NF-κB表达及激活,参与多种因子的调节。BTA可以通过阻断p38MAPK的激活,抑制脂多糖诱导的巨噬细胞炎症因子的释放[20]。本研究显示,卡马西平与BTA均可明显降低TN模型大鼠三叉神经节中NF-κB、p38MAPK蛋白磷酸化水平,这提示卡马西平与BTA均可抑制NF-κB、p38MAPK信号通路,两种药物在NF-κB、p38MAPK信号通路中均发挥一定作用。而且,BTA抑制NF-κB、p38MAPK信号通路的作用呈剂量依赖性,这也可能是BTA发挥减轻TN大鼠疼痛及炎症反应的重要作用机制之一。
綜上所述,BTA可减轻炎症反应,TN模型大鼠改善面部疼痛,可能是通过抑制NF-κB、p38MAPK信号通路发挥作用,可为临床TN的治疗提供参考。
参 考 文 献
[1] Hughes M A, Frederickson A M, Branstetter B F, Zhu X, Sekula R F Jr. MRI of the trigeminal nerve in patients with trigeminal neuralgia secondary to vascular compression. AJR Am J Roentgenol,2016,206(3):595-600.
[2] Solaro C M, Ferriero G. Refactory trigeminal neuralgia succ-essfully treated by combination therapy (Pregabalin plus Lamotrigine). Mult Scler Relat Disord,2018,25:165-166.
[3] Mitsikostas D D, Pantes G V, Avramidis T G, Karageorgiou K E, Gatzonis S D, Stathis P G, Fili V A, Siatouni A D, Vikelis M. An observational trial to investigate the efficacy and tolerability of levetiracetam in trigeminal neuralgia. Headache,2010,50(8):1371-1377.
[4] Magown P, Ko A L, Burchiel K J. The spectrum of trigeminal neuralgia without neurovascular compression. Neurosurgery,2019,85(3):E553-E559.
[5] Ausk B J, Gross T S, Bain S D. Botulinum toxin-induced muscle paralysis inhibits heterotopic bone formation. Clin Orthop Relat Res,2015,473(9):2825-2830.
[6] Zhang Y, Su Q, Lian Y, Chen Y. Botulinum toxin type A reduces the expression of transient receptor potential melastatin 3 and transient receptor potential vanilloid type 4 in the trigeminal subnucleus caudalis of a rat model of trigeminal neuralgia. Neuroreport,2019,30(10):735-740.
[7] Ding W, You Z, Shen S, Yang J, Lim G, Doheny J T, Chen L,
Zhu S, Mao J. An improved rodent model of trigeminal neuropathic pain by unilateral chronic constriction injury of distal infraorbital nerve. J Pain,2017,18(8):899-907.
[8] Chen G Q, Wang X S, Wang L, Zheng J P. Arterial compression of nerve is the primary cause of trigeminal neuralgia. Neurol Sci,2014,35(1):61-66.
[9] Dong H, Fan S, Luo Y, Peng B. Botulinum toxin relieves anxiety and depression in patients with hemifacial spasm and blepharospasm. Neuropsychiatr Dis Treat,2018,15:33-36.
[10] Bruno V, Freitas M E, Mancini D, Lui J P, Miyasaki J, Fox S H. Botulinum toxin type a for pain in advanced parkinsons disease. Can J Neurol Sci,2018,45(1):23-29.
[11] Ericson H, Abu Hamdeh S, Freyhult E, Stiger F, B?ckryd E, Svenningsson A, Gordh T, Kultima K. Cerebrospinal fluid biomarkers of inflammation in trigeminal neuralgia patients operated with microvascular decompression. Pain,2019,160(11):2603-2611.
[12] Yao Y, Chang B, Li S. Relationship of inflammation with trigeminal neuralgia. J Craniofac Surg,2020,31(2):e110-e113.
[13] Kiguchi N, Kobayashi Y, Kadowaki Y, Fukazawa Y, Saika F, Kishioka S. Vascular endothelial growth factor signaling in injured nerves underlies peripheral sensitization in neuropathic pain. J Neurochem,2014,129(1):169-178.
[14] Zhang H, Lian Y, Xie N, Chen C, Zheng Y. Single-dose botulinum toxin type a compared with repeated-dose for treatment of trigeminal neuralgia: a pilot study. J Headache Pain,2017,18(1):81.
[15] Shi X, Gao C, Wang L, Chu X, Shi Q, Yang H, Li T. Botulinum toxin type A ameliorates adjuvant-arthritis pain by inhibiting microglial activation-mediated neuroinflammation and intracellular molecular signaling. Toxicon,2020,178:33-40.
[16] K?rner A, Schlegel M, Kaussen T, Gudernatsch V, Hansmann G, Schumacher T, Giera M, Mirakaj V. Sympathetic nervous system controls resolution of inflammation via regulation of repulsive guidance molecule A. Nat Commun,2019,10(1):633.
[17] Yi H, Peng R, Zhang L Y, Sun Y, Peng H M, Liu H D, Yu L J,
Li A L, Zhang Y J, Jiang W H, Zhang Z. LincRNA-Gm4419 knockdown ameliorates NF-κB/NLRP3 inflammasome-mediated inflammation in diabetic nephropathy. Cell Death Dis,2017,8(2):e2583.
[18] Rojewska E, Piotrowska A, Popiolek-Barczyk K, Mika J. Botulinum toxin type A-A modulator of spinal neuron-glia interactions under neuropathic pain conditions. Toxins (Basel),2018,10(4):145.
[19] 范麗苑, 涂玲. 大鼠舌下神经压榨伤后p38MAPK的活化及外源性神经生长因子促神经再生作用的研究. 华西口腔医学杂志, 2010, 28(5):479-483.
[20] Kim Y J, Kim J H, Lee K J, Choi M M, Kim Y H, Rhie G E, Yoo C K, Cha K, Shin N R. Botulinum neurotoxin type a induces TLR2-mediated inflammatory responses in macrophages. PLoS One,2015,10(4):e0120840.
(收稿日期:2020-12-07)
(本文编辑:杨江瑜)

