UPLC-MS法同时测定马兜铃果皮及种子中5种成分
高昌琨, 高玉菊, 张 楠, 胡 蝶
(1.安徽医科大学第一附属医院药剂科,国家中医药管理局中药化学三级实验室,安徽 合肥 230022;2.安徽中医药大学第二附属医院药剂科,安徽 合肥 230061)
马兜铃为马兜铃科植物北马兜铃或马兜铃的干燥成熟果实,前者主要分布在东北、华北等地,后者分布于河南、山东及江南地区,其主要成分为马兜铃酸类。自1993年以来,陆续有马兜铃酸导致终末期肾病(ESRD) 及上尿路上皮癌(UUC) 等严重不良反应的报道[1-3],对药材中马兜铃酸类成分进行严格的含量控制对于相关药材和复方的质量安全尤为重要。
马兜铃酸为硝基菲类羧酸化合物,主要有马兜铃酸A、B、C、D[4-6],文献已有对以上4种成分同时进行含量监控的报道[7-9],或者检测马兜铃总酸的含量[10-12]。马兜铃内酰胺为马兜铃酸在人体内的代谢物,可以和DNA结合形成难以降解的加合物,持续损害人肾小管,因此也具有和马兜铃酸相似的肾脏毒性[13-16]。本实验采用UPLC-TOF/MS首次对马兜铃中5种毒性成分同时进行定量测定,从马兜铃酸类和内酰胺类两大类毒性成分更全面评价马兜铃相关药材的毒性,以期为其合理安全使用提供数据支撑。
此外,马兜铃种子和果皮中马兜铃酸类成分含量差异较大[11],本实验通过收集多批马兜铃主产地药材,通过分别测定果皮和种子中相应5种成分的含量及加合量,探讨马兜铃药材区分用药部位(以果皮入药)入药的可能性。
1 材料
1.1 仪器 Agilent 1260系列高效液相色谱、Agilent 6520四级杆飞行时间(Q-TOF)质谱仪(美国安捷伦公司);KQ2200B 超声波清洗仪(昆山市超声仪器有限公司);BT25S电子天平(德国赛多利斯科学仪器有限公司);Milli-Q纯水器(美国Millpore公司)。
1.2 试剂与药物 药材信息见表1,经安徽中医药大学金传山教授鉴定为北马兜铃AristolochiacontortaBge. 或马兜铃AristolochiadebilisSieb. et Zucc.的干燥成熟果实,区分为果皮和种子部位。对照品马兜铃酸A、B、C、D及马兜铃内酰胺均购于上海诗丹德标准技术服务有限公司,纯度大于98%。乙腈(色谱纯,美国Fisher公司);甲酸(色谱纯,国药集团化学试剂有限公司);水为Millpore Milli-Q超纯水。
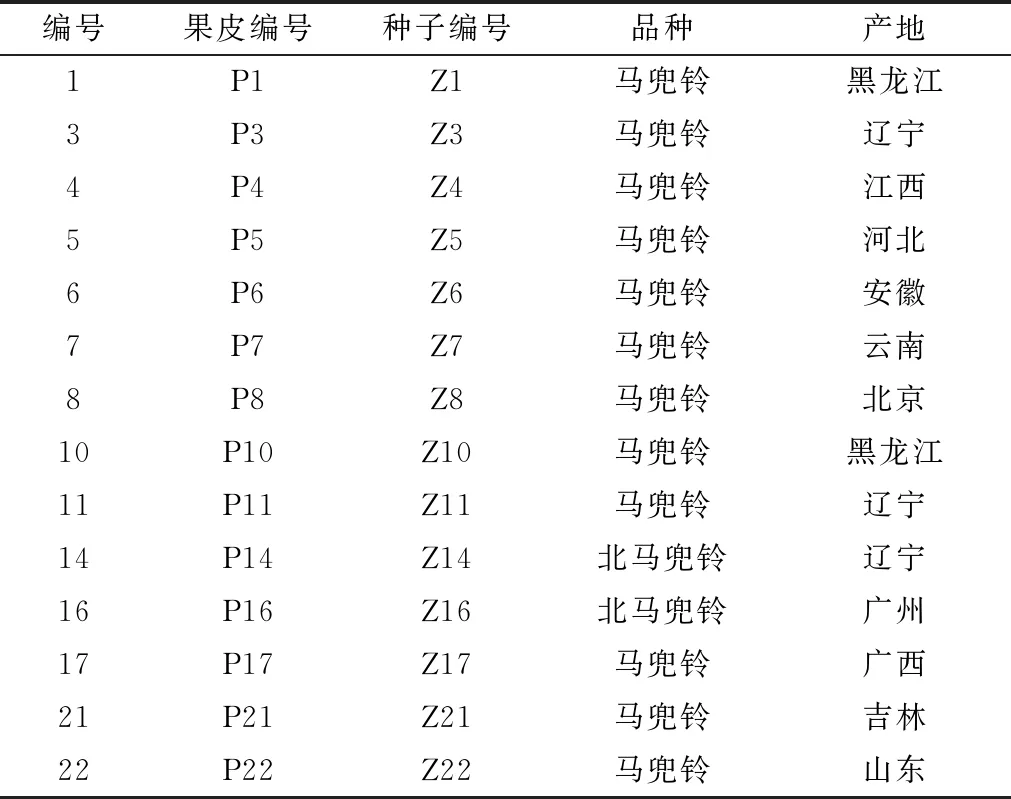
表1 样品信息
2 方法与结果
2.1 溶液配制
2.1.1 对照品溶液 称取5种对照品适量,精密称定,置于5 mL量瓶中,加甲醇溶解,定容,摇匀,即得贮备液,混合并稀释成25、6.25、1.5、0.8、0.4、0.2、0.05 μg/mL的溶液,即得。
2.1.2 供试品溶液制备 称取马兜铃果皮1 g,加入80%甲醇-0.1%甲酸10 mL,超声提取2次,每次30 min,12 000 r/min离心10 min,取上清液,用水稀释4倍。HPD-100树脂小柱(3 mL)先用5 mL甲醇活化,再用5 mL水平衡。马兜铃提取液以3 mL/min体积流量上样,先用5 mL水洗脱除杂,再用5 mL 80%甲醇洗脱,收集80%甲醇洗脱流分,N2吹干,80%甲醇-0.1%甲酸反溶,0.22 μm微孔滤膜过滤,取续滤液,即得。
2.2 方法学考察
2.2.1 色谱条件 Zorbax C18色谱柱(2.1 mm×100 mm, 1.8 μm);流动相0.1%甲酸(A)-乙腈(B);梯度洗脱(0~2 min,5%B;3~14 min,5%~95%B;14~14.5 min,95%~5%B;14.5~17 min,5%B;体积流量0.3 mL/min;柱温40 ℃;进样量3 μL。
2.2.2 质谱条件 ESI离子源;正离子模式检测;喷嘴电压500 V;雾化气压力35 psi(1 psi=6.895 kPa);氮气体积流量8 L/min; 干燥气温度300 ℃;鞘气体积流量10 L/min; 鞘气温度300 ℃。定量离子见表2。数据分析采用 Agilent MassHunter Qualitative Analysis软件(Version B.04.00)。
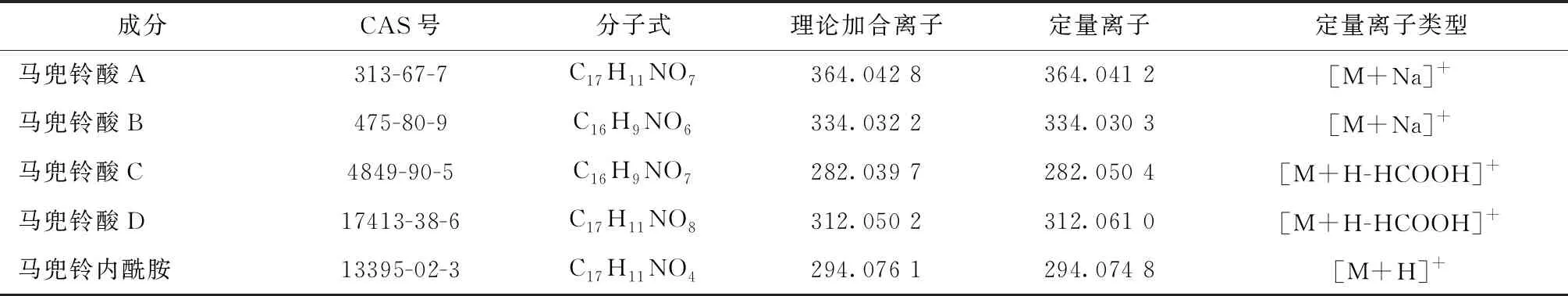
表2 5种成分定量离子(正离子模式)
2.2.3 系统适用性考察 精密吸取对照品、供试品适量,在“2.2.1”“2.2.2”项条件下进行分析,结果见图1,可知5种成分与相邻峰得到很好地分离。
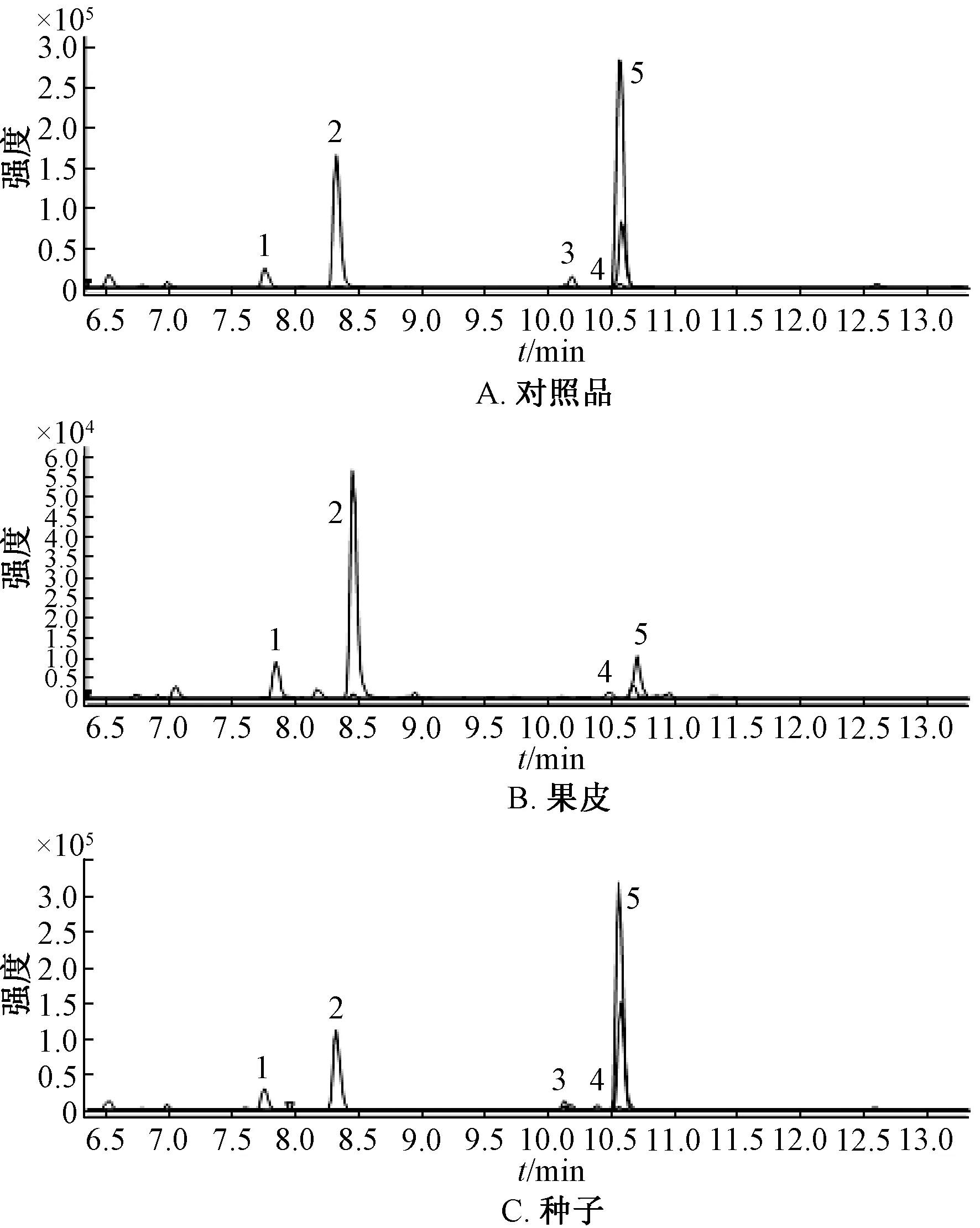
1.马兜铃酸C 2.马兜铃酸D 3.马兜铃酸B 4.马兜铃内酰胺 5.马兜铃酸A
2.2.4 线性关系考察 取“2.1.1”项下对照品溶液,在“2.2.1”“2.2.2”项条件下进样3 μL分析。以质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,结果见表3,可知各成分在各自范围内线性关系良好。

表3 各成分线性关系
2.2.5 精密度试验 精密吸取“2.1.1”项下0.8 μg/mL对照品溶液,在“2.2.1”“2.2.2”项条件下进样4次,连续测定3 d,测得马兜铃酸A、B、C、D及马兜铃内酰胺日内精密度RSD分别为1.87%、10.00%、3.43%、3.92%、3.64%,日间精密度RSD分别为7.21%、16.12%、7.33%、7.36%、17.43%,表明仪器精密度良好。
2.2.6 稳定性试验 取“2.1.2”项下供试品溶液,在“2.2.1”“2.2.2”项条件下于0、4、8、12、24 h进样,测得马兜铃酸A、B、C、D及马兜铃内酰胺峰面积RSD分别为5.29%、14.03%、6.96%、9.69%、12.75%,表明溶液在24 h 内稳定性良好。
2.2.7 重复性试验 取同一批药材粉末6份,按“2.1.2”项下方法制备供试品溶液,在“2.2.1”“2.2.2”项条件下进样,测得马兜铃酸A、B、C、D及马兜铃内酰胺含量RSD分别为4.43%、13.23%、6.98%、5.08%、7.62%,表明该方法重复性良好。
2.2.8 加样回收率试验 精密称取各成分含量已知(1号)的种子粉末6份,每份约0.5 g, 精密加入适量对照品溶液,按“2.1.2”项下方法制备供试品溶液,在“2.2.1”“2.2.2”条件下进样,计算回收率,结果见表4。
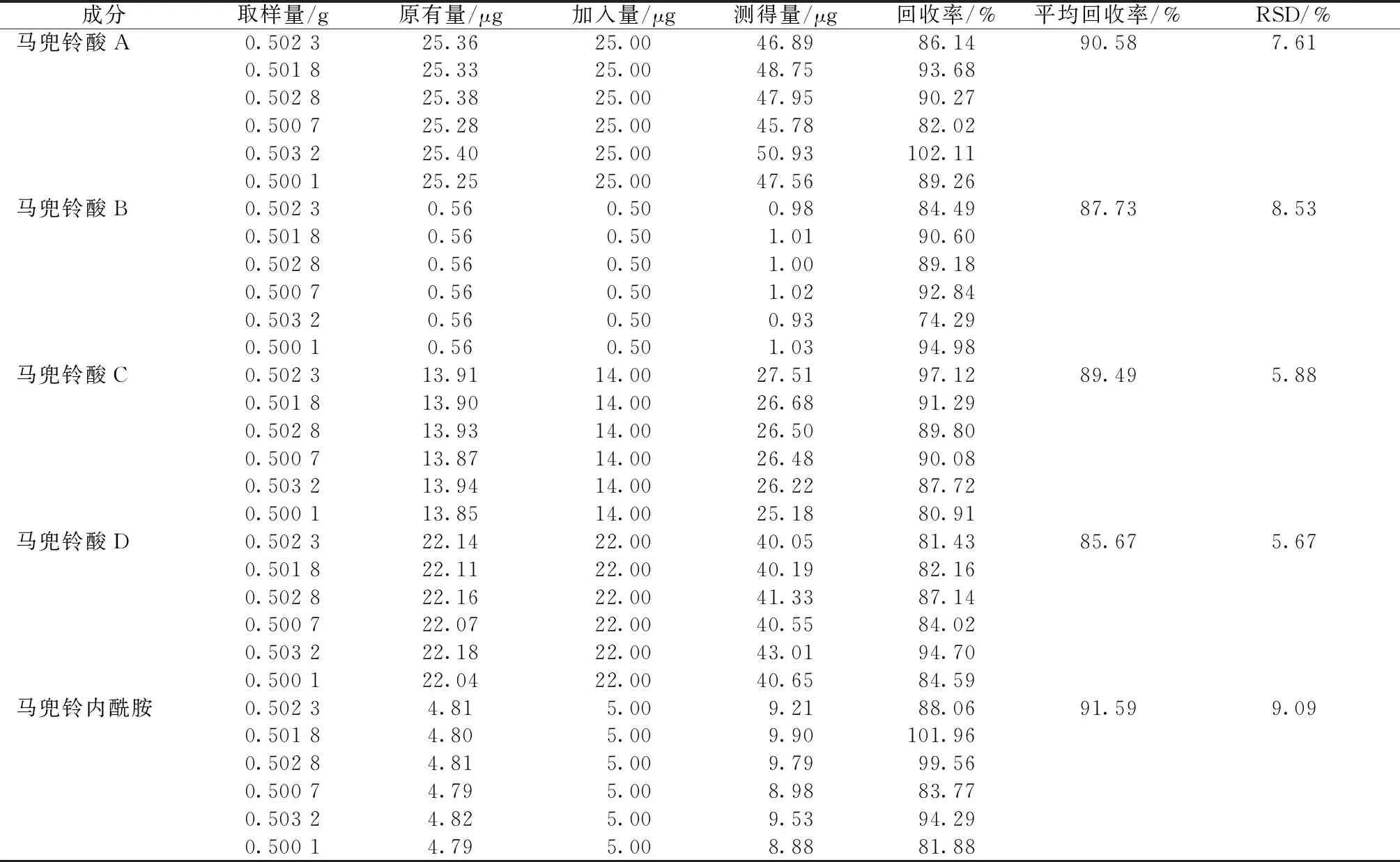
表4 各成分加样回收率试验结果(n=6)
2.3 样品含量测定 取各药材适量,按“2.1.1”项下方法制备供试品溶液,在“2.2.1”“2.2.2”项条件下进样,标准曲线法计算含量,结果见表5。由此可知,14批药材中果皮所含5种成分平均总含量为(2.86±1.03)μg/g,而种子为(156.23±58.31)μg/g,两者相差约50倍。
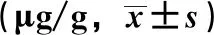
表5 各成分含量测定结果
3 讨论
马兜铃,尤其是种子中含有较多的脂肪,需要对样本进行预处理净化后才能采用质谱进行分析。一般预处理方法多采用C18SPE 小柱,但价格较为昂贵且容易堵塞萃取柱,而采用价廉易得的HPD-100树脂作为预处理净化方法,可以达到类似的效果并可反复使用,节约分析检测成本。
本实验采用质谱提取离子(EIC)方式进行定量,其中文献[7]报道马兜铃酸类成分的一级质谱出现多种加合离子,如马兜铃酸A包括m/z705.1[2 M+Na]+、m/z364.1[2 M+Na]+、m/z298.1[M+H-CO2]+,以及较弱的m/z342.1[M+H]+, 加合离子较多不利于取得更高的灵敏度,优化质谱条件后,马兜铃酸A产生较强及相对单一的m/z364.1[2 M+Na]+,因此,选择该离子作为定量离子。
文献报道,不同产地的马兜铃药材中马兜铃酸A的含量差异巨大,在460.73~1 039.46 μg/g之间;本实验发现马兜铃果皮和种子中不但5种成分差异明显,其总含量更是相差约50倍之多(果皮小于种子),实际应用中种子取样量小更容易导致取样不均,更加增大了安全用药风险。2020年版《中国药典》由于马兜铃的毒性已删去该品种,但保留含有马兜铃的复方品种31项,为进一步降低使用马兜铃复方的风险,建议马兜铃药材区分用药部位(以果皮入药)入药。
——凹脉马兜铃

