磷酸盐尿性间叶肿瘤的临床特点及其综合影像学表现
单凤玲 孙贞魁 沈晨 天 罗全勇
1上海市浦东医院,复旦大学附属浦东医院核医学科 201399;2 上海交通大学附属第六人民医院核医学科 200233
肿瘤源性骨软化症(tumor-induced osteomalacia,TIO)是一种由肿瘤引起的获得性低磷性骨软化症,致病肿瘤分泌过多的成纤维细胞生长因子23,使得肾脏排磷增加、血磷水平降低,导致骨骼钙磷代谢紊乱,引起骨软化性骨密度减低。该病的生化特点为血磷水平降低,尿磷水平升高,而血钙水平一般正常。患者临床症状表现为骨痛和肌肉无力,多开始于负重关节及四肢长骨,之后骨痛逐渐加重,严重时行走困难且容易发生病理性骨折(多发骨折或假骨折)。原发肿瘤切除后,病情能够得到明显缓解[1]。
TIO 的致病肿瘤大多数为骨或软组织的间叶源性肿瘤,其中磷酸盐尿性间叶肿瘤(phosphaturic mesenchymal tumor,PMT)是一种罕见的肿瘤,是引起TIO 的主要病因之一[2]。由于致病肿瘤位置隐匿、生长缓慢,导致对肿瘤的定位及诊断较为困难。大量研究者致力于对PMT 的超声、CT 及MRI显像特点的分析[3-4],而对PMT 的奥曲肽显像、全身骨显像及18F-FDG PET/CT 显像特点进行总结的研究较少。本研究主要对PMT 患者的相关诊疗资料进行研究分析,以期提高临床医师对PMT 的认识和诊疗水平。
1 资料与方法
1.1 一般资料
回顾性分析2014 年3 月至2018 年11 月于上海交通大学附属第六人民医院经组织病理学检查确诊的38 例PMT 患者(其中男性22 例、女性16例,年龄8~72 岁,中位年龄45.5 岁)的临床资料和影像学表现。其中,临床资料包括PMT 患者的临床症状、肿瘤来源、发病部位、肿瘤大小、组织病理学检查结果、治疗前后的血磷水平等;影像学表现包括超声、CT、MRI、99Tcm-联肼尼克酰胺-酪氨酸3-奥曲肽(99Tcm-hydrazinonicotinamide-Tyr3-octreotide,99Tcm-HYNIC-TOC) SPECT/CT 显 像、99Tcm-MDP SPECT/CT 骨显像、18F-FDG PET/CT 显像等表现。纳入标准:经组织病理学检查确诊为PMT;至少有一种影像学检查资料。排除标准:具有低磷性骨软化症家族史;因原发性甲状旁腺功能亢进、肾小管酸中毒、长期阿德福韦酯药物使用史等其他可能原因所致低磷性骨软化。本研究符合《赫尔辛基宣言》的原则。
根据上海交通大学附属第六人民医院病理科给出的报告进行总结:报告为“磷酸盐尿性间叶性肿瘤”者统计为良性;报告为“中间性磷酸盐尿性间叶性肿瘤或交界性磷酸盐尿性间叶性肿瘤”者统计为中间性;报告为“恶性磷酸盐尿性间叶性肿瘤或磷酸盐尿性间叶性肿瘤伴局部肉瘤变”者统计为恶性。
1.2 影像学检查方法
使用德国Siemens 公司s2000 彩色多普勒超声诊断仪、美国GE 公司LightSpeed VCT 64 排螺旋CT、荷兰Philips 公司Ingenia 3.0T MRI、美国GE公司Discovery NM/CT、美国GE 公司Discovery PET/CT 分别对患者进行相关影像学检查。所有患者于检查前均签署了知情同意书。
(1)CT 检查。CT 扫描参数:管电压120 kV、管电流350~450 mA、层厚5.00 mm、薄层扫描层厚0.63 mm,以3.00~5.00 mm 层厚行冠状面和矢状面重建。增强扫描采用高压注射器经肘前静脉以3 mL/s 流速注射碘海醇[通用电气药业(上海)有限公司,含碘量350 mg/mL] 100 mL,分别延迟30、65 s 行动脉期及静脉期扫描。
(2)MRI 检查。扫描序列包括:①横断面及冠状面T2 加权压脂序列,重复时间(repetition time,TR)3616.0~5488.0 ms,回波时间(echo time,TE)70.0~125.0 ms,层厚4.00~7.00 mm;②横断面及冠状面T1 加权快速自旋回波序列,TR 276.0~700.0 ms,TE 9.5~20.0 ms,层厚4.00~7.00 mm;③T1 加权快速场回波序列,TR 250.0 ms,TE 2.3 ms,层厚5.00 mm;④横断面及冠状面魔镜成像(mDIXON)序列,层厚6.00 mm;⑤MRI 增强扫描,经肘正中静脉手动推入钆喷替酸葡胺(377 mg/mL,法国Guerbet 公司)15~20 mL,注射流速1 mL/s,即刻采用T1 加权快速自旋回波序列(TR 276.0~700.0 ms,TE 9.5~20.0 ms,层厚4.00~7.00 mm)及魔镜成像(mDIXON)序列(层厚6.00 mm)行MRI 增强扫描。
(3)99Tcm-HYNIC-TOC SPECT/CT 显像和99Tcm-MDP SPECT/CT 骨显像。参数:矩阵 256×1024,放大倍数1.0,扫描速度22 cm/min,静脉注射925 MBq99Tcm-MDP(上海欣科医药有限公司)或370~555 MBq99Tcm-HYNIC-TOC (复旦大学附属肿瘤医院)3 h 后行全身显像,经计算机重建处理后获得全身平面图像及局部横断面、冠状面、矢状面SPECT、CT 以及SPECT/CT 融合图像。
(4)18F-FDG PET/CT 显像。按 3.70~5.55 MBq/kg
剂量静脉注射18F-FDG(上海江原安迪科药业有限公司),注射后1 h 行PET/CT 显像。先采集CT 图像,扫描范围自颅底至股骨中段,扫描参数:电压120 kV、电流140 mA、准直5.0 mm、层厚0.75 mm、0.5 ms/转、螺距1.25、扫描时间20~30 s。在同一范围内采用三维模式采集PET 图像,一般6~7 个床位,2 min/床进行扫描,采用CT 对PET 图像进行衰减校正、图像重建和融合。
2 结果
2.1 临床资料分析结果
(1)临床症状。PMT 患者的临床症状主要表现为进行性全身骨痛、肌肉无力以及肿瘤原发部位局部不适等。
(2)肿瘤来源、发病部位和肿瘤大小。38 例PMT 患者中,骨组织来源22 例,软组织来源16例;21.1%(8/38)发生于头颈部,2.6%(1/38)发生于躯干,76.3%(29/38)发生于下肢,下肢肿瘤中有31.0%(9/29)发生于膝关节以下位置(表1)。38例PMT 患者多表现为单发,仅1 例多发转移者表现为右下肢多发软组织肿块。38 例PMT 患者的肿瘤长径为1.2~8.2 cm。
(3)组织病理学检查结果。38 例PMT 患者中,组织病理学检查结果为良性者25 例、中间性者7 例、恶性者6 例(表1)。

表1 38 例PMT 患者的临床资料Table 1 Clinical data of 38 patients with phosphaturic mesenchymal tumor
(4)血磷水平。术前及术后均接受血磷水平检测的患者共30 例,术前血磷水平为0.28~0.73 mmol/L(正 常 参 考 值 为0.97~1.61 mmol/L),中 位 数 为0.50 mmol/L。术后复查血磷的30 例患者中,25 例于术后 3 d~6 个月血磷水平恢复正常,5 例血磷水平在术后10 个月仍未达到正常参考值[其中2 例术后有病灶残留、2 例术后复发、1 例为PMT(肉瘤3 级)伴多发转移]。
2.2 影像学表现
38 例PMT 患者中,有超声、CT、MRI、99Tcm-HYNIC-TOC SPECT/CT 显像、99Tcm-MDP SPECT/CT 骨显像和18F-FDG PET/CT 显像资料者分别为8、20、18、12、8、7 例。其中,典型病例的影像学图像见图1~3。
(1)超声表现。8 例PMT 患者的超声图像表现为边界多清晰,其中,5 例肿瘤呈低回声,3 例呈混合回声;7 例肿瘤周边及内部探及较丰富的血流信号,1 例未见明显血流信号;2 例肿瘤内见线条状钙化。
(2)CT 表现。骨组织来源的8 例PMT 中,50.0%(4/8)的患者在CT 上表现为溶骨性病变(图1A),另50.0%(4/8)的患者表现为髓腔内密度增高灶,边界欠清晰(图2A)。软组织来源的12 例PMT 病灶在CT 上表现为异常软组织密度灶或软组织肿块,其中16.7%(2/12)的患者伴有周边骨质破坏,8.3%(1/12)伴有钙化,16.7%(2/12)软组织肿块内见低密度灶(囊变、坏死);行CT 增强扫描的5 例软组织来源的PMT 肿瘤的实性部分均呈明显强化。

图1 不同PMT 患者的相关影像学图像 A~B:患者男性,30 岁,A 为CT 骨窗图,示右侧耻骨支溶骨性病变(箭头所示),B 为组织病理学检查图(苏木精-伊红染色,×400),结果为良性PMT;C:患者女性,67 岁,C 为99Tcm-HYNIC-TOC SPECT/CT 图,示多发肋骨骨折部位无放射性浓聚(箭头所示);D~H:患者女性,37 岁,多年前行肿瘤切除术,肿瘤复发、转移,D 为18F-FDG PET/CT 体部MIP 图,示左肺及右侧大腿多发18F-FDG 代谢异常增高灶,E 为CT 肺窗图,示左肺肿块(箭头所示),F 为CT 软组织窗图,示右侧大腿上段肿块(箭头所示),G 为18F-FDG PET/CT 图,示左肺段肿块伴18F-FDG 代谢增高(箭头所示),SUVmax=3.5,H 为18F-FDG PET/CT 图,示右侧大腿上段肿块伴18F-FDG 代谢增高(箭头所示),SUVmax=10.7。PMT 为磷酸盐尿性间叶肿瘤;CT 为计算机体层摄影术;99Tcm-HYNIC-TOC 为99Tcm-联肼尼克酰胺-酪氨酸3-奥曲肽;SPECT 为单光子发射计算机体层摄影术;FDG 为氟脱氧葡萄糖;PET 为正电子发射断层显像术;MIP 为最大密度投影;SUVmax 为最大标准化摄取值Figure 1 Different images of different patients with phosphaturic mesenchymal tumor
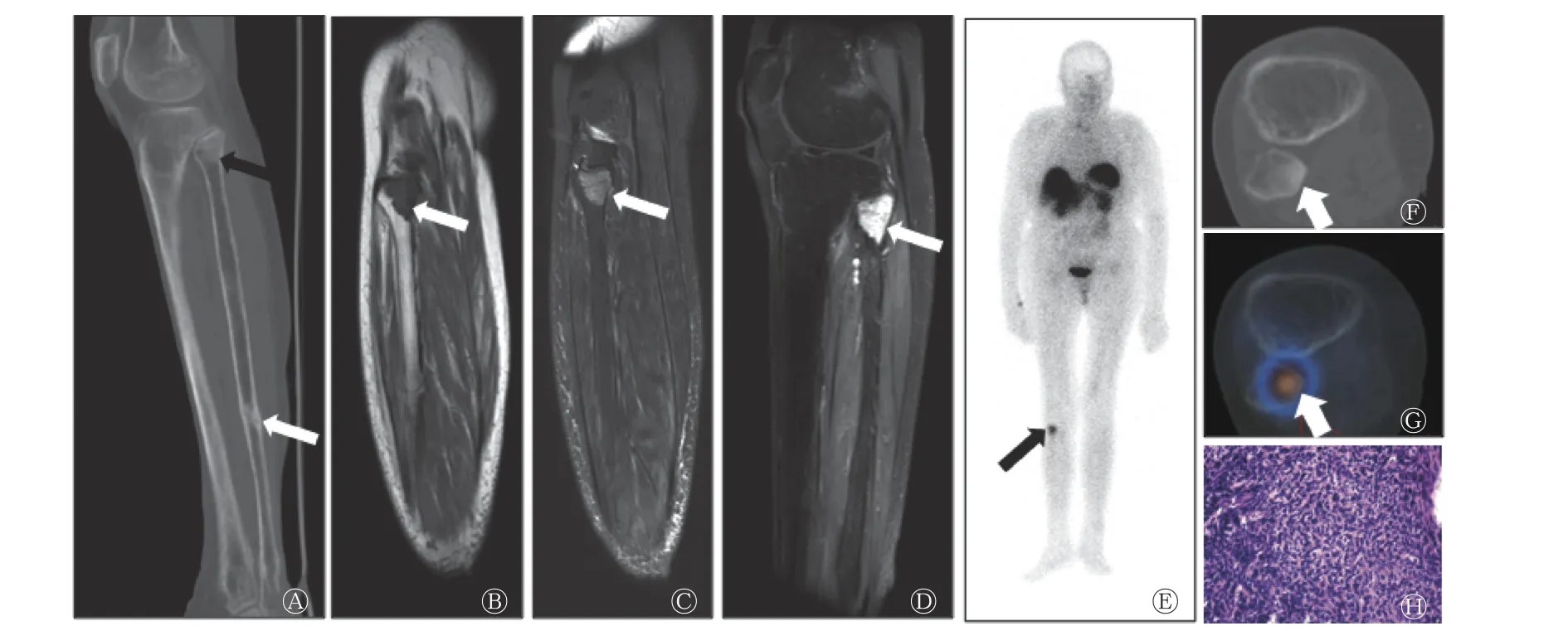
图2 PMT 患者(女性,67 岁)的相关影像学图像 A 为CT 骨窗图,示右侧腓骨近端髓腔内高密度灶(黑色箭头所示),另见右侧腓骨下段骨折(白色箭头所示);B~D 为MRI 图,右侧腓骨近端髓腔内病灶T1 加权像呈低信号(B,箭头所示),T2 加权像呈高信号(C,箭头所示),增强后呈明显强化(D,箭头所示);E~G 为99Tcm-HYNIC-TOC SPECT/CT 图,E 为SPECT 显像图,示右侧腓骨近端局部放射性浓聚(箭头所示),F 为CT 骨窗图,示右侧腓骨近端髓腔内高密度灶(箭头所示),G 为SPECT/CT 融合图,示右侧腓骨近端髓腔内病灶的放射性浓聚(箭头所示);H 为组织病理学检查图(苏木精-伊红染色,×400),结果为良性PMT。PMT 为磷酸盐尿性间叶肿瘤;CT 为计算机体层摄影术;MRI 为磁共振成像;99Tcm-HYNIC-TOC 为99Tcm-联肼尼克酰胺-酪氨酸3-奥曲肽;SPECT 为单光子发射计算机体层摄影术Figure 2 Different images of a patient (female, 67 years old) with phosphaturic mesenchymal tumor
(3)MRI 表现。18 例PMT 患者的MRI 均表现为T1 加权像等低信号、T2 加权像高低混杂信号,增强MRI 表现为肿瘤实性部分明显强化(图2B~D,图3A、B)。
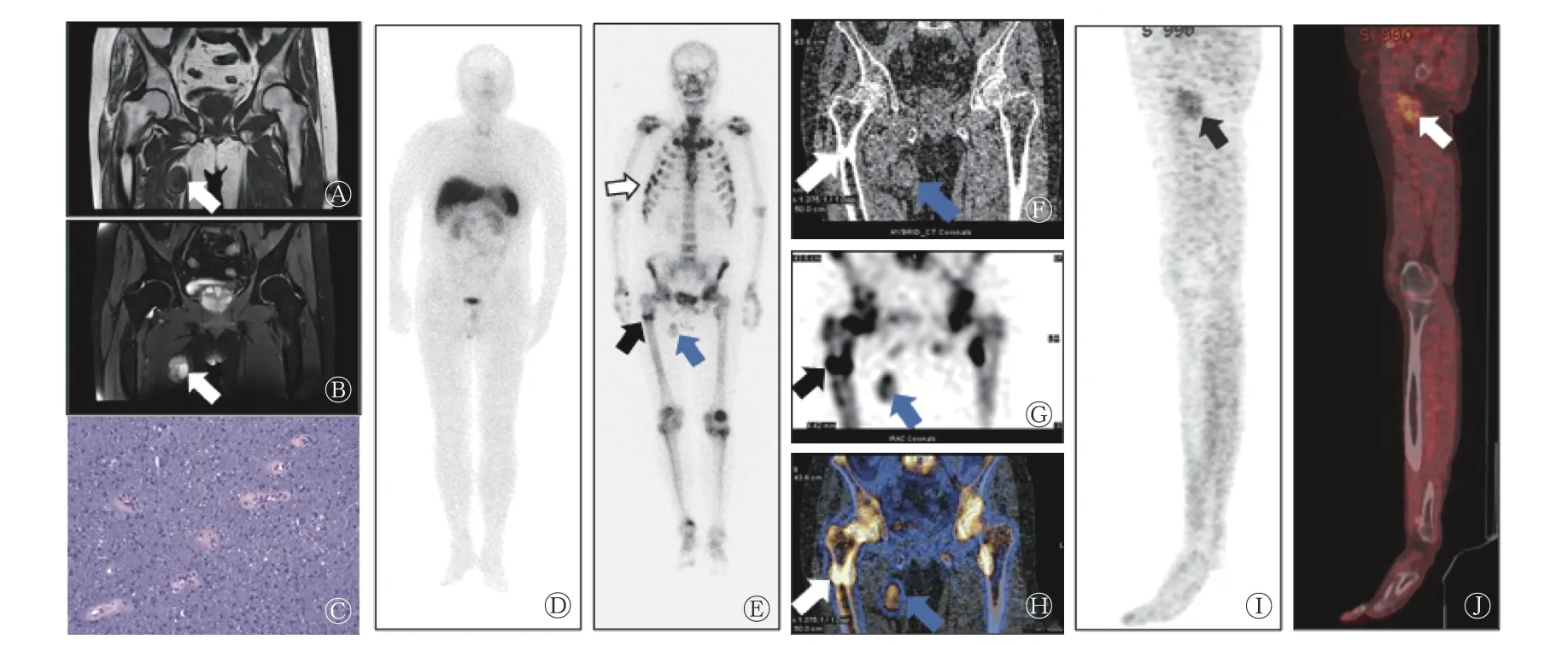
图3 PMT 患者(男性,45 岁)的相关影像学图像 A、B 为MRI 图,示右侧腹股沟肿块T1 加权像呈等低信号(A,箭头所示),T2 加权像呈等高信号,内见囊变(B,箭头所示);C 为组织病理学检查图(苏木精-伊红染色,×400),结果为良性PMT;D 为99Tcm-HYNIC-TOC SPECT 全身显像图,未见异常放射性浓聚灶;E 为 99Tcm-MDP SPECT 全身骨显像图,示右侧大腿根部局部放射性摄取增高灶(蓝色箭头所示),多发肋骨放射性浓聚(白色箭头所示),右侧股骨上段放射性浓聚(黑色箭头所示);F 为CT 软组织窗图,示右侧大腿根部局部软组织肿块(蓝色箭头所示),右侧股骨上段骨折后改变(白色箭头所示);G 为99Tcm-MDP SPECT 髋关节局部显像图,示右侧大腿根部局部放射性摄取增高灶(蓝色箭头所示),右侧股骨上段放射性浓聚(黑色箭头所示);H 为99Tcm-MDP SPECT/CT 融合图,示右侧大腿根部局部软组织肿块伴放射性摄取增高(蓝色箭头所示),右侧股骨上段骨折伴放射性摄取增高(白色箭头所示);I 为18F-FDG PET/CT 下肢MIP 图,示右侧腹股沟区18F-FDG 代谢增高灶(箭头所示);J 为18F-FDG PET/CT 融合图,示大腿根部软组织肿块伴18F-FDG 代谢增高(箭头所示),SUVmax=3.5。PMT 为磷酸盐尿性间叶肿瘤;MRI 为磁共振成像;99Tcm-HYNIC-TOC 为99Tcm-联肼尼克酰胺-酪氨酸3-奥曲肽;SPECT 为单光子发射计算机体层摄影术;MDP 为亚甲基二膦酸盐;CT 为计算机体层摄影术;FDG 为氟脱氧葡萄糖;PET 为正电子发射断层显像术;MIP 为最大密度投影;SUVmax 为最大标准化摄取值Figure 3 Different images of a patient (male, 45 years old) with phosphaturic mesenchymal tumor
(4)99Tcm-HYNIC-TOC SPECT/CT 显像。PMT患者99Tcm-HYNIC-TOC SPECT/CT 显像阳性率为83.3%(10/12)。骨组织来源的5 例PMT 均表现为放射性浓聚(图2E~G):其中有1 例除病灶处表现为放射性浓聚外,两侧肩关节放射性摄取对称性略增高,结合其他检查考虑为双侧肩关节炎所致;另有1 例原发灶位于右腓骨上段伴有多发肋骨骨折的患者行99Tcm-HYNIC-TOC SPECT/CT 显像,多发骨折部位无放射性摄取(图1C)。软组织来源的7 例PMT 中,28.6%(2/7)的肿瘤显像为阴性(图3D)。
(5)99Tcm-MDP SPECT/CT 骨显像。8 例PMT 患者99Tcm-MDP SPECT/CT 骨显像示全身多发骨折部位均呈异常骨代谢活跃灶,其中1 例软组织来源的肿瘤见放射性摄取轻度增高(图3E~H)。
(6)18F-FDG PET/CT 显像。7 例PMT 患者18FFDG PET/CT 显像示所有病灶均见18F-FDG 代谢增高,SUVmax为3.1~10.7,中位数为4.0(图1D~H,图3I、J),同时,18F-FDG PET/CT 显像可显示全身骨质改变情况。
3 讨论
多种间叶性肿瘤可导致TIO,但90%以上的TIO 是由PMT 所致[5]。2013 年WHO 软组织肿瘤分类中首次将PMT 作为一种新的病种收录[6]。大量研究者对PMT 的病理、临床及影像学表现等进行了探讨,但这些研究的病例数均较少,且多仅从CT 和MRI 的角度分析了PMT 的影像学特点[3-4]。与以往的研究相比,本研究纳入的病例数较多,且同时具有超声及多种核素显像的资料。
PMT 以单发为主,可分布于全身各处,多发生于骨及软组织,四肢是其好发部位。PMT 多数为良性,部分可表现为恶性。本研究中致病肿瘤绝大多数为单发,仅1 例发现多发转移;76.3%的肿瘤分布于下肢,其中有31.0%发生于膝关节以下位置,另有21.1%分布于头颈部;良性肿瘤占65.8%(25/38),中间型肿瘤占18.4%(7/38),恶性肿瘤占15.8%(6/38)。以上结果均与文献报道结果一致[7-9]。
PMT 本身多不引起明显的临床症状,患者多以骨痛为首发症状,实验室检查结果显示低血磷水平,手术切除肿瘤是该病最有效的治疗方法[7-8,10-11]。本研究中30 例患者的血磷水平在术前均低于正常参考值,肿瘤切除后,除了5 例有残留、复发或转移的患者,其他患者的血磷水平均在术后短时间内恢复至正常参考值。因此,对于术后血磷水平长时间内未恢复的患者,建议进一步行全身检查诊断是否存在肿瘤残余、复发或远处转移。
对肿瘤进行明确地定性及定位诊断是治疗TIO 的前提和关键。超声检查可探测发生于身体浅表部位的软组织肿瘤,本研究结果显示,PMT 主要表现为边界清楚的低回声肿块,87.5%(7/8)的PMT表现为肿瘤周边及内部有丰富的血流信号,这表明肿瘤常富含血管。但超声检查仅限于浅表软组织肿瘤的探测,对骨组织来源及其他部位来源(鼻腔、颅底等)的病变的应用价值有限。
本研究结果显示,50.0%的骨组织来源的PMT在CT 上表现为溶骨性病变,另外50.0%表现为髓腔内密度增高灶,边界欠清晰;这与Broski 等[12]的研究结果稍有不同。原因可能与本研究中骨组织来源的病例数较少及患者的选取有关。
Reubi 等[13]的研究结果显示,引起 TIO 的间叶组织来源肿瘤细胞的表面表达生长抑素受体,因此其认为可以利用生长抑素类似物奥曲肽与该受体结合显像来进行TIO 的肿瘤定位。本研究结果显示,99Tcm-HYNIC-TOC SPECT/CT 显像的阳性率为83.3%(10/12),16.7%(2/12)的PMT 患者呈假阴性表现。由于生长抑素受体在人体内的表达比较广泛,因此应注意99Tcm-HYNIC-TOC SPECT/CT 显像的假阳性及假阴性问题[14-15];另外,全身多发骨折在99Tcm-HYNIC-TOC SPECT/CT 显像上无放射性浓聚,因此在行99Tcm-HYNIC-TOC SPECT/CT 显像时应注意不要漏诊患者骨质异常。
本研究中99Tcm-MDP SPECT/CT 骨显像显示骨代谢活跃区域均表现为放射性浓聚。而放射性浓聚的多少与肿瘤的血流灌注量和代谢活跃程度有关[16]。由于骨肿瘤、骨质疏松及骨折等多种骨病均可能引起放射性摄取增高,因此99Tcm-MDP SPECT/CT 骨显像对PMT 的定位并没有特异性,但是其可整体评估PMT 患者的骨骼受累情况。某些软组织来源的PMT 由于其血流灌注量增加等原因,在99Tcm-MDP SPECT/CT 骨显像上也会表现出不同程度的放射性摄取。
18F-FDG PET/CT 显像对PMT 的定位及全身整体情况的评估有较大的应用价值[11]。本研究结果显示,PMT 在18F-FDG PET/CT 显像中均表现为18FFDG 代谢增高,程度高低不一。18F-FDG PET/CT显像在检出PMT 的同时,亦可整体评估其他病灶的情况。但由于常规扫描范围为颅顶至大腿中上段,发生于下肢的肿瘤易被遗漏,且又因PMT 好发于下肢,因此对于此类患者,在行18F-FDG PET/CT显像前应询问清楚患者病史,充分了解病情,明确检查目的,以防遗漏病灶。
本研究的不足之处在于本研究为回顾性分析,并非每例患者均有超声、CT、MRI、99Tcm-HYNICTOC SPECT/CT 显像、99Tcm-MDP SPECT/CT 骨显像、18F-FDG PET/CT 显像资料及治疗前后的血磷水平等其他实验室检查结果;另外,本研究中患者的随访不规律,失访率较高。
综上所述,PMT 的超声、CT、MRI 表现并没有特异性,99Tcm-HYNIC-TOC SPECT/CT 显像对PMT肿瘤的定位灵敏度较高;99Tcm-MDP SPECT/CT骨显像对PMT 的定位价值有限,但可以整体评估骨骼受累情况。18F-FDG PET/CT 显像对肿瘤的定位及整体评估有较大的应用价值。虽然PMT 大多为良性肿瘤,但也有复发的可能,术后应定期随访、常规监测血磷水平等血清指标,当再次出现血磷水平降低或者出现骨痛等相关症状时,应考虑肿瘤复发的可能,建议行相关核素全身显像进一步检查。同时本研究结果还显示,PMT 转移患者的18FFDG PET/CT SUVmax较高,因此18F-FDG PET/CT SUVmax可能与PMT 的病理及预后相关,有待后续研究进一步探究。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 单凤玲负责数据的采集和分析、论文的撰写;孙贞魁负责研究命题的提出、论文的审阅;沈晨天负责数据的统计和分析、论文撰写的指导;罗全勇负责数据的提供、研究的指导。

