放疗在低负荷转移性前列腺癌中的应用价值
骆华春 傅志超 沈志勇 王鑫鹏 蔡履娟 冯静 应文敏 陈忠华
解放军联勤保障部队第九〇〇医院放射治疗科,福州 350025
前列腺癌是男性常见的恶性肿瘤之一,在多数发展中国家,约70%的患者确诊时已经出现远处转移,其中低负荷转移性前列腺癌(low burden metastatic prostate cancer,LBMP)约占80%[1]。随着手术、放疗和内分泌治疗等技术的发展,远处转移的前列腺癌患者的预后得到了显著改善,但是对于LBMP 的治疗方式尚存在争议[2]。一项前瞻性随机对照研究结果证实,与单纯内分泌治疗相比,单纯前列腺直接放疗(prostate-only directed radiation therapy,PODT)可以提高LBMP 患者的总生存(overall survival,OS)率[3],但该研究仍存在缺陷,对于LBMP 的转移灶是否接受放疗仍存在争议,前列腺联合转移灶放 疗(prostate and metastatic radiation therapy,PMRT)能否进一步改善患者预后,尚不明确。本研究采用回顾性队列研究,比较PODT和PMRT 2 种方法对LBMP 患者的预后及生存质量的影响。
1 资料与方法
1.1 一般资料
回顾性分析2009 年11 月至2015 年11 月于解放军联勤保障部队第九〇〇医院确诊为LBMP的男性患者的临床资料。纳入标准:(1)经组织病理学检查确诊为前列腺腺泡细胞癌;(2)经骨全身显像、盆腔MRI 及全脊柱MRI 证实,椎体转移灶个数≤4 个;(3)经胸部CT 和全腹部增强CT 检查,无内脏转移;(4)东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~2 分;(5)年龄≤75 岁;(6)接受前列腺病灶和(或)转移灶的放疗,且在放疗前接受盆腔MRI 检查;(7)接受标准且持续的全雄激素阻断内分泌治疗,治疗时间>2 年;(8)临床资料完整。排除标准:(1)合并无法控制的基础疾病;(2)既往有恶性肿瘤病史;(3)不愿意接受长期随访;(4)患有精神系统疾病;(5)临床资料不完整。本研究共纳入91 例患者,年龄53~72(67.4±4.5)岁,按放疗方法的不同,将患者分为PODT 组和PMRT 组,其中PODT 组52 例患者,年龄(68.2±4.7)岁;PMRT 组39 例患者,年龄(67.1±4.4)岁。本研究经解放军联勤保障部队第九〇〇医院伦理委员会的批准(批准号:2020YW020)。所有患者均签署了知情同意书。
1.2 治疗方法
1.2.1 内分泌治疗
所有LBMP 患者均接受标准的全雄激素阻断内分泌治疗,治疗方法:口服比卡鲁胺片(阿斯利康药业有限公司,英国),5 mg/次,1 次/d;皮下注射醋酸戈舍瑞林(阿斯利康药业有限公司,英国)3.6 mg,1 次/28 d,连续治疗3 年。
1.2.2 放疗
治疗前要求患者排空直肠,喝水600 mL 充盈膀胱,憋尿30 min;取仰卧位,采用热塑膜联合真空垫体位固定后进行CT 扫描定位,扫描设备为美国飞利浦公司的16 层大孔径螺旋CT 模拟机(型号:BrillianceTMBig Bore CT),扫描条件:电压120 kV、电流50 mA、扫描层厚3 mm。扫描范围自第5 腰椎上缘至肛门下2 cm(如有椎体转移灶,则上界为椎体转移灶上缘5 cm);将CT 扫描的图像由模拟工作站传输至美国Varian公司Eclipse 放疗计划系统(TPS),将CT 和MRI(美国GE 公司Discovery MR750 3.0T MRI 仪,扫描条件:管电压120 kV、管电流300 mA、进床速度1 mm/s、层厚5 mm、层间距1 mm)进行图像融合。由2 位放疗科的副主任医师共同进行肿瘤靶区、危及器官(organ at risk,OAR)的勾画(包括直肠、膀胱、左侧股骨头、右侧股骨头)。其中前列腺的临床靶区体积(clinical target volume,CTV)为MRI T2 成像可见的前列腺(包含或者不包含钙化灶)及双侧精囊(前列腺病灶外放2.0~2.5 cm),计划靶区体积(planning target volume,PTV)为CTV 头脚方向外放1 cm,后界外放0.3 cm,余方向外放0.5 cm,处方总剂量为62.5 Gy(2.5 Gy/次,1 次/d,25 次/5 周)。淋巴结大体肿瘤体积(lymph node gross tumor volume,GTVnd)为MRI 上可见的盆腔转移淋巴结(肿瘤最大层面上的短径>1 cm),椎体转移灶大体肿瘤体积(metastatic gross tumor volume,GTVm)为MRI 上可见椎体转移范围,分别外放0.5 cm 为淋巴结计划大体肿瘤体积(lymph node planning gross tumor volume,PGTVnd)和椎体转移灶计划大体肿瘤体积(metastatic planning gross tumor volume,PGTVm),PGTVnd处方总剂量为55 Gy (2.2 Gy/次,1 次/d,25 次/5 周),PGTVm处方总剂量为45 Gy(1.8 Gy/次,1 次/d,25 次/5 周)。
PODT 组的放疗靶区为PTV;PMRT 组的放疗靶区为PTV+PGTVnd+PGTVm。正常组织和OAR的勾画按照肿瘤放疗协作组(Radiation Therapy Oncology Group,RTOG)标准,要求95%PTV 接受100%的处方剂量,OAR 剂量上限为25%直肠体积≤70 Gy、30%膀胱体积≤65 Gy、5%双侧股骨头体积≤50 Gy。由放疗计划系统(TPS)自动生成肿瘤照射体积和OAR 照射剂量(D1、D5、D10)(D1、D5、D10 分别表示1%、5%、10%的靶区体积接受的照射剂量)。
1.3 观察指标
1.3.1 生存时间
观察所有患者的无生化失败期间(interval to biochemical failure,IBF)、IBF 率、前列腺癌特异性生存(prostate cancer specific survival,PCSS)率和OS 率。IBF 时间定义为患者放疗后当天至前列腺特异性抗原(prostate specific antigen,PSA)出现生化复发的时间,其中生化复发为PSA 最低值升高≥2 ng/mL;PCSS 时间定义为前列腺癌患者自确诊之日开始至因前列腺癌进展诱发的并发症或肿瘤因素导致患者死亡的时间;OS 时间定义为患者确诊当天至死亡的时间。
1.3.2 生存质量
采用扩展性前列腺癌复合指数(expanded prostate cancer index composite,EPIC)量表评价患者随访期间的生存质量。该量表包含泌尿系统功能、肠道功能、性功能和激素功能等4 个领域的评价内容,问卷积分采用百分制形式,评分区间为0~100分,患者得分越高,表示对应领域的生存质量越好。问卷调查的随访时间点分别为放疗第1 天(时间点a)、放疗结束当天(时间点b)、放疗后3 个月(时间点c)、放疗后6 个月(时间点d)、放疗后12 个月(时间点e)、放疗后24 个月(时间点f)和放疗后36 个月(时间点g)。问卷的每个维度至少有一项得分,否则予以剔除,全部完成题组的问卷以实际得分计算,部分完成题组的问卷以平均分计算。
1.3.3 随访方式和时间
随访时间截至2020 年1 月1 日,随访时间36~70(56.7±8.2)个月。随访方式包括问卷调查、电话和门诊随访。随访时间点a 和b 的问卷调查由医师和患者共同完成,时间点c、d、e、f、g 均采用电话随访、门诊随访等方式进行。治疗结束后前2 年每3 个月、第3~5 年每6 个月复查1 次,复查项目包括盆腔MRI、腹部彩超、胸部X 射线、血常规、肝功能、肾功能、PSA 和血清睾酮水平等。患者放疗后采用RTOG 标准评价急性放射损伤。
所有患者在随访过程中,若出现骨相关事件均行局部放疗;若PSA 达到IBF 的诊断标准,予以更改治疗方案(接受新型内分泌治疗或化疗)。
1.4 统计学分析
采用SPSS 13.0 软件进行统计学分析。符合正态分布的计量资料以±s表示,计数资料以率表示,EPIC 量表中的维度得分以均值表示。在方差齐的条件下,组间肿瘤照射体积和OAR 照射剂量的比较采用独立样本t检验;急性放射损伤比较采用卡方检验;以时间点a 的生存质量作为对照,采用Mann-WhitneyU秩和检验比较组间各个时间点的生存质量;生存分析采用Kaplan-Meier 法,并行Log-rankχ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 PODT 组和PMRT 组一般资料的比较
由表1 可知,2 组LBMP 患者的年龄、基线PSA 水平等一般资料的差异均无统计学意义(均P>0.05)。
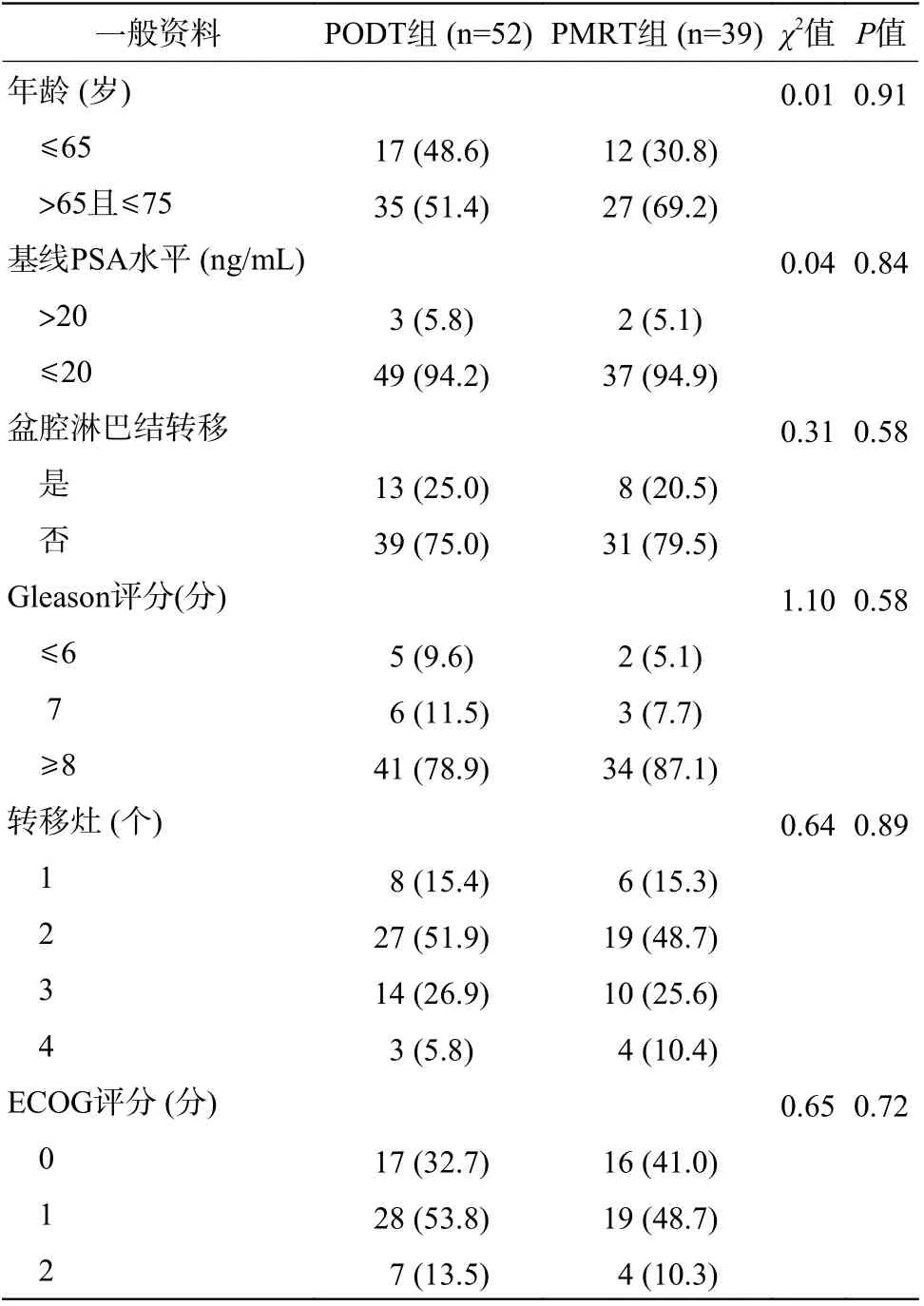
表1 2 组低负荷转移性前列腺癌患者一般资料的比较(例,%)Table 1 Comparison of general information between two groups of patients with low burden metastatic prostate cancer (case, %)
2.2 PODT 组 和PMRT 组 肿 瘤 照 射 体 积 及OAR照射剂量的比较
PODT 组总的照射体积为(264.52±86.37)cm3,PMRT 组为(418.47±63.64)cm3,2 组间的差异有统计学意义(t=1.362,P<0.05)。由图1 可见,PODT组直肠、膀胱、左侧股骨头和右侧股骨头照射剂量的D1、D5、D10 均显著低于PMRT 组,2 组间的差异均有统计学意义(均P<0.05)。
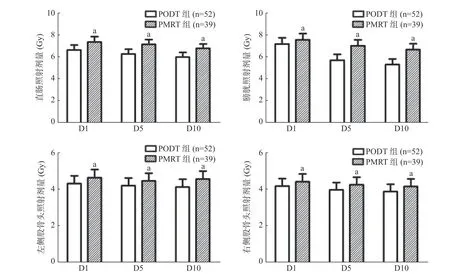
图1 2 组低负荷转移性前列腺癌患者危及器官照射剂量(D1,D5,D10)的比较 a 表示与PODT 组比较,差异均有统计学意义(t=2.01~4.78,均P<0.05)。D1 表示1%的靶区体积接受的照射剂量;D5 表示5%的靶区体积接受的照射剂量;D10 表示10%的靶区体积接受的照射剂量。PODT 为单纯前列腺直接放疗;PMRT 为前列腺联合转移灶放疗Figure 1 Comparison of radiation dose to organs at risk(D1,D5,D10)between two groups of patients with low burden metastatic prostate cancer
2.3 PODT 组和PMRT 组生存质量的比较
由图2 可见,PODT 组和PMRT 组的激素功能评分在各个随访时间点比较,差异均无统计学意义(Z=0.483~1.472,均P>0.05);PODT 组在时间点b、c、d 的泌尿系统功能评分均显著高于PMRT组,且差异均有统计学意义(Z=4.467、5.726、7.984,均P<0.05),其他随访时间点的差异均无统计学意义(Z=0.494~1.137,均P>0.05);PODT 组在时间点b、c、f 的肠道功能评分均显著高于PMRT组,且差异均有统计学意义(Z=3.862、5.693、7.874,均P<0.05),其他随访时间点的差异均无统计学意义(Z=0.472~1.376,均P>0.05);PODT 组的性功能评分在开始放疗后呈现持续性下降,PMRT 组的性功能评分在时间点b 显著低于PODT组,且差异有统计学意义(Z=5.787,P<0.05),时间点c 及以后的其他时间点PMRT 组的性功能评分均高于PODT 组,且差异均有统计学意义(Z=2.381~9.872,均P<0.05)。
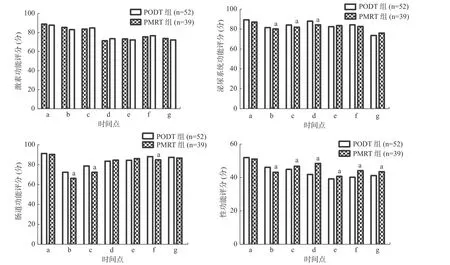
图2 2 组低负荷转移性前列腺癌患者放疗后不同时间点EPIC 量表评分的比较 a 表示与PODT 组比较,差异均有统计学意义( Z=2.381~9.872 , 均 P<0.05)。a 为放疗第1 天;b 为放疗结束当天;c 为放疗后3 个月;d 为放疗后6 个月;e 为放疗后12 个月;f 为放疗后24 个月;g 为放疗后36 个月。EPIC 为扩展性前列腺癌复合指数;PODT 为单纯前列腺直接放疗;PMRT 为前列腺联合转移灶放疗Figure 2 Comparison of expanded prostate cancer index composite score at different times after radiotherapy between two groups of patients with low burden metastatic prostate cancer
2.4 PODT 组和PMRT 组随访情况的比较
91 例患者的随访率为100%。PODT 组和PMRT组的5 年OS 率、PCSS 率和IBF 率随时间的推移呈下降趋势。其中PODT 组的5 年OS 率高于PMRT组(59.6%对58.9%),2 组间的差异无统计学意义(95%CI:0.50~1.88,χ2=4.62,P=0.94);PODT 组的5 年PCSS 率低于PMRT 组(65.3%对71.79%),2 组间的差异无统计学意义(95%CI:0.58~2.55,χ2=3.07,P=0.56);PODT 组患者的中位IBF 时间为31 个月,PMRT 组患者为39 个月,PODT 组的5 年IBF 率低于PMRT 组(4.2%对14.9%),2 组间的差异有统计学意义(95%CI:0.14~1.44,χ2=7.68,P=0.03)。
2.5 PODT 组和PMRT 组急性放射性损伤的比较
PMRT 组和PORT 组患者均发生了急性放射性损伤,其中2 组患者WBC、血小板计数和血红蛋白水平下降的发生率分别为82.1%和66.7%、84.6%和57.7%、48.1%和57.7%,差异均有统计学意义(χ2= 6.09、3.12、7.58,均P<0.05)。PMRT组出现2 例3~4 级WBC 减少的患者,经治疗后恢复正常;PMRT 组腹泻、尿频的发生率分别为64.1%和51.2%,高于PODT 组的63.5%和50.0%,差异均无统计学意义(χ2=0.03、0.01,均P>0.05)。PMRT组呕吐的发生率显著高于PODT 组(48.7%对19.2%),且差异有统计学意义(χ2=8.93,P<0.05)。
3 讨论
我们的前期研究结果已经证实,EPIC 量表可有效评价前列腺癌患者放疗后出现急性放射损伤的程度[4]。LBMP 的治疗模式和治疗药物的先后顺序是目前研究的热点,但往往忽略了放疗在LBMP中的作用[5-6]。本研究对LBMP 患者接受放疗联合内分泌治疗进行评价,比较PODT 和PMRT 2 种治疗模式的优劣性,并对疗效、放疗指标和生存质量等客观指标进行综合评价,可对LBMP 患者的治疗选择提供直观的数据参考。
靶区的勾画是放疗的重要组成部分,靶区体积和OAR 照射剂量是评价放疗疗效的主要参考指标。虽然质子治疗在前列腺癌的OAR 剂量降低方面有优势,但是现有的研究无法证实质子治疗可以取代调强放疗[7],调强放疗技术仍然是前列腺癌放疗的主流技术之一。本研究中PMRT 组和PODT组在靶区勾画中存在较大差异,主要是PMRT 组增加了转移灶的勾画范围,及肿瘤照射体积、OAR的D1、D5、D10 的照射剂量;肿瘤照射体积的增加是影响预后的危险因素,PMRT 组的肿瘤照射体积高于PODT 组,但在远期生存时间上并无差异,肿瘤放疗体积是否可以作为一个预后的参考指标,尚不明确。采用ROC 曲线可能可以进一步明确患者最佳肿瘤放疗体积,但仍需进一步证实。如何降低直肠等重要OAR 的照射剂量,是提高前列腺病灶照射剂量的关键,采用水凝胶注入前列腺和直肠之间的结缔组织,可以有效降低直肠的受照剂量[8]。受研究条件限制,我们的研究对象均未采用类似的技术,因此PODT 组和PMRT 组患者的直肠受照剂量显著增加,也明显高于其他研究报道的数据[9]。这可能与外照射增加了放疗靶区的范围,增加了直肠损伤的风险有关[10]。PMRT 组的勾画范围包含了盆腔淋巴结区域,这很大程度上增加了膀胱和双侧股骨头的照射剂量,膀胱充盈程度直接影响了前列腺的内移动范围。无论PMRT组还是PODT 组的膀胱照射剂量均高于既往的研究[11],这可能与研究人群的异质性有关;另外,在定位前采用膀胱充盈能力锻炼可能会减少膀胱的照射剂量。
转移性前列腺癌患者的生存质量往往决定了治疗策略的选择。本研究中的患者在长达5 年的随访期间,PODT 组和PMRT 组的泌尿系统功能和肠道功能在接受放疗后均存在不同程度的下降,这与OAR 的照射剂量较高有密切关系。本研究中,PMRT 组和PODT 组腹泻、尿频的发生率分别为64.1%、51.2%和63.5%、50.0%,均明显高于Pasquier 等[12]报道的1.4%和9.3%,后者采用外照射联合立体定向放疗,而本研究全程采用外照射,且研究对象以远处内脏转移患者为主,一部分患者还接受转移灶的放疗,这增加了发生急性泌尿反应(腹泻、尿频)和肠道反应(呕吐)的风险。当EPIC 量表性功能评分介于40~60 分时,仍有28%的前列腺癌术后患者勃起功能正常[13]。我们的研究对象以老年男性为主,且均接受长时间的雄激素阻断治疗,因此患者性功能和内分泌功能在随访期间内总体呈现下降趋势。睾酮激素水平与前列腺癌无明显相关性,但与骨密度和性功能密切相关[14],PMRT 组的性功能在放疗后3 个月出现大幅度提高,这可能与骨转移灶控制得较好有关。
我们的前期研究发现,接受放疗的局部晚期前列腺癌患者,照射范围越小,骨髓抑制的发生率越低[15]。WBC、血小板计数和血红蛋白下降是前列腺癌放疗过程中主要的血液学不良反应,骨盆的活性骨髓对机体造血功能具有重要的作用[16-17],这可能是PMRT 组出现血液学不良反应高于PODT组的主要原因。包括腹泻、呕吐等放疗引起的急性损伤,由患者自行评估,能在最大程度上降低由医师评估引起的漏报率[18]。本研究采用EPIC 量表和RTOG 标准评价,能更加客观地评价放疗的急性放射损伤。PMRT 组患者的直肠和膀胱照射剂量增高,导致腹泻、尿频等症状的发生率增高。放疗过程中,PMRT 组和PODT 组的前列腺移动变异性的不同是否会引起急性放射损伤的差异[19],尚需进一步证实。放疗引起的呕吐是影响生存质量的主要因素之一[20],PMRT 组的呕吐发生率高于PODT组,但所有患者中并未出现3度及以上的呕吐,2种放疗模式对患者都是可以耐受的。
Sandler 等[21]对患者盆腔预防性照射在前列腺癌放疗中的作用进行一项回顾性研究,结果证实,增加盆腔照射,并无法改善OS 率和PCSS 率。相比本研究,二者在研究对象和放疗方法上存在差异,但是间接证实了靶区体积的增加,并不能改善患者远期的生存时间,也说明包括内分泌治疗等方法在提高前列腺癌总体生存时间方面具有重要作用。Bowden 等[22]采用立体定向放疗技术,在前列腺局部治疗的基础上,照射4~5 个和1~2 个转移灶之间的疗效并未体现出差异。本研究结果显示,PMRT 在改善IBF时间方面具有较好的优势,不同放疗技术和放疗剂量出现的肿瘤生物学效应仍存在差异,但是无论哪种放疗模式,长期的生存率却大致相同。本研究中我们将PMRT 组患者的淋巴结包含在照射野内,但并未体现出生存时间上的优势,是否进一步分层分析可以得到阳性结果,尚需扩大样本量证实。一项回顾性队列研究结果显示,在近距离放疗的基础上联合或者部分联合转移灶的放疗,5 年的OS 率和PCSS 率分别为64.4%和87.9%[23],均显著高于本研究中的PODT 组和PMRT组。作为回顾性研究,受我国总体医疗水平的限制,大多新研发药物的使用率相比于欧美国家仍较低,这可能是造成生存时间差异的主要因素。
作为一项回顾性研究,尚无有效的数据证实PMRT 是否会增加其他OAR 的照射剂量,如肺、心脏等;受研究条件限制,对PMRT 和PODT 造成的远期放射损伤未进行随访观察。另外,本研究中对研究对象的内分泌治疗时间作出了一定的限制,长期内分泌治疗的不良反应均可耐受,且内分泌治疗是晚期前列腺癌最主要的治疗手段,因此要求接受内分泌治疗时间大于2 年,这可能会造成选择性偏倚[24]。综上所述,LBMP 患者在内分泌治疗的基础上,采用PMRT,可能带来更大的泌尿系统和消化系统的不良反应,虽然提高了IBF 时间,但并不能提高远期的生存率。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 骆华春负责命题的设计、论文的撰写;傅志超负责论文初稿的修改;沈志勇、王鑫鹏负责生存质量的随访;蔡履娟、冯静负责生存率的统计;应文敏负责急性放疗不良反应的随访;陈忠华负责命题的设计、论文的审阅。

