长链非编码RNA ZFAS1作为肿瘤预后因子的荟萃分析
李璐燕,陈梦湘,何国献,余敏,吴越,向惠英,邵世和
(1.江苏大学医学院,江苏镇江212000;2.常州市第二人民医院检验科,江苏常州213000)
癌症作为一种由多种因素引起的疾病,具有较高的发病率和死亡率。癌症的早期诊断是改善肿瘤患者预后的有效途径之一[1],寻找新的肿瘤标志物对癌症的早期诊断具有重要意义。长链非编码RNA(LncRNA)是长度超过200 bp的非编码RNA,其作为一种新的生物学标志物,对癌症的诊断、治疗和预后具有一定的临床价值[2]。多种LncRNA已被证实与癌症相关,例如,Chen等[3]发现沉默Lnc00958可以预防胰腺癌的进展。Wu等[4]证实,lncHDAC2能促进肝癌干细胞的扩散和自我更新。Xiao等[5]研究发现,LncRNA-TTTY15在前列腺癌组织中过表达,促进了前列腺癌的进展。ZFAS1最初被证实在乳腺上皮分化和肺泡发展过程中发挥调控作用[6]。后续大量研究发现,该LncRNA在胃癌、食道癌、神经胶质瘤、结直肠癌、非小细胞肺癌和其他癌症患者中均呈异常表达[7-11],且ZFAS1基因高表达患者的总生存率、无病生存率均较差[12-13]。然而,由于研究癌症类型单一,样本量小,结果不具有代表性。因此,本研究旨在通过荟萃(meta)分析确定ZFAS1与癌症患者临床预后的关系,并进一步验证ZFAS1作为肿瘤标志物的潜在价值。
1 材料和方法
1.1文献检索策略 利用电子数据库PubMed、Cochrane Library、Web of Science、Wiley Online Library等,使用以下关键词:“ZFAS1”、“LncRNAZFAS1”或“long non-coding RNAZFAS1”、“cancer”和“tumor”进行检索。检索日期截至2020年7月10日。
1.2纳入和排除标准 纳入研究需满足以下条件:(1)与ZFAS1关联的癌症研究;(2)将患者分为基因高、低水平表达组,分类标准为肿瘤组织中ZFAS1基因的表达水平;(3)提供相关的临床资料;(4)提供生存分析相关的风险比率(hazard ratio,HR)和95%置信区间(95% confidence interval,CI)或可以获取生存曲线。排除标准:(1)综述、meta分析、病例报告和重复出版物;(2)临床资料不足的研究。
1.3数据提取和质量评估 提取数据包括:文章出版信息(包括作者名称、出版时间、癌症类型)、基因检测方法,ZFAS1基因高、低表达组患者数量,临床病理参数(包括TNM分期、是否发生淋巴结转移、远处转移、性别)以及生存相关(包括生存率和无病生存率)的HR值及95%CI、P值。研究质量评估包括:(1)纳入患者的选择;(2)组间的可比性;(3)随访结果。
1.4统计学分析 采用危险比(HR值)及95%CI评估ZFAS1与癌症患者临床预后之间的关系。在本次研究所纳入的文章中,部分HR值可以直接从原文中获取,部分研究并未提供,对于无法直接获得HR值的研究则需通过原文中的生存曲线获得原始数据,并使用Engauge Digitizer 4.2版软件(http://digitizer.sourceforge.net/)计算HR值和95%CI。异质性分析采用卡方Q检验和HigginsI2统计量分析。基于合并效应量的异质性,选择固定效应模型或随机效应模型。当异质性明显(I2>50%或P<0.05)时,采用随机效应模型,反之则采用固定效应模型。在临床病理因素方面,将患者按照性别分为男性和女性,根据是否诊断为淋巴结转移、远处转移分为阳性和阴性,根据TNM分期分为早期(Ⅰ+Ⅱ期)组和晚期(Ⅲ+Ⅳ期)。
2 结果
2.1研究选择及特点 根据文献筛选策略,共筛出152项研究。阅读标题和摘要后,有72篇文章因是动物研究、综述、meta分析或无关研究被删除。通篇阅读文章后,因缺乏生存结果或临床病理参数的必要信息,有5篇文章被排除。最终选择21篇文章进行meta分析,共17种癌症,其中包括肝癌2篇[13-14],结直肠癌4篇[15-18],大肠癌1篇[19],胃癌1篇[20],骨肉瘤1篇[21],卵巢癌1篇[12],非小细胞肺癌1篇[11],胶质瘤1篇[22],膀胱癌1篇[23],黑色素瘤1篇[24],前列腺癌1篇[25],肾透明细胞癌1篇[26],胆管癌1篇[27],食管鳞状细胞癌1篇[28],鼻咽癌1篇[29],宫颈癌1篇[30],子宫内膜癌1篇[31]。所有患者均基于明确的病理诊断。本次研究共包含1 765例患者,且纳入的研究均将患者分为高表达组和低表达组,分类标准为癌症组织中ZFAS1表达情况,检测方法均为qRT-PCR。21项研究均来自中国。见表1。
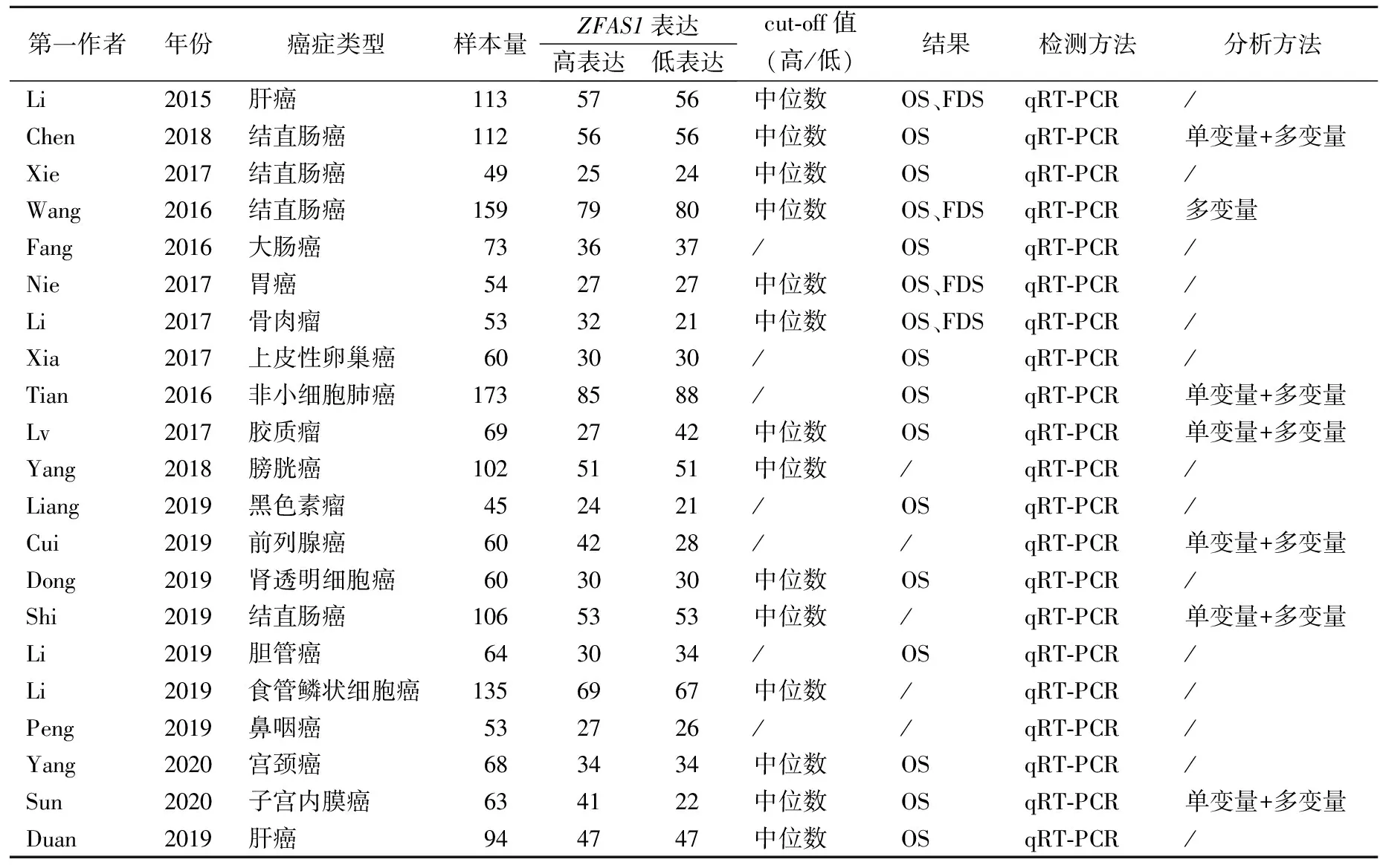
表1 本次meta分析纳入研究的临床特征
2.2ZFAS1表达与癌症患者总生存率OS及无病生存率DFS的相关性 采用HR值及95%CI分析ZFAS1表达与患者生存率的关系。其中16项研究分析了总生存率OS与ZFAS1表达水平之间的关联,4项研究分析了无病生存率DFS与ZFAS1表达水平的关联。结果显示,总生存率HR合并结果为1.85(95%CI:1.67~2.05,Z=11.78,P<0.000 01),见图1A。无病生存率HR合并结果为1.92(95%CI:1.51~2.44,Z=5.35,P<0.000 01),见图1B。由于研究间不存在明显异质性,分析方法均采用固定效应模型。此外,根据肿瘤类型进行亚组分析,将纳入的研究按照肿瘤种类分为消化系统肿瘤组(包括胃癌、肝癌、结直肠癌、胆管癌、大肠癌、食管鳞状细胞癌),呼吸系统肿瘤组(包括非小细胞肺癌、鼻咽癌),泌尿生殖道系统肿瘤组(包括膀胱癌、子宫内膜癌、宫颈癌、肾透明细胞癌、前列腺癌、卵巢癌)及其他系统肿瘤组(包括胶质瘤、骨肉瘤、黑色素瘤)。结果显示,ZFAS1高表达能够显著降低消化系统肿瘤(HR=1.78,95%CI:1.52~2.08,Z=7.18,P<0.000 01),泌尿生殖道系统肿瘤(HR=2.03,95%CI:1.54~2.68,Z=4.99,P<0.000 01),呼吸系统肿瘤(HR=1.64,95%CI:1.30~2.07,Z=4.16,P<0.0001)及其他肿瘤(HR=1.87,95%CI:1.68~2.07,Z=7.10,P<0.000 01)患者的生存率,见图1C。
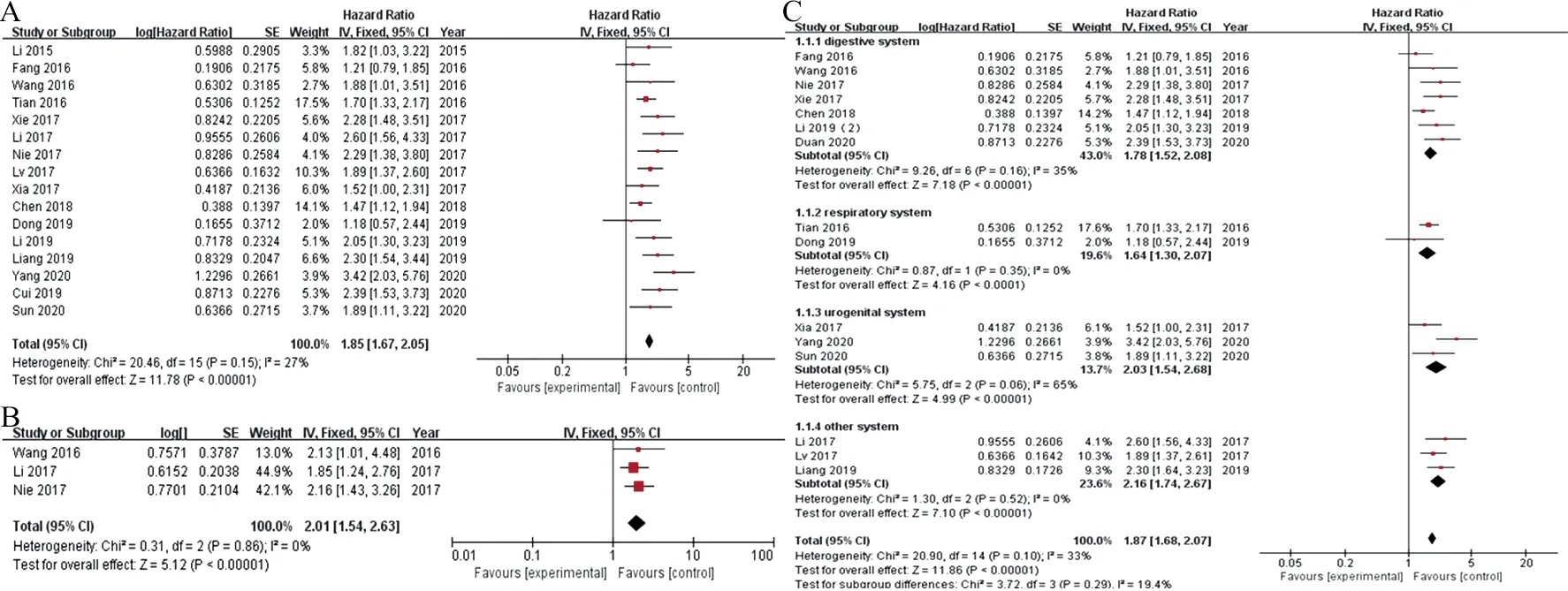
注:A,ZFAS1表达与癌症患者总生存期OS相关性的森林图;B,ZFAS1表达与癌症患者无病生存期DFS相关性的森林图;C,ZFAS1表达与癌症患者总生存期OS相关性按癌症类型亚组分析森林图;degestive system,消化系统;respiratory system,呼吸系统;urogenital system,泌尿生殖系统;other system,其他系统。
2.3ZFAS1表达与癌症患者临床病理参数的相关性 采用OR值及95%CI评估ZFAS1表达与患者临床病理参数的关系。其中15项研究共纳入1 416例患者的临床TNM分期数据,13项研究纳入1 070例患者的淋巴结转移情况,8项研究纳入629例患者的癌症远处转移情况,16项研究纳入1 447例患者的性别,具体统计数据见表2。分析结果显示,ZFAS1基因高表达的患者与TNM分期为Ⅲ+Ⅳ期(OR=2.87,95%CI:2.31~3.57,Z=9.55,P<0.000 01),更易发生淋巴结转移(OR=2.44,95%CI:1.40~4.25,Z=3.13,P=0.002)和肿瘤的远处转移(OR=1.90,95%CI:0.86~4.18,Z=1.59,P=0.000 9)有关。而患者性别与ZFAS1的表达并无明显关联(OR=1.06,95%CI:0.86~1.31,Z=0.57,P=0.23)。见图2。
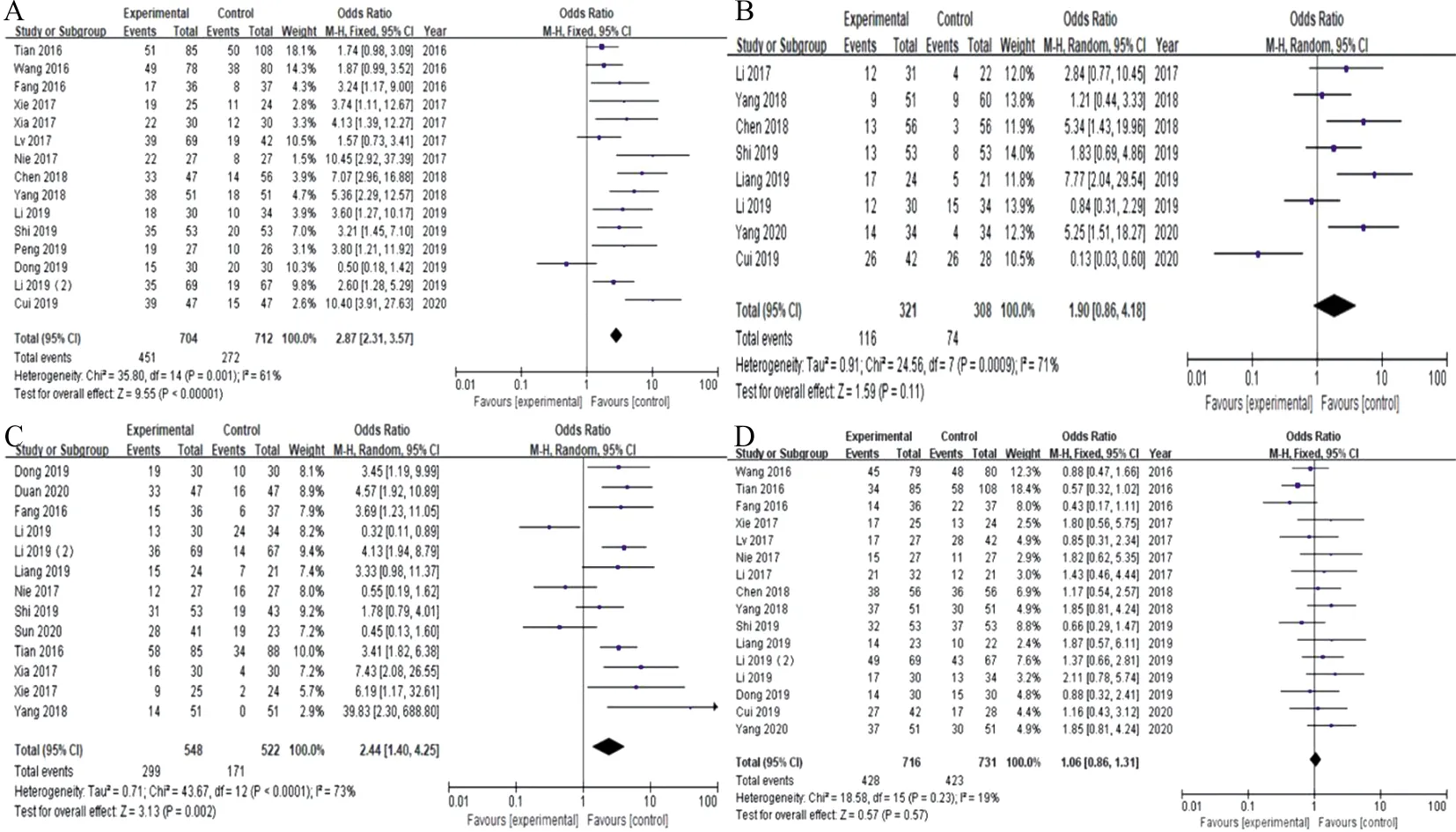
注:A,TNM分期;B,远处转移;C,淋巴结转移及侵袭;D,性别。
2.4web GEPIA数据库验证结果 使用基因表达谱动态分析数据库web GEPIA分析ZFAS1在癌组织与癌旁组织中的表达水平,并通过对TCGA和GTEx项目RNA测序表达数据进行分析,结果表明,与相应的癌旁组织相比,ZFAS1在多种癌组织中均明显升高。见图3。

注:CHOL,胆管癌;COAD,结肠癌;DLBC,弥漫性大b细胞淋巴瘤;GBM,多形性成胶质细胞瘤;KIRC,肾透明细胞癌;LGG,脑低级别胶质瘤;LIHC,肝脏肝细胞癌;nam(T),癌组织;num(N),癌旁组织。
2.5敏感性分析与发表偏倚 应用Stata 12.0软件检测删除数据对总生存率合并结果的影响,并验证结果的稳健性,漏斗图结果显示不存在明显发表偏倚。见图4A、4B。
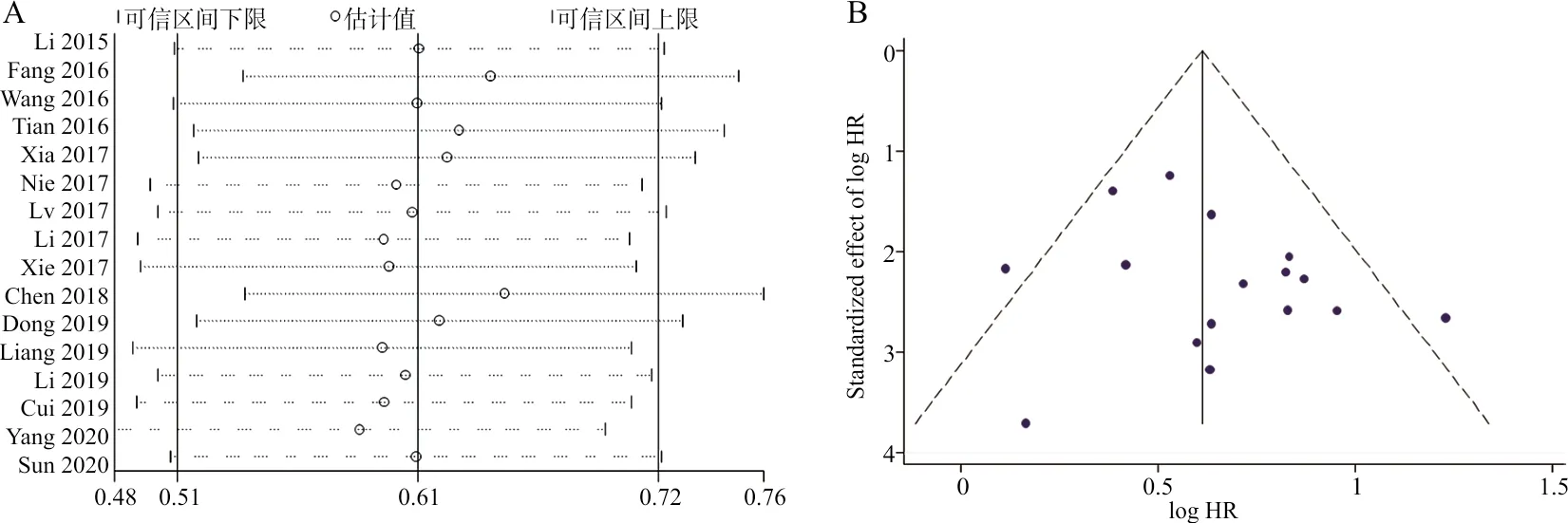
注:A,敏感性分析结果;B,漏斗图。
3 讨论
LncRNAs曾经被认为是基因垃圾,但越来越多的研究表明,它在肿瘤细胞的生命活动中发挥重要作用,包括转录调控、基因剪接、翻译和细胞成分的组装等[32]。多种LncRNAs已经被贴上致癌基因或肿瘤抑制基因的标签[33-34],对肿瘤诊断具有重要价值。近年来,LncRNAsZFAS1被证实在多种肿瘤组织中异常表达。查阅文献可知,其在结直肠癌、胃癌、肝癌、胆囊癌等消化系统肿瘤中的研究较为深入广泛,但在其他类型癌症中研究相对较少。本次meta分析基于以上研究基础,综合分析ZFAS1表达在各系统肿瘤预后诊断价值,亚组分析结果显示,高表达的ZFAS1与消化系统、泌尿生殖道系统、呼吸系统等肿瘤的低生存率均具有显著相关性。此外,为重点研究ZFAS1表达水平与癌症患者临床病理参数之间的潜在联系,笔者收集了患者性别、TNM分期、淋巴结转移和远处转移等数据进行分析。结果表明,与低表达组相比,ZFAS1高表达患者TNM分期更易发展为Ⅲ/Ⅳ期,且更易发生淋巴结转移及远处转移。综上所述,高表达的ZFAS1与肿瘤患者的不良预后具有明显相关性。
为进一步探究ZFAS1在癌症中发挥调控作用的分子机制,笔者发现目前针对该LncRNA的研究主要集中于竞争性内源性RNA(Competitive endogenous RNA, ceRNA)调控机制。ceRNA假说最早由Leonardo Salmena等提出,该假说论证了细胞中编码和非编码RNA是如何相互作用并进一步影响细胞表型[35]。MicroRNA是具有代表性的非编码RNA,其主要在分子水平上发挥重要作用,研究证实LncRNAZFAS1与多种miRNAs之间存在调控环路。通过查阅文献,笔者发现能够与ZFAS1直接结合的MicroRNA主要有miR-150-5p[12,15,24,36-37]、miR-590-3p[38-40]、miR-1271-5p[41-42]、miR-193a-3p[43-44]、miR-421[45],其中miR-150-5p、miR-590-3p被证实在多种癌症中均能够被ZFAS1特异性吸附。此外,ZFAS1调控的靶基因具有多样性,可以从细胞增殖、迁移、侵袭、凋亡及细胞耐药性等方面调控癌症进展。
本研究仍存在一定的局限性:(1)纳入文章数量和样本量有限;(2)所有纳入的研究均在中国进行,可能存在种族及地域差异;(3)本次meta分析仅包括英文出版物;(4)部分HR值无法从原文获取,而是由生存曲线计算获得。本研究还需在今后的临床研究中验证。
综上所述,本次meta分析证实ZFAS1是一种重要的肿瘤标志物,高表达的ZFAS1预示着癌症患者较差的生存期和不良的临床预后。ZFAS1作为ceRNA直接或间接与MicroRNA结合,影响肿瘤的发生、发展。

