骨代谢标志物在骨质疏松中的应用进展
王健 廖燚 袁锋
骨质疏松症是骨骼代谢最常见的疾病,约有1/2的女性和1/5的男性预期会在一生中经历一次骨质疏松性骨折[1]。女性一生的骨质疏松性骨折的发病率和死亡率很高,其髋部骨折死亡的风险大致相当于乳腺癌。由于这些严重的临床后果,骨质疏松症的诊断、治疗和监测至关重要。在这方面的主要挑战是骨质疏松在出现骨折前无症状;对于其临床诊断和后续治疗主要依靠放射学,并根据临床病史和人口学的情况对有风险的患者进行实验室检测[2]。骨质疏松症的发病机制是破骨细胞吸收骨骼的能力与成骨细胞形成骨骼的能力不平衡造成的,这种失衡多发生于具备骨质疏松症的临床风险因素的患者中。这些危险因素包括更年期妇女、高龄、糖皮质激素的使用以及其他内分泌疾病如甲状腺功能亢进或甲状旁腺功能亢进,或其他慢性全身性炎症。虽然放射学检测技术仍然是诊断骨质疏松症的主要手段,但其已被证明只能预测一部分骨折风险[1,2]。此外,放射学检测的骨量变化可能滞后人们希望可以发现骨骼生理变化数月甚至落后1年[3]。由于骨质疏松症直接来自于成骨细胞和破骨细胞的数量及其活动变化的结果,随之而来的是这些细胞活性的生物标志物反映了当前的骨转换水平,这就是骨代谢标志物(bone turnover marker,BTM)。他们可能还会提供对总骨量的放射学评估以外的其他信息,这是因为骨质疏松的患者在低的骨转换水平具有与高的骨转换水平不相同的生物物理特性和骨折的风险。
1 骨代谢标志物分骨形成标志物及骨吸收标志物
首先可以归类为反映骨骼吸收的指标及形成的指标,然后进一步分类为进入骨吸收或形成过程中释放的基质产物或以破骨细胞或成骨细胞的数量或活性相称的水平直接分泌到循环中的细胞产物(图1)。
1.1 I型C端和N端端肽胶原 I型胶原蛋白是最丰富的蛋白质成分。骨的I型C端和N端端肽胶原蛋白(CTX和NTX)都是I型片段来自三肽的端肽区域的胶原蛋白成熟胶原蛋白末端附近的部分破骨细胞吸收
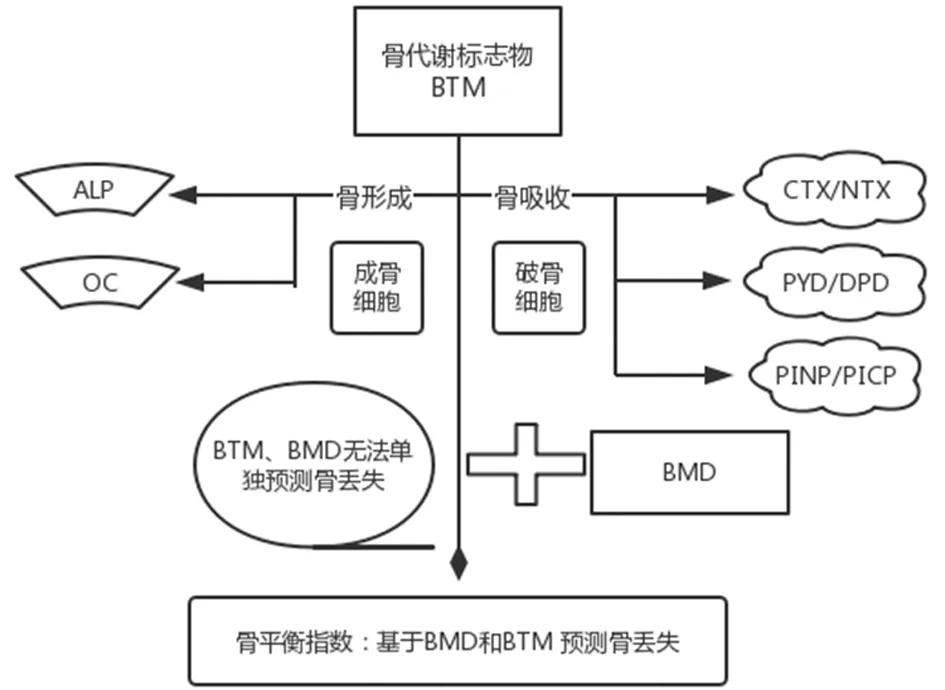
图1 骨代谢标志物产生及其在骨量评价中作用
过程中裂解端肽。在骨质,它们释放进入循环速率与骨吸收活性成正比。CTX是组织蛋白酶K介导的骨吸收的特定产物,代表了组织蛋白酶K对骨的直接代谢导致CTX释放,但不是替代骨分解代谢酶,例如基质金属蛋白酶teinases[4]。相反,另一个BTM,I型C末端交联的端肽基质金属蛋白酶释放胶原蛋白(ICTP)或胰蛋白酶也是骨骼消化的产物。ICTP对骨吸收的反映,在实质性的骨肿瘤中的响应速度比在绝经后骨质疏松症要更加灵敏中。但是,ICTP因为它只能手动RIA,因此他的临床应用受到限制,因此在此不再赘述。
虽然α1型胶原肽链与α2型胶原肽链交织在一起,NTX检测也可以识别α2型胶原链的N端端肽的肽链。值得注意的是,CTX八肽还包含一个从新合成形式逐渐转变为异构化和种族化的天冬氨酰(CTX)随时间变化为的异构形式。到期到交联形成赖氨酸的存在CTX肽,它们以单体形式存在(αCTX和βCTX)和二聚体(α-αCTX,α-βCTX,和β-βCTX)。αCTX相对于βCTX可以提供有关胶原蛋白沉积与吸收之间的效能,但还需要进一步验证才能确定该比率的潜在临床效用[5]。CTX分析可以显示出不同程度的αCTX和βCTX和各种CTX二聚体,其中大多数CrossLaps认可的检测方法主要是β-βCTX,而Alpha CTX分析可以识别α-αCTX。
通常,CTX和NTX分析显示出大致相似的临床效用和测试特征[6]。CTX和NTX足够小,可以肾脏清除,因此血清/血浆和尿液的样本都可以用来检测。在临床实践中,CTX最常在血清中进行分析,而NTX通常在尿液中运行。尽管许多参考实验室都可以使用血清NTX测定,但检查样本选择尿液相对于血清对于NTX来说在抗吸收治疗方面显示出较小的变化[7]。
1.2 吡啶啉和脱氧吡啶啉 骨骼中的I型胶原蛋白显示出广泛的网络共价交联有助于评估骨骼的整体生物力学特性。吡啶啉(PYD)和脱氧吡啶并啉(DPD)是特定的交联PYD在端肽区域中赖氨酸或羟赖氨酸残基之间的结构性胶原蛋白中形成,在胶原蛋白三螺旋中具有特定位点具有2种形式,由3个羟基赖氨酸残基形成的羟基糖基PYD和衍生自1个赖氨酸和2个羟基赖氨酸残基。羟赖氨酸是由赖氨酰羟化酶[赖氨酸原胶原,2-氧戊二酸5-双加氧酶1(PLOD1)]的作用形成,在Ⅵ型Ehlers-Danlos综合征中有缺陷。因此,在Ⅵ型Ehlers-Danlos综合征可降低羟基赖氨酸PYD与赖氨酰基PYD的比例,用作诊断Ⅵ型的辅助证据埃勒斯-丹罗斯综合征[8]。而PYD位于DPD主要在骨骼中发现,包括骨骼和软骨在内,因此被认为可以成为骨转换的更具体标志。PYD和DPD在骨骼吸收后释放,随后通过肾脏清除[9]。尿液中约有30%~50%的PYD是以游离形式存在,其余与肽结合或更大的蛋白质复合物[10]。自由物种是假设是从骨骼释放后肽结合的PYD的代谢形成的[11]。PYD具体是通过HPLC检测其天然荧光定量或通过ELISA检测,取决于与游离总和酸水解是否进行分析以及分析肽结合的片段[12]。
1.3 Ⅰ型N和C末端前肽胶原 成骨细胞分泌Ⅰ型胶原蛋白为完整分子包含N和C端前肽随后在细胞外空间分裂。因此,Ⅰ型胶原的N和C末端前肽(PINP和PICP)水平是成骨细胞的Ⅰ型胶原蛋白分泌的标志物。PINP和PICP作为分析物具有都相似特性,但是PINP已得到更广泛的研究,因此将成为此处考虑的重点。PINP最初是作为Ⅰ型胶原蛋白的3条蛋白质链中的前肽并随后转化为单体形式循环。因此,化验可同时测量单体和三聚体PINP(总PINP)或仅测量三聚体PINP(完整PINP)。三聚体PINP通过清除剂受体的摄取被清除,而单体PINP主要在肾脏清除。因此,完整而完整的PINP显示良好与健康对照的相关性,血液透析患者的总PINP浓度大大增加是由于单体PINP的清除受损[13]。
1.4 骨特异性碱性磷酸酶 测量总碱性磷酸酶(ALP)水平可以通过酶活性可以显示出骨重塑活动的程度,尤其是在骨转换严重紊乱的情况下,例如骨Paget病,在这种情况下,总ALP的效用因总代表4种ALP基因产物的ALP活性[碱性磷酸酶、肠(ALPI),碱性磷酸酶、肝/骨/肾(ALPL),碱性磷酸酶、胎盘(ALPP),碱性磷酸酶、胎盘像2(ALPPL2)]。碱性磷酸酶的每一种亚型对标不同的组织特异性疾病过程的反应。其中,只有骨骼特异性ALPL基因的亚型反映了骨合成代谢活性,因为它成骨细胞以特定方式直接释放到循环中与数量和微分状态成比例[14]。历史上有很多确定同工型特异性ALP水平的方法或为了监测骨代谢活性,目前优选使用特异性识别骨特异性ALP(骨ALP)的免疫测定法。重要的是,当前可用于骨ALP的免疫测定法未显示出完全的特异性,仍显示出与肝脏ALP的一定程度的交叉反应性。因此,骨ALP增加需谨慎解释,需关注患有肝病的患者血脂水平。骨ALP表达是在间充质祖细胞分化成骨细胞的早期获得的,骨ALP本身是天然的焦磷酸矿化抑制剂,如因突变导致的佝偻病样的低磷血症患者潜在的严重骨骼疾病不适于使用ALPL检测。
1.5 骨钙素 骨钙素(OC)是49个氨基酸,与钙结合最成熟的成骨细胞分泌的多肽骨骼中发现丰富的非胶原蛋白。OC有最近重新引起人们的广泛关注是因为基础和翻译骨骼生物学的发现,因为它可作为骨源激素起作用,影响男性生育力,葡萄糖稳态,中枢神经系统直接影响的行为以及肌肉在小鼠中的功能[15-17]。成骨细胞分泌的大多数OC被掺入有机基质中,后来骨化成骨头,但是有一小部分被分泌出来进入流通。因此,OC被广泛认为是骨形成标记,实际上,OC浓度与直接测量骨骼有关通过组织形态计量学形成[18]。但是,OC掺入有机骨基质中的部分在破骨细胞吸收过程中可被释放。因此,骨吸收可直接影响血清OC浓度,尽管这种作用的实际意义尚不清楚。OC还含有3种谷氨酸(氨基酸13、17和20)经历了维生素K依赖的羧基化,增加OC对羟基磷灰石的亲和力[19]。与此一致依赖于维生素K的翻译后加工,用维生素K拮抗剂(如华法令)治疗,会增加未羧基化或羧基化OC的相对量,并可能降低血清总OC浓度[20]。一部分OC随后经历脱羧,只有未羧化的OC能够调节葡萄糖稳态[21]。临床应用一直很感兴趣测量未羧基化的OC,具有尚未作为临床检测方法实施研究环境。
值得注意的是,由于OC不稳定,用于OC测量的样品具有特殊的收集和运输要求。建议将样品保持在4℃附近,并在收集后4 h内进行处理。始终观察到样品溶血以减少OC,可能是通过提高OC降解水平而达到的。OC的这种不稳定性主要是不稳定的6-氨基、酸性C端序列的特性,分析缺少该序列的更稳定的片段,即N-Mid-OC片段(第1~43位氨基酸)已在临床上发现了实用性完整OC的测量[22]。
2 测量BTM中的分析前因素
只要BTM提供了对骨转换的综合系统性测量,影响因素的分析前因素收集时的骨转换会影响他们的浓度。这些预分析因素可以分为可控因素,例如季节性或昼夜变化,以及不可控因素,包括人口统计变量,例如年龄和性别。骨吸收之间可控因素,显示显着昼夜节律变化,血清CTX,NTX和OC浓度在凌晨至午夜之间达到峰值(23点)[23]。这个昼夜节律大多数BTM通常都能观察到这种作用CTX在昼夜节律变化中显示出最高幅度[24]。此外,绝经前女性耦合程度表现出最大的差异的季节变化发生骨重塑的峰值在冬季[25]。餐后骨吸收水平下降,这也是导致骨吸收增加的重要原因。CTX在清晨产生,这通常是每天禁食时间最长的时间。餐后骨骼重塑下降由于胃肠激素的作用,例如胰高血糖素样肽2,会减少骨吸收[26]。因此,建议早上在空腹时抽血测量血清CTX,以增加测量的准确性。骨形成标记似乎较少受这些因素影响[27]。观察到运动会导致体内BTM浓度的急剧变化,因此建议您进行运动抽样前要避免48 h[28]。吸烟习惯、较低的BMI也会影响到基础的BTM浓度[29]。骨转换率也随着月经周期而变化,在月经的中后期增加,卵泡期和黄体中期下降[30]。因此,绝经前女性的理想做法是在月经周期的卵泡期获得在BTM浓度中一致的基线。
除了这些影响骨转换的因素之外,影响BTM清除率的患者因素也将影响测量结果。最值得注意的是,CTX,NTX,单体PINP和OC显示出肾脏清除率的功能,并且会随着肾功能不全通常会增加[34]。抗酒石酸酸性磷酸酶(TRAP),一种破骨细胞分泌的酶,与骨吸收活动有关,是少数几个不通过肾脏清除的分解代谢的BTM之一,因此可以在肾功能不全的患者中使用。但是,与CTX或NTX相比,预测断裂骨折风险的一般能力较差,限制了TRAP分析的实用性[32]。专门测量破骨细胞衍生的TRAP同工型TRAP5b,而不是所有血清TRAP活性[33]。对于合成代谢BTM,骨ALP不通过肾脏清除,在肾功能不全的情况,可能会改善这些局限性[34]。大多数BTM是存在于非骨骼组织的Ⅰ型胶原中或其他涉及基质重塑的疾病过程的组织,例如全身性硬化症,充血性心力衰竭,或扩张型心肌病已显示出增加BTM浓度[35-37]。人口因素是不可控制的BTM中的分析前变异。20多岁和30多岁的男人通常比女性显示较高的BTM基础浓度[38,39]。但是,在50岁以后,情况正好相反,因为随年龄增长女性的基线水平显示出更快的吸收,最可能与更年期过渡相关[40]。作为BTM浓度反映可用的骨重塑的表面总面积和在这些部位中相对重塑活性,年轻人相对更多的BTM基线浓度是因为其骨骼质量的更大。在成长中的孩子大大提高了形成和吸收标记物可以被检出,与身高变化呈现正相关性,在青春期达到顶峰[41]。与DPD相比,CTX或NTX的青春期高峰更为明显,可以观察到DPD浓度增加直到青春期未出现下降[42]。成年后,BTM在此期间倾向于保持较低的基础水平,直到女性绝经后其浓度增加。这些人口统计因素对BTM的影响水平突出了产生参考的挑战是年龄和性别类别之间的间隔,尤其是BTM的许多标准基于年轻女性形成。人口因素对骨代谢的影响的研究较少,包括男性、儿童的可用数据较少,无法用于建立参考依据[43]。在确定骨骼质量时最常用的双能X射线吸收法(DXA),通常主要是比较患者的值不是参考的年龄和性别匹配的参考区间(称为Z得分),而是引用性别匹配的是与健康的年轻人参考区间(T评分)。理由是骨量决定骨折风险的因素,而不是看患者的骨量是否在参考年龄的骨量范围内。类似的考虑也可能会扩展到BTM标记,因为有人建议35~45岁女性参考间隔从各个年龄段的BTM中的相对最低点得出[29]。
3 BTM的应用
大多数骨质疏松性骨折不发生在骨矿物质密度(BMD)测试为骨质疏松的个体中,而是发生在骨量减少的患者中。骨质疏松症患者(DXA的BMD T评分1~2.5扫描)的个人骨折风险低于骨质疏松症患者(T评分2.5),骨量减少的患者的数量较大,这意味着大多数骨折将在骨量减少的人群中发生[44]。
因此,由于骨折发生率相对较低,然而可能发病的人群却又比较巨大,因而迫切辅助工具预测骨折风险以及识别最能从骨质疏松症药物治疗中受益的人。解决此问题的一种方法是应用先进的射线照相技术,例如DXA衍生的小梁骨评分和高分辨率外周定量计算机断层扫描,以提供更多的风险分层数据[45,46]。BTM的测量方法已被研究为另一种解决此问题的潜在方法。在这里,我们将总结BTM在临床骨质疏松症管理中的效用,主要集中在绝经后骨质疏松症。
3.1 使用BTM预测骨丢失 由于在体内测量总骨量反映了活动的破骨细胞和成骨细胞这些细胞谱系的活性的平衡,更年期期间的骨的流失迅速增加[47]。由于骨吸收和形成是通常相伴的,成骨细胞活动指数增加通常伴随着破骨细胞的骨吸收的增加。多项研究调查了BTM,更年期状态和伴随的破骨细胞引起的骨质流失。总体而言,虽然建立了绝经前BTM水平与随后的骨质流失明确的关系,老年女性的BTM水平与随后的骨质流失之间的关联明显较少。因此,合理的认识明显改变的BTM水平与老年人的骨质的加速流失是比较合理的[2]。
目前,大多数女性在绝经期还没有系统地经过骨质疏松的筛查。因此,纳入常规监测BTM进入临床实践以识别“骨质流失”,他们可能会继续发展成骨质疏松症,这提出了严峻的挑战。在评估此类筛查的有效性和成本效益的前瞻性随机临床试验缺乏的情况下,目前不建议使用BTM作为一项公共卫生措施以识别患者快速骨质流失的风险[48]。
一种增加BTM实用性的方法预测骨丢失是基于以下观察,骨量反映了骨形成的数量减去吸收的数量。因此,理想情况下,骨形成和骨吸收BTM将是合并成一个反映净骨量的丢失,将BTM测量值与骨组织的改变联系起来是一个挑战,骨平衡指数是解决这一问题的创造性方法,并基于回归确定相对患者队列中OC与尿液NTX的含量骨量稳定。然后,对患者进行评估相对于此回归标准来确定是否NTX相对于OC的数量高于或低于预期对应于稳定骨量的量。初步验证表明,骨平衡指数可能是预测骨质流失的有用方法,但是,需要进行研究以进一步了解该方法的适用性[49]。
3.2 使用BTM预测骨折风险 鉴于骨密度不能完全预测骨折的风险,已经进行了许多研究来确定相伴的BTM浓度与随后的骨折风险。明显地,必须区分的是BTM预测骨丢失和骨折的能力的不同,如上所述,他们具有预测骨折风险的能力,由于人口统计学,临床和骨骼微体系结构因素的不同,在给定的整体骨量水平下,因为患者的骨折风险可能明显不同。总体而言,前瞻性研究分析骨形成标记与后续骨形成标记之间的关系骨折风险未能显示出明显的合成代谢效用的BTM[2]。
相反,多个研究表明,骨骼标志物的增加吸收可预测随后的脆性骨折[50]。有趣的是,初次测定后5年,在长期随访研究中未检测到这种关联增加骨吸收标记与骨折风险的增加[51]。值得注意的是,合并症可能会改变BTM与BMD测量之间的关系以预测骨折风险。如研究最多的例子之一,BMD测量低估了糖尿病患者的骨折风险[52]。因此,如何最好地应用BTM进行估算糖尿病患者的骨折风险应积极进一步研究。尽管这些发现将重吸收性BTM的浓度增加和骨折风险联系在一起,但几乎没有数据关于这种测量在日常中的实用性临床实践。ROC分析未能证明低BMD和高BMD相结合BTM检测到的女性发生骨折风险的风险比低风险高[53]。
总之,在所有人群中,虽然BTM是流行病学家研究骨折风险的强大工具,目前的证据不足以建议其常规使用来识别患者中谁将从骨质疏松症药物联合疗法中获得最佳利益。但是,应该区分患有“继发性”骨质流失的患者,例如甲状旁腺功能亢进,甲状腺功能亢进,维生素D缺乏和超蛋白血症,因为BTM可能在这些方面区分出高风险的患者亚群。此外,由于未满足降低发病率和死亡率的临床需求,正在积极推动骨质疏松性骨折的研究来最好地将BTM应用于日常监控骨折风险,BTM在该领域的新应用将来可能会出现。见图2。
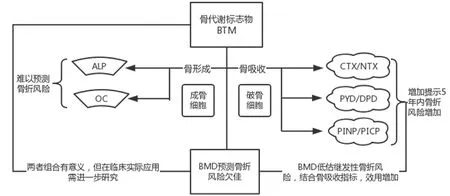
图2 BTM预测骨折的价值
3.3 使用BTM监测骨质疏松症 与BTM用于确定有快速骨丢失风险患者的作用有限相反,将BTM应用于指导骨质疏松症的治疗具有更大的效用。BTM响应的变化模式治疗方法已有很好的描述,这些变化已经用于预测骨密度的增加和减少骨折风险的治疗效果。
3.4 治疗效果 抗吸收剂直接抑制骨质破骨细胞的骨吸收,在骨吸收标记中,因此导致相对较快的减少抑制程度。骨吸收随每种抗吸收剂的不同而不同,具体取决于剂量和作用机制。这种抑制骨吸收导致骨减少由于连接破骨细胞和成骨细胞活性的生理机制,形成标记。作为其中的一些破骨细胞直接介导偶联作用,破骨细胞是抑制破骨细胞吸收能力同时保留破骨细胞的抗吸收剂,与减少破骨细胞的药物相比,对骨形成的影响较小。例如,组织蛋白酶K的抑制剂(属于传统的抗吸收剂)可降低CTX的水平[54]。但是,作为组织蛋白酶K的抑制剂却没有影响破骨细胞的数量,现有的破骨细胞仍然能够刺激成骨细胞的募集和分化。因此,使用钙蛋白酶K抑制剂的骨形成标志物的减少少于双膦酸盐和地诺单抗可以阻止破骨细胞分化或杀死活性破骨细胞的减少[55,56]。破骨细胞和成骨细胞之间的这种联系可以也有相反的作用,焦油使成骨细胞影响破骨细胞对骨的吸收。重组人甲状旁腺激素(PTH)1-34(特立帕肽)的典型特征是合成代谢剂,导致骨骼的骨化和吸收标记物增加[54]。抗硬化素单克隆抗体,一种正在研究的合成代谢药物,还导致骨的剂量依赖性增加形成标记,但与特立帕肽不同,血清CTX降低[57]。
4 临床结果
骨质疏松症治疗开始后早期的BTM预测BMD变化。特立帕肽诱导后的第18个月和第24个月的脊柱和髋部BMD变化与基线浓度PINP与正相关[58,59]。应用特立帕肽后PINP在第1个月和第3个月的早期增加是脊柱骨密度增加1~2年的预测因素[58,60]。同样,BTM的早期减少可以预测长期应用双膦酸盐和地诺单抗相关(2~3年)BMD升高[61,62]。此外,BTM的早期变化也与使用一些抗吸收剂可降低骨折风险[63-69]。例如,在骨折干预试验(FIT)的事后分析中,血清的减少更多PINP,骨ALP和CTX与阿仑膦酸盐治疗以减少脊柱和臀部有关骨折[67]。同样,尿液中的CTX和尿液中的NTX与利塞膦酸盐的发生相关减少脊柱骨折[61,63]。在多重雷洛昔芬(MORE)试验的结果,OC的变化预测的脊柱骨折风险降低效果优于骨密度变化[68]。
每年1次-关键性骨折试验(HORIZON-PFT)研究在健康结果中观察到PINP和唑来膦酸的关系相似,而唑来膦酸的发生率降低[69]。最后,在停用后监控血浆中的BTM水平或变化,这种疗法在临床上将会有价值。超过5年无治疗间隔的参与者骨折干预期间平均接受了5年的阿仑膦酸盐治疗建立了BTM与骨折风险相关,在长期骨折干预试验中扩展(FLEX)试验,CTX、PINP和骨骼的水平扩展开始时的ALP不能预测骨丢失[70]。此外,骨骼ALP和停药后的尿液NTX不能预测骨折发生率[71]。使唑来膦酸用3年的安慰剂进入试验时的血清的PINP浓度不能预测椎体形态或接受过3次治疗的参与者的非椎骨骨折[72]。总之,将BTM与骨质疏松症治疗结合使用仍然限于研究用途,尚未标准化用于临床。但是,能够及早发现BTM与骨骼密度扫描相比,骨骼的变化仍然非常可取的。BTM的临床使用可能受到先前讨论的测定方法的分析变异性的限制,并且骨质疏松症的护理对BTM的未来发展影响很大。
骨质疏松症的患者可以应用BTM进行于诊断和管理。首先,许多生理因素和疾病因素等混杂因素可能影响BTM的检测结果,需积极的排除这些因素来更好的应用BTM。其次,BTM结合骨密度的检查结果所得出骨平衡指数可以预测临床骨折风险,应仔细选择适应症来提高预测的效能上。后期的研究需在影响BTM检测结果的混杂因素及其预测骨折风险的适应症的进一步,最终将BTM在临床更加精准的应用,提高骨质疏松症及相关骨折的治疗结果。

