全面认识酸碱缓冲溶液的缓冲能力
——由高校通用教材中一道例题引发的思考
岳宣峰,段亚娟,孙君岳,简亚军,张延妮
1陕西师范大学化学化工学院,陕西省生命分析化学重点实验室,西安 710062
2陕西师范大学药用资源与天然药物化学教育部重点实验室,西安 710062
酸碱缓冲溶液的概念由Walther Hermann Nernst在1903年提出,第一个用来衡量其缓冲能力的指标即缓冲值β的描述及其微分数学表达式是在20世纪20年代由Koppel及Spiro[1]、Slyke[2]分别独立提出来的,然而其数学表达式和一些教材中对该概念的描述并不完全吻合[3],一个世纪以来,伴随着化学学科的发展,有关缓冲溶液缓冲能力的衡量规范引发过广泛关注[4–22],也不乏争议[5,6,8–11]。国内绝大多数现行高校《化学分析》教材中关于酸碱缓冲溶液缓冲能力衡量的介绍还是基于Slyke的描述,一些有益的发展[12–20]并未被收录,而一些不够明晰的界定给学习者带来困惑[22]。因此,很有必要对酸碱缓冲溶液缓冲能力的有关知识做一个全面梳理,深化对高校化学分析课程中有关酸碱缓冲溶液的认识。本文以武汉大学主编的《化学分析》第6版一个例题求解方法为切入点展开商榷。
1 衡量酸碱缓冲溶液缓冲能力的有关计算
1.1 酸碱缓冲溶液缓冲能力衡量指标的演进
为了定量地衡量酸碱缓冲溶液的缓冲能力,1922年Slyke提出了缓冲值的概念,其定义为:使1 L溶液的pH增加dpH单位时所需加入该溶液的强碱的量db(mol);或是使1 L溶液的pH减少dpH单位时所需加入该溶液的强酸的量da(mol),给出的数学表达式见式(1)。

基于此数学微分式,Slyke进一步推导了共轭酸碱对等缓冲体系的缓冲值β的具体数学表达式,这些表达式至今仍被广泛采用,其中共轭酸碱对的缓冲值β的表达式见式(2)。
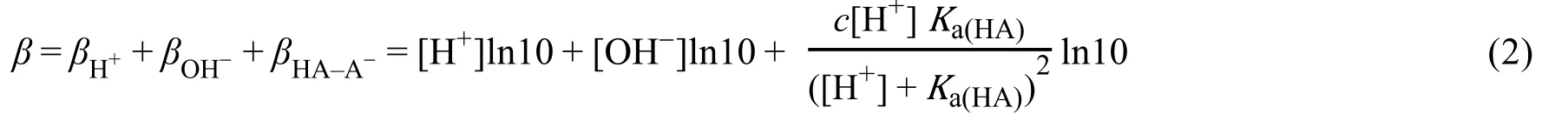
其中Ka(HA)、[H+]及[OH−]分别表示弱酸HA的解离常数、溶液中H+的浓度和OH−的浓度。Slyke的定义是一个微分值,包含着两个默认的规定:1)β是缓冲溶液的一个瞬态性质,即β会随着缓冲溶液组成的任何变化相应地发生改变;2) 拟对抗的外加物(外加给缓冲液的酸或碱)的体积被认为是零或者小到可以忽略不计(比如外加物为少量固体),即认为缓冲溶液在缓冲过程中体积不发生改变,实际上这并不可能发生,但这一抽象的规定依然有其显著的意义,本文也会加以讨论。
1937年Kolthoff[4]把缓冲值改称为缓冲容量(或缓冲指数)。1954年Bates认为Slyke的那些具体表达式忽视了稀释效应对缓冲能力的影响,为了对Slyke的概念进行完善和发展,他提出了稀释值(ΔpH1/2)的概念[5],稀释值是指被等体积的纯水稀释后缓冲液pH的增加值,其数学表达式为ΔpH1/2=(pH)ci/2− (pH)c,由该定义可知:ΔpH1/2越小, 缓冲溶液的抗稀释能力越强,但他并未探讨稀释值和β的定量关系;1966年John Butcher[6]在计算缓冲容量β时就充分考虑了稀释效应的影响;1987年彭笑刚[9]在Bates的基础上给出了考虑稀释效应时共轭酸碱对型缓冲溶液缓冲容量β的具体表达式,见式(3),其不同于式(2)。
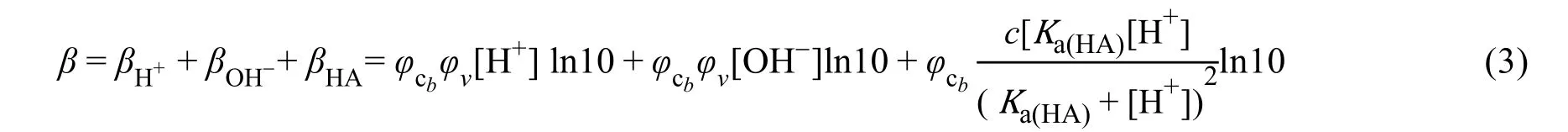
其中φcb表示浓度因子,φv表示稀释因子。1989年到1990年,胡乃非[10]和王克强[11]基于Bates考虑稀释的理念,推导出更多酸碱缓冲体系缓冲容量β的具体表达式,发现“同一酸碱溶液的缓冲容量β的大小在很大程度上取决于外加酸碱的种类及其浓度大小”。甚至有学者认为“很难用缓冲容量β作为衡量一个溶液缓冲能力的标准”[8]的结论。其实这一系列对Slyke异议的本质是期望改变Slyke关于β定义的第二个规定,Bates等认为:缓冲液在对抗外加酸或碱时必然伴随着缓冲液的稀释,外加物的体积不能忽略,在计算缓冲容量β时应该考虑这一稀释因素;这些考虑了稀释效应的β表达式虽然可以在计算β时实现对缓冲液体积的微分,然而,β的计算也变得更为复杂,更值得注意的是,文献[8]的结论显然有悖提出β这一指标的“初衷”,不利于直观地衡量缓冲溶液的缓冲能力,也许正是由于这个原因,在计算β时考虑稀释的计算方法及其应用鲜有后续研究。Slyke的β表达式(2)虽然含有抽象的体积假设,但它使得酸碱缓冲溶液的缓冲能力有了一个独立于外加物种类和浓度的衡量标准。
除了以上采用微分式作为指标来衡量缓冲能力之外,1980年戴明等[12,14]提出了积分缓冲容量α的概念(以区别于以上微分形式的缓冲容量β),即:使1 L溶液的pH值改变指定pH范围时需要强酸碱的量,并给出了积分表达式,见式(4)。

1981年张懋森等[13]进一步推导了共轭酸碱对型缓冲体系的积分缓冲容量β(张懋森延续了微分缓冲容量的表示符号β,但此处β的意义完全不同于微分缓冲容量,而是戴明[12,14]的积分缓冲容量)的计算式,原文表达式见式(5)。
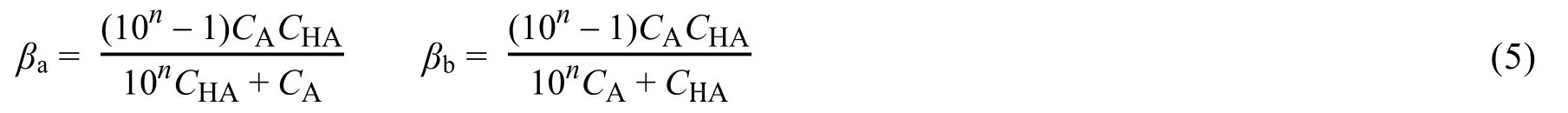
用以解决“当一定量缓冲溶液的pH允许改变n个单位时,计算所能对抗外加酸或碱的最大量”这类实际问题。作为衡量缓冲溶液缓冲能力的又一指标即积分缓冲容量α,考虑了缓冲过程中实际存在的稀释效应,这一点与Slyke的缓冲指数也有所不同。20世纪90年代以来,国内外学者[15,18,19]进一步明确把微分缓冲容量称为缓冲强度β(或缓冲指数β),积分缓冲容量称为缓冲容量α,而鲜有采用IUPAC“模糊”的定义[7](The capacity of a solution to resist changes in pH on the addition of strong acid or strong base which may be expressed numerically as the number of moles of strong acid or strong base required to change the pH by one unit when added to one liter of the specified buffer solution)。
微分式(1)表示的是缓冲溶液的一种瞬态缓冲能力,缓冲溶液在对抗外来少量酸或碱的同时自身也在不断地发生着组成上的变化,而由这一组成决定的缓冲能力必然是一个动态的瞬态指标;而积分式(4)表示的是缓冲溶液的一种持续缓冲能力,这一能力必须经过一个持续的缓冲过程来体现,由于它考虑了实际存在的稀释作用,所以在实践中的应用更为广泛。
1.2 《化学分析》教材有关缓冲能力计算的商榷之处
在现行通用教材[23]第202页有道例题涉及缓冲溶液缓冲能力的计算,例题题干为“用0.0200 mol·L−1EDTA溶液滴定25.00 mL 0.0200 mol·L−1Pb2+溶液,若Pb2+溶液的pH = 5.0,如何控制溶液的pH在整个滴定过程中不超过0.2 pH单位?”,为了对抗Pb2+的加入所引起的pH的变化,需要采用六亚甲基四胺及其共轭酸(pKa= 5.15)作为缓冲体系以控制溶液的pH,求解这个题目的关键一步是获得六亚甲基四胺及其共轭酸的初始总浓度c总,教材中获得c总的思路如下:
根据题意有:

式(7)中的β、Ka及[H+]都已获知,所以可以获得c总= 0.358 mol·L−1(教材上c总的计算结果是0.39,这是由于Ka取值不当造成的结果),其中[A−]初始及[HA]初始分别是0.149 mol·L−1和0.209 mol·L−1。
然而,以上例题中“在整个滴定过程中不超过0.2 pH单位”是一个典型的涉及过程的缓冲容量α的描述,而且该题目中随着缓冲的进行缓冲液的体积会从25 mL变化到50 mL (微分式计算默认的一个前提是缓冲过程中溶液体积不改变或其改变可以忽略),这些因素本都不指向采用微分式的β来衡量缓冲能力,而本例题的解法中却采用了微分式(7)来计算;另外,式(6)中的β计算式既不是微分式也不是积分式,其实是一个(平均缓冲强度β),其计算结果却被等同于微分式(7)的计算结果。教材中的解法错了吗?
为了回答这个问题,可以采用积分法计算并获得c总,然后和以上计算结果做个对比。根据题意,溶液的初始pH始是5.0,当1 L溶液中外加0.04 mol H+(加入0.02 mol Pb2+后,EDTA释放出H+的量)后pH的降低值不能超过0.2个单位,根据积分式(4),得式(8)。

其中[HA] =c总·[H+]/([H+] +Ka),[A] =c总·Ka/([H+] +Ka),而n= 0.2,Ka= 10−5.15,[H+] = 10−5.0。由此计算获得c总= 0.380 mol·L−1。并进一步由式(9)和式(10)得到[A−]初始及[HA]初始。

经计算,滴入Pb2+之前溶液中的[A−]初始及[HA]初始分别是0.158 mol·L−1及0.222 mol·L−1,这些数据和教材上的计算结果接近但不相同,毋庸置疑,采用积分式的结果更为准确,那么教材上的计算会带来多大的误差呢?
针对此问题,可以绘制缓冲液的pH随滴定进程的变化曲线,同时观察在滴定过程中ΔpH是否始终没有超过0.2个单位,滴定过程中pH的准确计算公式为式(11)。

式中VPb2+为Pb2+溶液滴入的体积,将此处采用积分式获得的及教材中获得的[A−]初始及[HA]初始分别代入式(11),可获得按照两种不同算法配制缓冲液后其pH随滴定进程的变化曲线,见图1中a和b。
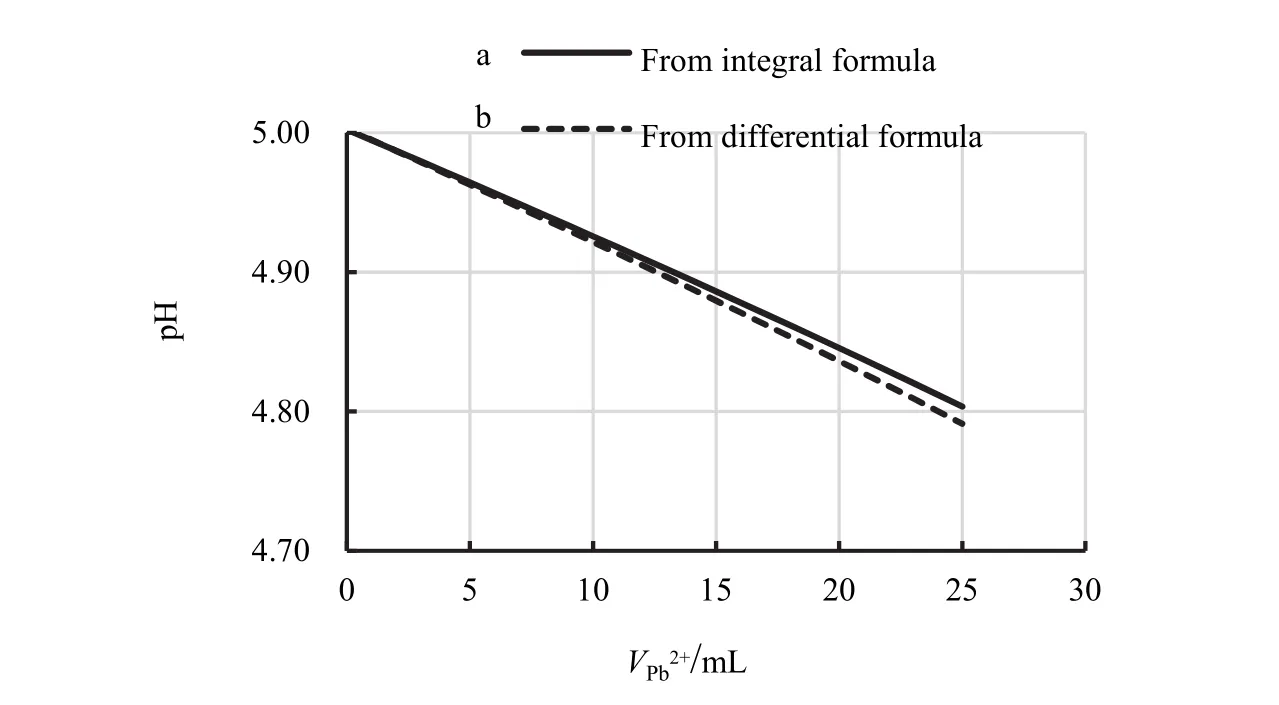
图1 缓冲液的pH随VPb2+的变化
由图1可以看出:a和b两条曲线变化趋势大致相同,a (来自积分式)完全在pH初始的0.2个pH单位内,而b (来自微分式)稍微超出了这个范围;换言之,采用微分式计算其结果虽然没有积分式那么准确,但其计算结果在一定的公差内可以接受。这里就产生一个新的问题:在一个分明需要采用积分式计算的情况下教材中采用了微分式,却也获得了具有一定接受度的结果,例题的这一做法是否含有普遍的规律从而可以推广呢?对缓冲液的pH及其变化范围ΔpH有没有一些限定呢?
为了回答这个问题,有必要研究一下共轭酸碱对(HA-A−)型缓冲液的缓冲强度β(来自微分式)及缓冲容量α(来自积分式)随溶液pH的变化规律。我们忽略离子强度的影响,根据缓冲液pH计算公式及上文中的公式(2)和(3),利用Excel软件绘制了具有固定总浓度(六亚甲基四胺及其共轭酸的总浓度c总= 0.380 mol·L−1)的缓冲液在对抗外加H+/OH−时有关变量随pH的变化曲线,见图2,具体数据及图表制作见补充材料Excel文件。图2a为外加[H+]随溶液pH变化的曲线,由其可以进一步获得缓冲强度β(Slyke定义的微分式1)随pH变化的曲线,见图2b。在图2b上,当pH = 5.0时,其瞬态β的计算式就是例题中的式(7),其准确数值应为0.21 mol·L−1(见补充材料);例题中式(6)计算的是对应于指定缓冲范围(pH5.0–pH4.8)的平均缓冲强度,其数值=积分缓冲容量α/缓冲宽度=0.20 mol·L−1,一般情况下这个平均缓冲容量(对应pH5.0–pH4.8)和瞬态缓冲容量(对应pH5.0)是不相等的,而例题中把这两者等同了起来,这便是例题解法欠准确的根源所在。另一个方面,从图2a中可以看出,当pH处于pKa(5.15)左右时,外加[H+]随pH的变化呈现一定的线性,其变化率(即β)随pH变化的波动性较小,其波动性可在图2b中得到准确衡量,可以看出:当pH处于pKa(5.15) ± 0.4这个区间内时,其极值波动性也不超过20%,这个区间的曲线是整个曲线较为平坦的部分;图2c属于图2b上的较平坦部分,其pH从5.0变化到4.8,对应的缓冲强度β从约0.21 mol·L−1逐渐降低到约0.19 mol·L−1,而这个区间的平均缓冲强度为0.20 mol·L−1(平均值并不严格位于区间两个端点值正中间,因为β并不随pH线性变化),因此这个瞬间缓冲强度β(对应pH5.0)和区间平均缓冲强度(对应pH5.0–pH4.8)相差不超过5%,在例题中把他们等同,从而简化了计算过程,获得了在一定误差范围内可以接受的计算结果。综上,例题解题时采用的计算公式是可以接受的;然而,未能首先就可否采用简便运算进行判断,这在解题思路和步骤上都是不完善的,作为例题还可能会误导读者,把在一定限定条件下的做法当做普遍真理。
在滴定过程中,缓冲溶液的体积其实是不断增大的,按照式(3)绘制“考虑稀释效应的缓冲强度β”随pH的变化曲线,见图2d,可以看出:考虑了稀释效应后,随着缓冲过程的实际进行,“考虑稀释效应的缓冲强度β”急剧降低,从而也无法进行如上例题中的简便运算。通过对比,再次凸显了不考虑稀释效应的缓冲强度(或缓冲指数)这一概念的优势。
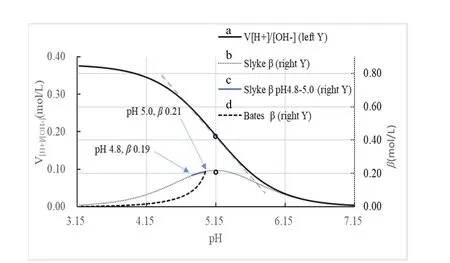
图2 外加酸碱的V[H+]/[OH−]及缓冲液β随缓冲液pH的变化
由图1和图2可以得到:对于缓冲溶液,在计算有关持续缓冲的问题时采用积分式总是正确的选择,但是当缓冲液的pH变化处于pKa± 0.4范围时,由于此时da/dpH ≈ Δa/ΔpH,所以在准确度要求不高的情况下,可以采用微分式进行有关简化计算,如果忽略该前提而任意使用就会带来较大误差[22]。关于这一点教材[23]中也有提及,但是表述不够严谨,教材上的表述为“如果在缓冲溶液中加入的酸或者碱的量很少,所引起的pH的变化也很小(< 0.4),此时可以用ΔpH代替dpH,Δa或者Δb代替da或者db”,应该修正为“如果在缓冲溶液中加入的酸或者碱的量较少,同时缓冲液pH在pKa± 0.4区间内变化,此时可以用Δa(或Δb)/ΔpH代替da(或db)/dpH,这种替代引入的pH计算误差一般不超过10%”。
2 广泛缓冲溶液和两性物质的缓冲能力
一个酸碱缓冲溶液的缓冲强度β是其pH的函数,对于由多个共轭酸碱对组成的缓冲液,其总缓冲强度β等于各共轭酸碱对独立的β的加和[24],由此可以通过叠加多对共轭酸碱对的β-pH曲线来获得复杂缓冲溶液的β-pH曲线[25],基于此人们研究了常湘滨[26]提出的广泛缓冲溶液的β随其pH的变化规律[27–30],配制了具有恒定缓冲强度、宽程等特性的缓冲液。
研究[31,32]揭示一些两性物质能够通过单一化学组成的溶解形成缓冲溶液,这样的两性物质一般必须满足一定的条件,即:溶解后必须形成至少两对共轭酸碱对,且共轭酸碱对中共轭酸的pKa之间的差值必须小于一定的数值(ΔpKa≤ 5.326 + lg(c酸碱对1总·c酸碱对2总)[33],比如一定浓度的酒石酸氢钾、邻苯二甲酸氢钾、柠檬酸二氢钾及硼砂溶液可成为缓冲溶液,而像乙酸铵这种ΔpKa太大的两性物质就不行,由两性物质溶解获得的缓冲溶液的特点是缓冲范围较宽。
3 思考及倡议
综上,我们倡议:可以用两个指标从不同角度来衡量酸碱缓冲溶液的缓冲能力,一个指标可称为“缓冲强度β”或“缓冲指数β”,另外一个指标可以称为“缓冲容量α”。“缓冲强度β”是酸或碱溶液中主要组分的pH分布曲线在某pH处的斜率,其数学表达式见式(1),它不考虑稀释效应,基于此而计算得到的β与外加酸碱的种类和体积无关,可以用来比较不同缓冲溶液在指定pH下的瞬态缓冲能力;而“缓冲容量α”,是在酸碱缓冲液的“缓冲强度β”随pH (X轴)的变化曲线上,某一区间的β(对应缓冲过程的ΔpH)在pH轴上投影时的面积,其数学表达式见式(4),它考虑了稀释效应,可以用来比较不同缓冲溶液在缓冲过程中(对应ΔpH)的持续缓冲能力。这一区分的建议也是很多同行的声音[12–20]。“缓冲强度β”(微分式)和“缓冲容量α”(积分式)在分析化学教学和实践中都有着重要的意义。
为了方便计算,在实践中也常采用区间平均缓冲强度,其数值=对应区间的积分缓冲容量α/缓冲区间宽度ΔpH,当积分式的积分范围缩至无限小时,即ΔpH → dpH,区间平均缓冲强度 →瞬态缓冲强度β,文献[22]及教材[23]中也有提及。
补充材料:可通过链接http://www.dxhx.pku.edu.cn免费下载。

