miR- 145- 5p靶向ARK5调控人上皮性卵巢癌细胞增殖凋亡的作用
武 磊,周文勤,袁琳楠,李 洁,裴美丽
1西安交通大学第一附属医院妇产科,西安 710061 2西安市中心医院妇产科,西安 710003 3商南县中医医院妇产科,陕西商洛 726300 4西安交通大学第一附属医院病理科,西安 710061
卵巢癌是妇科恶性肿瘤相关死亡的主要原因之一,因其组织来源及结构复杂、位置较深,不易被表面触及,约80%的患者确诊时即为中晚期,且多数已有盆腔各器官及腹腔大网膜转移,5年生存率多年来徘徊在30%左右。虽然分子靶向研究联合临床试验取得了很大进展,如聚ADP核糖聚合酶抑制剂(poly ADP-ribose polymerase inhibitor,PARPi)已应用于晚期上皮性卵巢癌的维持治疗,可显著延长患者无进展生存期[1],但卵巢癌仍严重威胁着妇女的生命安全,其总体生存率亟待进一步提高。miR- 145是新近研究比较明确的抑癌基因,研究显示其能抑制卵巢癌细胞的增殖、侵袭、转移[2]、耐药[3]和上皮间质转化(epithelial-mesenchymal transformation,EMT)[4]等生物进程,但具体机制仍需进一步研究。根据TargetScan软件在线预测,我们发现腺苷5’-磷酸(amp)激活蛋白激酶-相关蛋白激酶- 5[adenosine 5’-monophosphate(amp)activates protein kinase-related protein kinase 5,ARK5]是miR- 145的靶基因之一。ARK5又称NUAK1,属于腺苷5’-磷酸(amp)激活蛋白激酶[adenosine 5’-monophosphate(amp)activates protein kinase,AMPK]亚家族成员,多项研究显示,ARK5对于癌症患者的生存至关重要,在不同类型的癌症中,ARK5表达升高与细胞恶性行为呈正相关,包括化疗耐药、早期转移和不良预后[5- 8]。本研究探讨了miR- 145- 5p对人上皮性卵巢癌细胞增殖和凋亡的影响及可能涉及的分子机制,以期为阻止卵巢癌的发展进程提供新的研究思路。
材料和方法
实验细胞系和试剂人卵巢癌细胞株SKOV3为西安交通大学机能细胞实验中心馈赠,人正常卵巢上皮细胞IOSE80购自北京北纳创联生物技术研究院。胎牛血清购自杭州四季青公司,RPMI- 1640培养液购自美国Hyclone公司,细胞消化胰酶、BCA蛋白定量试剂盒购自上海碧云天生物技术公司,miR- 145- 5p mimic(模拟物)、control(mimic NC 模拟物阴性对照)购自上海吉玛制药有限公司,转染试剂LipofectamineTM2000购自美国Invitrogen公司,反转录试剂盒购自美国Thermo公司,实时定量PCR试剂盒购自日本TaKaRa试剂公司,CCK- 8试剂盒购自西安鼎国商贸有限责任公司,Annexin V-FITC/PI细胞凋亡试剂盒购自南京凯基生物技术有限公司。ARK5抗兔多克隆单抗购自美国Cell Signaling Technology公司;β-actin抗兔克隆单抗购自武汉三鹰生物技术有限公司,二抗购自北京天德悦生物技术有限公司;PVDF膜及底物发光液均购自美国millipore公司。
细胞培养人卵巢癌细胞株SKOV3用含10%胎牛血清及1%双抗的RPMI- 1640培养液进行细胞传代培养,在5% CO2、37 ℃细胞培养箱内培养,细胞融合度达80%时进行细胞传代。人正常卵巢上皮细胞IOSE80培养条件:37 ℃、5% CO2、CM2- 1培养液。CM2- 1培养液为90% RPMI- 1640+10% FBS。RPMI- 1640为含谷氨酰胺的1640培养液。
细胞瞬时转染将生长状态良好、处于对数期的细胞以3×105个/孔接种于6孔板中,37 ℃细胞培养箱内常规培养至细胞融合度60%,采用LipofectamineTM2000转染试剂瞬时转染,将miR- 145- 5p mimic与miR-control分组转染入细胞,在超净工作台内避光操作。转染48 h后提取RNA进行实时定量PCR检测转染结果。所有实验均重复3次,取平均值进行分析。
qRT-PCR检测将细胞接种于6孔板内并做相应处理,采用Trizol法按实验步骤提取细胞中的总RNA,用分光光度计检测RNA浓度,当A260/A280值介于1.8~2.0间时可进一步行RNA反转录。采用Thermo反转录试剂盒进行RNA反转录,-20 ℃保存备用。qRT-PCR反应体系为20 μl,将RNA反转录所得cDNA用灭菌ddH2O稀释10倍,mRNA按以下反应体系进行实时荧光定量PCR反应:SYBY Green 10 μl,上游引物 0.4 μl,下游引物 0.4 μl,cDNA模板4.0 μl,ddH2O 5.2 μl,总体积 20.0 μl。对miRNA进行实时荧光定量PCR时,考虑到含量本身较少,cDNA不稀释,按以下反应体系进行反应:SYBY Green 10 μl,上游引物0.8 μl,下游引物0.8 μl,cDNA模板4.0 μl,ddH2O 4.4 μl,总体积20.0 μl。mRNA的反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环。每一个样品设置3个复孔,实验重复3次,以β-actin为内参,采用2-ΔΔCt方法计算相对定量(relative quantification,RQ)值,取平均值。miRNA的反应条件:95 ℃ 30 s,95 ℃ 5 s,50 ℃ 30 s,40个循环。每一个样品均设置3个复孔,实验重复3次,以U6为内参,采用2-ΔΔCt方法计算RQ值,取平均值。
2-ΔΔCt法:(1)用内参基因的CT值(样品扩增产物的荧光信号达到所设定的荧光阈值时需要的循环数)归一目标基因的CT值:(2)ΔCT(test)=CT(target,test)-CT(ref,test),ΔCT(calibrator)=CT(target,calibrator)-CT(ref,calibrator);(3)用校准样本的ΔCT值归一实验样本的ΔCT 值:ΔΔCT=ΔCT(test)-ΔCT(calibrator);(4)计算表达水平比率:2-ΔΔCT=表达量的比值。
引物序列:(1)miR- 145- 5p:F:5’-GTCCAGTTTTCCCAGGAF- 3’,R:5’-GTGCAGGGTCCGAGGTF- 3’;(2)U6:F:5’-CTCGCTTCGGCAGCACATATACT- 3’,R:5’-ACGCTTCACGAATTTGCGTGTC- 3’;(3)β-actin:F:5’-TCCCTGGAGAAGAGCTACGA- 3’,R:5’-AGCACTGTGTTGGCGTACAG- 3’;(4)ARK5:F:5’-GAGTCCACTCTATGCAT- 3’,R:5’-ATGTCCTCAATAGTGGCC- 3’;(5)miR- 145- 5p:RT primer:5’-CGTATCCAGTGCAGGGT-CCGAGGTATTCGCACTGGATACGACAGGGAT- 3’;(6)U6:RT primer:5’-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACAAAATA- 3’。
靶基因预测和筛选用生物信息学数据库TargetScan(http:/www.TargetScan.org/)预测miR- 145的靶基因,统计靶基因个数,列出权重分数绝对值高于0.50的进行筛选,结合文献选取其中与细胞增殖、凋亡相关的ARK5基因进行下一步研究。
CCK- 8法检测细胞增殖采用CCK- 8法检测细胞增殖情况,具体为:将瞬时转染处理后的细胞调整至5×103个/孔均匀铺于96孔板中,培养液100 μl/孔,放置于培养箱中培养过夜。24 h后换含10μl CCK- 8的新鲜细胞培养液,将培养板在培养箱内继续孵育2 h,用酶标仪测定各孔细胞在450 nm处的吸光度。每组设4个复孔,实验独立重复3次,取平均值。增殖率=(实验组OD-对照组OD)/对照组OD×100%。
Annexin V-FITC/PI 双染法检测细胞的凋亡将转染后的细胞培养24 h,用不含EDTA的胰酶消化细胞后,加入培养基终止消化,按说明书收集细胞,加入300 μl的1×Binding Buffer(缓冲液)悬浮细胞。加入5 μl的Annexin V-FITC混匀后,再加入5 μl的PI染色,室温避光孵育15 min,于1 h内上机。
Western blot检测IOSE80(或SKOV3)细胞种于6孔板内,24 h贴壁后分别进行转染处理,待细胞处理到检测时间点时,每孔加入RIPA 裂解液150 μl、PI 6 μl、PMSF 3 μl,冰上孵育30 min,每隔5 min晃动1次;移入离心管中,4 ℃、12 000 g 离心15 min,上清液即为总蛋白质;吸取上清,用BCA蛋白定量试剂盒测定蛋白质浓度。根据浓度计算加样体积,加等体积的2×电泳加样缓冲液,沸水浴5~10 min,每孔上样量保持一致。电泳(80 V/30 min,120 V/70 min),电转膜仪转膜(200 mA/60 min)。5%脱脂奶粉封闭2 h,洗膜10 min 3次;一抗孵育4 ℃过夜,洗膜10 min 3次;二抗孵育室温2 h,最后洗膜10 min 3次,滴上发光液显色。
双荧光素酶基因验证报告实验采用双荧光素酶基因验证报告实验验证miR- 145- 5p与ARK5的相互作用关系,ARK5 mRNA的野生型全长3’-UTR以及突变型3’-UTR扩增并连接到psi-CHECK- 2载体(美国Promega公司),分别命名为野生型WT-ARK5 psiCHECKTM- 2 载体组和突变型MT-ARK5 psiCHECKTM- 2载体组。细胞共转染200 nmol/L miR- 145- 5p mimic和100 ng质粒,24孔板培养48 h。收集细胞裂解,海肾和萤火虫荧光素酶荧光强度使用Dual-Luciferase报告分析系统进行分析,重复3次。
统计学处理采用SPSS 20.0统计软件,符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本双侧t检验,柱状图及生长曲线用Graphpad软件绘制,P<0.05为差异有统计学意义。
结 果
miR- 145在卵巢癌细胞中表达降低根据细胞培养说明,常规复苏并培养SKOV3和IOSE80两个细胞系,qRT-PCR法检测miR- 145- 5p的表达,结果显示,miR- 145- 5p在卵巢癌SKOV3细胞中的表达水平明显低于正常人卵巢上皮细胞IOSE80(5.347±1.485比9.813±0.242;t=4.345,P=0.049)。
转染miR- 145- 5p mimic可以促进SKOV3细胞中miR- 145- 5p的表达以miR- 145- 5p mimic及control转染SKOV3细胞,达到作用时间点时提取细胞的总RNA,随后进行反转录及qRT-PCR实验,结果显示,miR- 145- 5p mimic组细胞的miR- 145- 5p表达量明显高于control组(2594.000±58.620比0.993±0.115;t=76.640,P=0.002),control组与阴性对照组相比差异无统计学意义(0.993±0.115比1.000±0.001;t=1.008,P=0.419)。
过表达miR- 145- 5p可抑制卵巢癌细胞增殖,促进细胞凋亡CCK- 8检测结果显示,miR- 145- 5p过表达组细胞的增殖率明显低于control组[(48.580±5.392)%比(98.140±0.699)%;t=-15.790,P<0.001],而control组与阴性对照组相比差异无统计学意义[(98.140±0.699)% 比(99.100±0.890)%;t=1.786,P=0.216];流式细胞术检测结果显示,miR- 145- 5p过表达组细胞的凋亡率明显高于control组[(47.270±4.027)% 比(29.980±1.715)%;t=5.433,P=0.032](图1)。
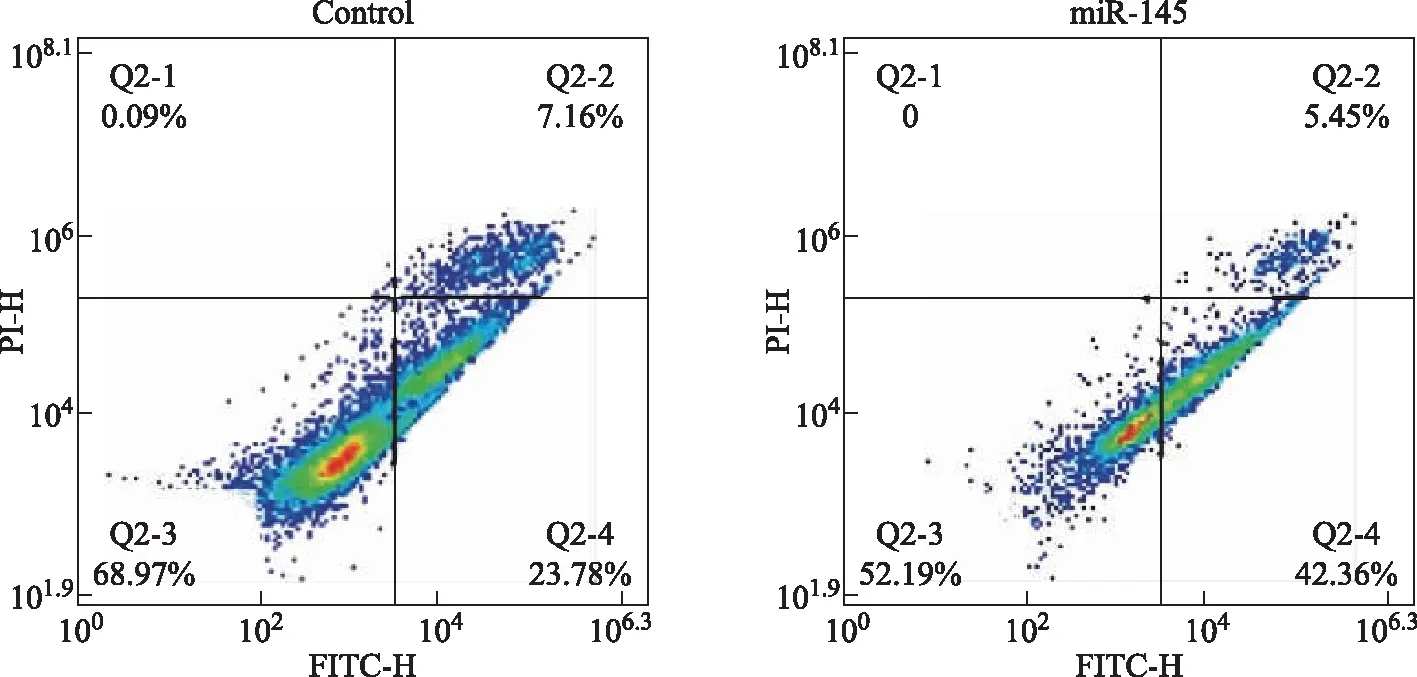
图1 流式细胞检测结果显示miR- 145- 5p过表达组细胞的凋亡率高于control组Fig 1 The results of flow cytometry showed that the apoptosis rate of the miR- 145- 5p overexpression group was higher than that of the control group
ARK5是miR- 145- 5p的靶基因TargetScan在线预测结果显示,ARK5 3’-UTR上存在潜在的与 miR- 145- 5p靶向结合的位点(图2)。检测过表达miR- 145- 5p及control细胞中ARK5的表达水平,结果显示,过表达miR- 145- 5p可以下调细胞中ARK5的mRNA表达水平(0.460±0.065比1.000±0.010;t=-12.824,P<0.001)及蛋白表达水平(0.310±0.085比 0.670±0.102;t=-4.792,P=0.001)(图3)。根据ARK5互补序列构建荧光素酶质粒(图4),进一步进行双荧光素酶基因验证报告基因实验,结果显示:miR- 145- 5p mimic+ARK5-WT组细胞的荧光素酶活性(0.461±0.132)明显低于共转染mimic control的NC组(1.020± 0.030;t=-6.421,P=0.016)和ARK5-WT 3’UTR组细胞(1.003±0.670;t=-5.383,P=0.010),而miR- 145- 5p mimic+ARK5-MUT组细胞与NC+ARK5-MUT组细胞的酶活性差异无统计学意义(1.003±0.670比1.020±0.030;t=1.145,P=0.082)。

图2 ARK5 3’-UTR上潜在的与miR- 145- 5p靶向结合的位点Fig 2 Potential binding site of miR- 145- 5p with ARK5 3’-UTR
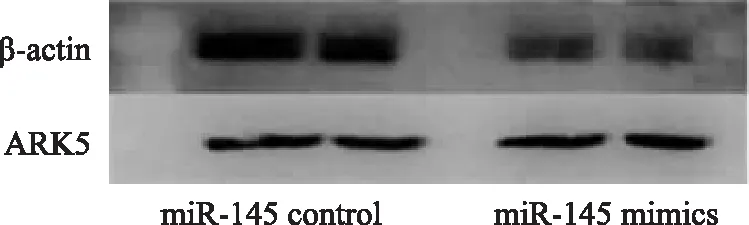
图3 Western blot 检测结果显示过表达miR- 145- 5p可以下调细胞中ARK5蛋白的表达水平Fig 3 Western blot showed that overexpression of miR- 145- 5p can down-regulate the protein level of ARK5 in cells
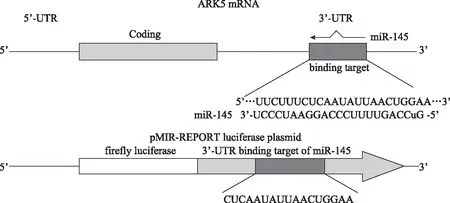
图4 人ARK5 3’-UTR、miR- 145- 5p和pMIR-REPORT荧光素酶质粒的生物学信息Fig 4 Biological information of human ARK5 3’-UTR,miR- 145- 5p,and pMIR-REPORT luciferase plasmid
过表达ARK5可促进卵巢癌细胞增殖,抑制细胞凋亡克隆ARK5全部序列构建GV219(+)载体,合成促ARK5过表达质粒,然后将ARK5过表达质粒及空载体vector分别转染入SKOV3细胞中,qPT-PCR和Western blot检测结果显示,ARK5过表达质粒转染组SKOV3细胞中的ARK5 mRNA表达水平(432.500±10.001比0.993±0.115;t=74.820,P<0.001)和蛋白表达水平(6.260± 0.420比0.930 ± 0.180;t=6.397,P=0.003)均明显高于vector转染组(图5)。CCK- 8检测结果显示,在同一细胞恒温培养箱中培养24h之后,ARK5过表达组细胞的增殖率明显高于vector转染组[(41.601±4.341)% 比(18.960±5.394)%;t=27.290,P<0.001],vector转染组细胞与阴性对照组相比差异无统计学意义[(18.960±5.394)%比(16.120±1.642)%;t=1.786,P=0.216]。流式细胞术检测结果表明,ARK5过表达组细胞的24 h凋亡率明显低于vector转染组 [(13.740±1.010)%比(29.320±0.210)%;t=-8.241,P=0.001](图6)。
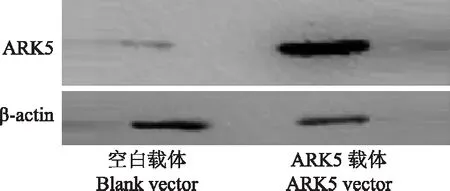
图5 Western blot检测结果显示ARK5过表达质粒转染组SKOV3细胞中的ARK5蛋白表达水平高于vector转染组Fig 5 Western blotting showed that the protein level of ARK5 in the SKOV3 cells transfected with ARK5 overexpression vector was higher than that in the cells transfected with the blank vector
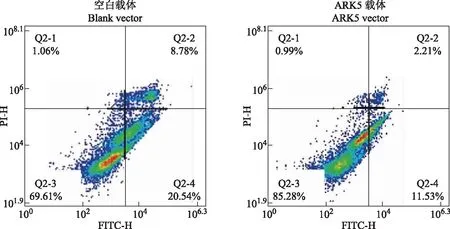
图6 流式细胞术检测结果显示vector转染组细胞的24 h凋亡率高于ARK5过表达组Fig 6 The results of flow cytometry showed that the 24 h apoptosis rate of the cells transfected with the blank vector was higher than that of the cells transfected with ARK5 overexpression vector
miR- 145- 5p靶向ARK5可抑制卵巢癌细胞增殖,促进细胞凋亡将SKOV3细胞分为阴性对照组、miR- 145 mimic组和miR- 145 mimic+ARK5过表达质粒组,分别进行细胞转染,CCK- 8检测结果显示,miR- 145 mimic组细胞的增殖活性明显低于阴性对照组[(47.580±5.392)% 比(97.201±0.699)%;t=-14.490,P=0.003],miR- 145 mimic+ARK5过表达质粒组明显高于miR- 145 mimic组[(99.430±0.545%)%比(47.580±5.392)%;t=15.580,P=0.004]。流式细胞术检测结果显示,miR- 145 mimic组细胞的凋亡率明显高于阴性对照组[(37.020±0.201)%比(26.160±1.010)%;t=6.455,P=0.023],miR- 145 mimic+ARK5过表达质粒组明显低于miR- 145 mimic组[(23.620±0.910)%比(37.020±0.210)%;t=-12.470,P=0.006](图7)。
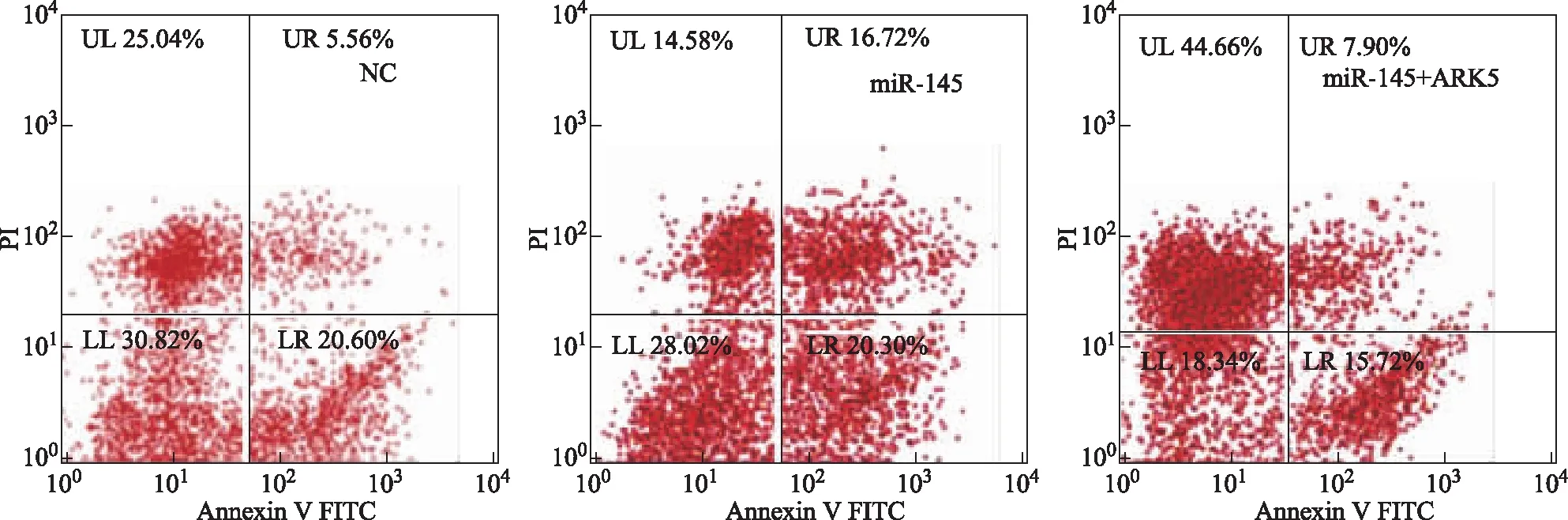
图7 流式细胞术检测结果显示miR- 145 mimic组细胞的凋亡率高于阴性对照组,miR- 145 mimic+ARK5过表达质粒组低于miR- 145 mimic组Fig 7 The results of flow cytometry showed that the apoptosis rate of the miR- 145 mimic group was higher than that of the negative control group and the miR- 145 mimic + ARK5 overexpression plasmid group
讨 论
卵巢癌是女性与癌症相关死亡的第5大诱因,居妇科恶性肿瘤死因首位,也是40岁以上女性中仅次于乳腺癌的常见恶性肿瘤,尤其是在发达国家。全球每年约有24万新诊断卵巢癌患者[9]。因卵巢癌早期症状不明显,患者被发现时多已进入中晚期[10- 11]。在诊断为晚期(FIGO Ⅲ或Ⅳ期)浸润性上皮性卵巢癌的女性中,5年存活率不足50%[12],且复发率极高。因此,积极探索卵巢癌发生、发展的相关分子机制,寻求更加有效的治疗方案,是目前亟需解决的问题。
miRNAs是不编码蛋白质的小单链RNA,在真核生物中广泛存在,通过与靶癌基因序列互补结合,发挥沉默靶癌基因或抑制其表达的作用[13]。miRNAs可调节细胞周期、增殖、凋亡、分化、应激等生物进程[14],还与肿瘤相关基因的表达和调控密切相关,影响肿瘤的发生和发展[15]。miR- 145被发现在多种肿瘤中表达下调[16- 20],是人体的保护基因,承担着维护机体正常运转的角色。鉴于对miR- 145作用机制的了解,本研究旨在探讨miR- 145- 5p在上皮性卵巢癌(最常见的卵巢癌组织类型,发病率占卵巢癌85%~90%)细胞中的表达及其对癌细胞增殖、凋亡的影响及可能涉及的分子机制。
本研究首先通过qRT-PCR实验,证实miR- 145- 5p在卵巢癌细胞中的表达水平显著低于正常卵巢上皮细胞,与其他肿瘤组织中结果一致,发挥抑癌作用。CCK- 8及流式细胞术检测结果表明,miR- 145- 5p可抑制癌细胞的增殖,促进癌细胞凋亡。为了研究miR- 145- 5p抑制卵巢癌的作用机制,本研究采用TargetScan软件在互联网上预测其潜在的靶基因,发现并通过分子交互实验证实了其在卵巢癌中的直接分子靶标ARK5。ARK5与癌细胞之间的关系已在许多癌症类型中得到验证,如胆管癌[21]、肝癌[22]和鼻咽癌[23]。ARK5可以多种方式参与癌症的发展和进程:ARK5是Akt信号通路上的分子,AKT磷酸化可以通过激活ARK5抑制凋亡来刺激癌细胞的入侵活动[24];Chang等[25]研究发现,ARK5可增强基质金属蛋白酶(matrix metalloproteinase,MMP)- 2和MMP- 9表达,促进肿瘤的侵袭和迁移。ARK5还可通过核因子κB转录因子调节参与凋亡相关基因的表达,维持癌细胞的存活[26]。Phippen等[27]研究表明,ARK5通过促进EMT和激活丝氨酸/苏氨酸激酶/哺乳动物雷帕霉素靶蛋白/基质金属蛋白酶途径来增加SKOV3细胞侵袭潜能。另有研究发现,ARK5与卵巢癌的预后有关,其表达水平越高,卵巢癌患者的预后越差[28]。此外,ARK5还抵抗凋亡、激活癌细胞缺氧耐受以及调节信号通路。本研究进一步通过ARK5对卵巢癌细胞增殖和凋亡的影响以及miR- 145- 5p和ARK5两者相互作用的相关研究,明确了miR- 145- 5p可通过靶向ARK5抑制卵巢癌细胞的增殖,促进其凋亡。
综上,本研究结果显示,miR- 145- 5p可抑制卵巢癌细胞的增殖,促进癌细胞的凋亡,而ARK5发挥与其相反的作用。本研究通过靶基因预测和分子交互实验证实ARK5是miR-145的靶基因,受miR-145的直接调节。研究发现,miR-145也受到上游非编码RNA的调控。如:预示卵巢癌不良预后的环状RNA Hsa_circ_0009910,就是通过抑制miR- 145来诱导卵巢癌细胞增殖性和活动性表型[29];LncRNA SNHG1通过抑制miR- 145- 5p促进卵巢癌的发生[30]。且ARK5也可影响细胞侵袭、迁移、EMT进程等,至于miR- 145- 5p的上游分子以及其靶向ARK5作用于下游的哪个分子以及途径,本研究未做深入探讨,尚待进一步研究。

