自然衰老C57BL/6J雄性小鼠肝脏的定量与乙酰化修饰蛋白质组学特征
柳江枫,杨晔宏,武 乐,杨俊涛
1中国医学科学院 北京协和医学院 基础医学研究所医学分子生物学国家重点实验室,北京 100005
2南开大学统计与数据科学学院,天津 300071
衰老是存在于大多数生物体的复杂生物学过程,伴随时间依赖性的功能衰退[1]。衰老和衰老相关疾病已为个体和社会带来日益增长的负担[2]。因衰老的进展机制复杂,至今尚不明确,所以一直缺少能够有效延缓衰老的方案。生物组学技术在系统性研究复杂生物学过程中具备优势,并已应用于衰老研究领域[3]。既往研究表明,衰老过程伴随基因组不稳定、表观遗传改变、蛋白质稳态丢失和代谢紊乱[1,4]。作为人和小鼠最大的代谢器官,肝脏在衰老过程中整体变化的研究资料尚不全面。衰老肝脏的生理学变化不明显[5- 6],但分子层面已发生特征性改变。既往与肝脏衰老相关的整体性组学研究大多涉及转录组学[7- 8]、DNA甲基化特征[9- 10]、单细胞测序[11]等领域,而蛋白质组学研究资料较少。本研究采用串联质谱标签(tandem mass tag,TMT)标记定量和液相色谱串联质谱联用技术,联合比较了年轻与年老小鼠肝脏的蛋白质组学与乙酰化修饰蛋白质组学特征,以期为继续深入开展衰老研究提供有效数据集。
材料和方法
实验动物及分组野生型雄性C57BL/6J小鼠24只,购自北京维通利华实验动物技术有限公司,其中,2月龄小鼠14只(年轻组),18月龄小鼠10只(年老组)。本研究经中国医学科学院基础医学研究所实验动物使用管理与伦理委员会批准,动物实验伦理审查编号ACUC-A02- 2013- 001。
样本前处理对小鼠实施安乐死后,称取适量肝脏组织至预冷的研钵,在液氮环境将组织研磨成粉末。各样本分别添加4倍于粉末体积的8 mol/L尿素裂解缓冲液,冰上超声裂解。离心去除碎片,留上清液作为组织蛋白提取物,用BCA试剂盒(碧云天,P0011)测定蛋白质浓度。将每7只年轻小鼠的肝脏蛋白样本混合成1个样品,将每5只年老小鼠的肝脏蛋白样本混合成1个样品。混合后的4个样品蛋白量相同,用于后续分析。
用胰酶(Promega,V5280)将各样品从蛋白质酶解为肽段状态。根据TMT试剂盒(Thermo Fisher Scientific,90068)的操作说明为各个样品的肽段做TMT标记。标记后的肽段做高效液相色谱分离。用Agilent 300Extend C18(5 μm粒径,4.6 mm内径,250 mm长)色谱柱分离蛋白质组学分析的样本,获得9个组分。用Thermo Betasil C18(5 μm粒径,10 mm内径,250 mm长)色谱柱分离乙酰化修饰蛋白质组学分析的样本,获得4个组分。将应用于乙酰化修饰分析的肽段与乙酰化树脂(PTM Bio,PTM104)4 ℃共同孵育过夜。用0.1%三氟乙酸洗脱树脂结合的肽段,留待乙酰化修饰分析。
液相色谱-质谱联用分析采用EASY-nLC 1200超高效液相系统进行肽段分离。液相色谱流动相A相为含0.1%甲酸的水溶液,流动相B为含0.1%甲酸和90%乙腈的水溶液。设置40min液相梯度,流动相B从8%提升到80%,流速维持在400 nl/min。
超高效液相系统分离后的肽段被注入NSI离子源进行电离,然后进入Q ExactiveTMHF-X质谱仪进行串联质谱分析。数据采集模式选择数据依赖型分析(data-dependent analysis,DDA)模式,一级扫描选定的母离子进入HCD碰撞池进行碎裂,肽段母离子及其二级碎片高分辨率的Orbitrap质量分析器检测。
数据库搜索及生物信息分析质谱仪生成的原始raw文件用MaxQuant(1.5.2.8)进行检索。数据库文件选择2019年6月24日下载并增添反库和污染库的Swiss-Prot小鼠蛋白质数据库(17 014条序列)。数据库搜索参数与质谱仪检测参数保持一致。蛋白质组分析的漏切位点设为2,乙酰化修饰蛋白质组分析的漏切位点设为4。肽段-谱图匹配、蛋白质鉴定和修饰鉴定的假阳性率(false discovery rate,FDR)都设为1%。原始raw文件与MaxQuant搜库结果都通过iProx[12]上传至ProteomeXchange,并获得PXD号:PXD018003。
MaxQuant生成蛋白质、修饰位点鉴定表后,过滤去除反库、污染库匹配到的条目,再以每个样本的中值做数据质心化。用Perseus(1.6.5.0)软件的Significance A算法做差异筛选,Benjamini-Hochberg FDR<0.05的蛋白质/位点设定为差异表达。用年老小鼠的均值比年轻小鼠的均值计算每个蛋白质/位点的变化倍数(fold-change,FC),FC>1视为衰老过程中上调,FC<1视为衰老过程中下调。
采用通路分析(ingenuity pathway analysis,IPA)和基因本体(gene ontology,GO)数据库注释蛋白质,功能富集分析由R包clusterProfiler[13]实现。层次聚类分析、主成分分析(principle component analysis,PCA)和图像可视化由R实现。乙酰化修饰位点的基序分析应用Motif-x算法实现。
结 果
年轻与年老小鼠的蛋白质组学整体特征描述蛋白质组学检测共生成541 511张二级谱图,其中,77 726张二级谱图成功匹配到70 092条肽段(40 796条非重复肽段),谱图鉴定率为14.35%,结果良好。蛋白质组学共鉴定到5831个蛋白质,经过数据过滤筛选,4712个蛋白质可用于定量计算(图1A)。肽段长度主要分布在7~53个氨基酸范围内(图1B),提示胰酶酶切效果好。任意两样品间蛋白质整体定量的Pearson相关性系数≥0.99,提示检测体系稳定,所得数据满足质量控制要求(图1C)。用层次聚类分析与PCA评估各样品整体特征,结果显示年轻与年老小鼠肝脏蛋白质的整体表达模式有区别,且年老小鼠的肝脏蛋白表达量的变异程度略大于年轻小鼠(图1D、E)。
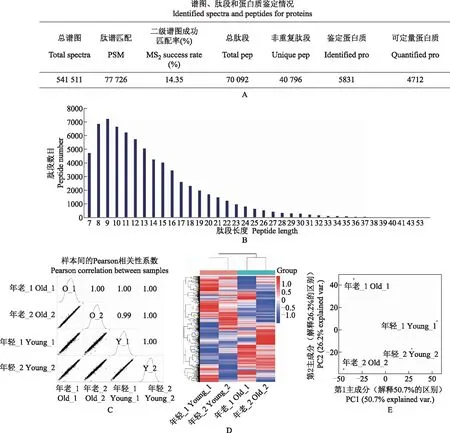
A.蛋白质组的谱图、肽段、蛋白质鉴定概况;B.蛋白质组全部肽段的长度分布柱状图;C.对蛋白质的定量值做log2转换,绘制各样品定量值的散点图和密度分布图,在图上标注样本间的Pearson相关性系数计算结果;D.年轻与年老小鼠肝脏蛋白质的层次聚类分析(4712个可定量蛋白,聚类距离=欧氏距离);E.年轻与年老小鼠肝脏蛋白质的主成分分析A.identified spectra and peptides for proteins;B.length distribution of all the identified peptides in the proteome;C.scatter plot and density distribution based on log2(intensity)of quantified proteins,and Pearson correlation coefficients were calculated and displayed in the diagram;D.hierarchical clustering of proteins in livers of young and old mice(4712 quantifiable proteins were used,clustering distance=Euclidean distance);E.principle component analysis of proteins in livers of young and old mice图1 年轻与年老小鼠肝脏蛋白质组学整体概况Fig 1 Proteome profiling of livers in young and old mice
年轻与年老小鼠的差异表达蛋白质功能分析采用Perseus软件的Significance A(双边,Benjamini-Hochberg FDR<0.05)算法计算差异表达蛋白质,结果显示,衰老过程中小鼠肝脏有114个蛋白质表达量上调(上调>1.30倍),81个蛋白质下调(下调<0.80倍)。采用IPA数据库做亚细胞定位分析,发现与整体相比,上调及下调的差异蛋白均出现了细胞核定位比例减少、细胞外基质定位比例增加的现象(图2A)。功能富集分析显示,衰老肝脏中上调的蛋白质主要与脂肪酸代谢、环氧合酶P450途径、药物分解代谢、有机羟基化合物代谢、花生四烯酸代谢等生物学过程相关(图2B);衰老肝脏中下调的蛋白质主要与基因沉默、核小体组装、蛋白质异源四聚、干扰素反应等生物学过程相关(图2C)。
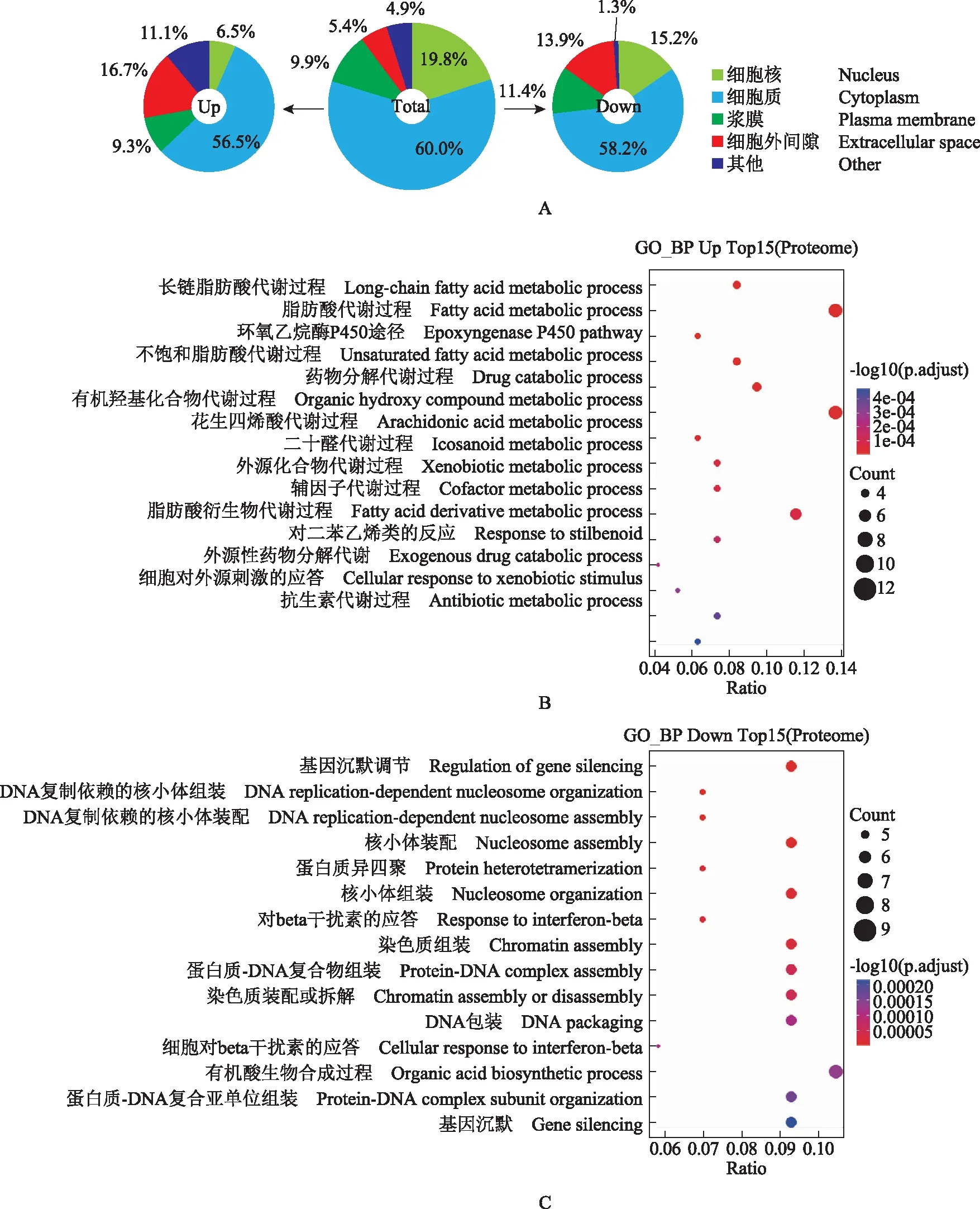
GO_BP:基因本体_生物过程GO_BP:gene ontology_biological processA.蛋白质定位情况,总计4712个可定量蛋白,114个上调蛋白,81个下调蛋白;B.衰老时上调的蛋白质中富集程度最高的15个GO过程;C.衰老时下调的蛋白质中富集程度最高的15个GO过程A.location of the total,upregulated,and downregulated proteins;total:4712 quantifiable proteins,up:114 upregulated proteins in aged livers,down:81 downregulated proteins in aged livers;B.top 15 enriched GO processes by upregulated proteins during aging;C.top 15 enriched GO processes by downregulated proteins during aging图2 衰老过程中小鼠肝脏的差异蛋白质功能分析Fig 2 Functions of differentially expressed proteins in livers of mice during normal aging
年轻与年老小鼠乙酰化修饰蛋白质组学的整体特征乙酰化修饰蛋白质组共生成146 519张二级谱图,其中,18 601张二级谱图成功匹配到13 808条肽段(对应1690个蛋白质),谱图鉴定率为12.7%。存在乙酰化修饰的肽段共有13 606条(6626条非重复肽段),对应1669个蛋白质和5640个乙酰化修饰位点(图3A)。经过数据过滤筛选,4818个乙酰化位点(对应1367个蛋白质)可被量化并进行后续差异分析。肽段长度分布集中在7~38个氨基酸之间(图3B),样品间Pearson相关性系数的最小值为0.98(图3C),提示乙酰化修饰蛋白质组学数据的质量合格。采用层次聚类分析与PCA评估各样品中可定量的乙酰化修饰位点的整体状况,结果显示,年轻与年老小鼠肝脏的乙酰化位点表达有整体区别,且年老小鼠的肝脏乙酰化修饰变异程度略大于年轻小鼠(图3D、E)。
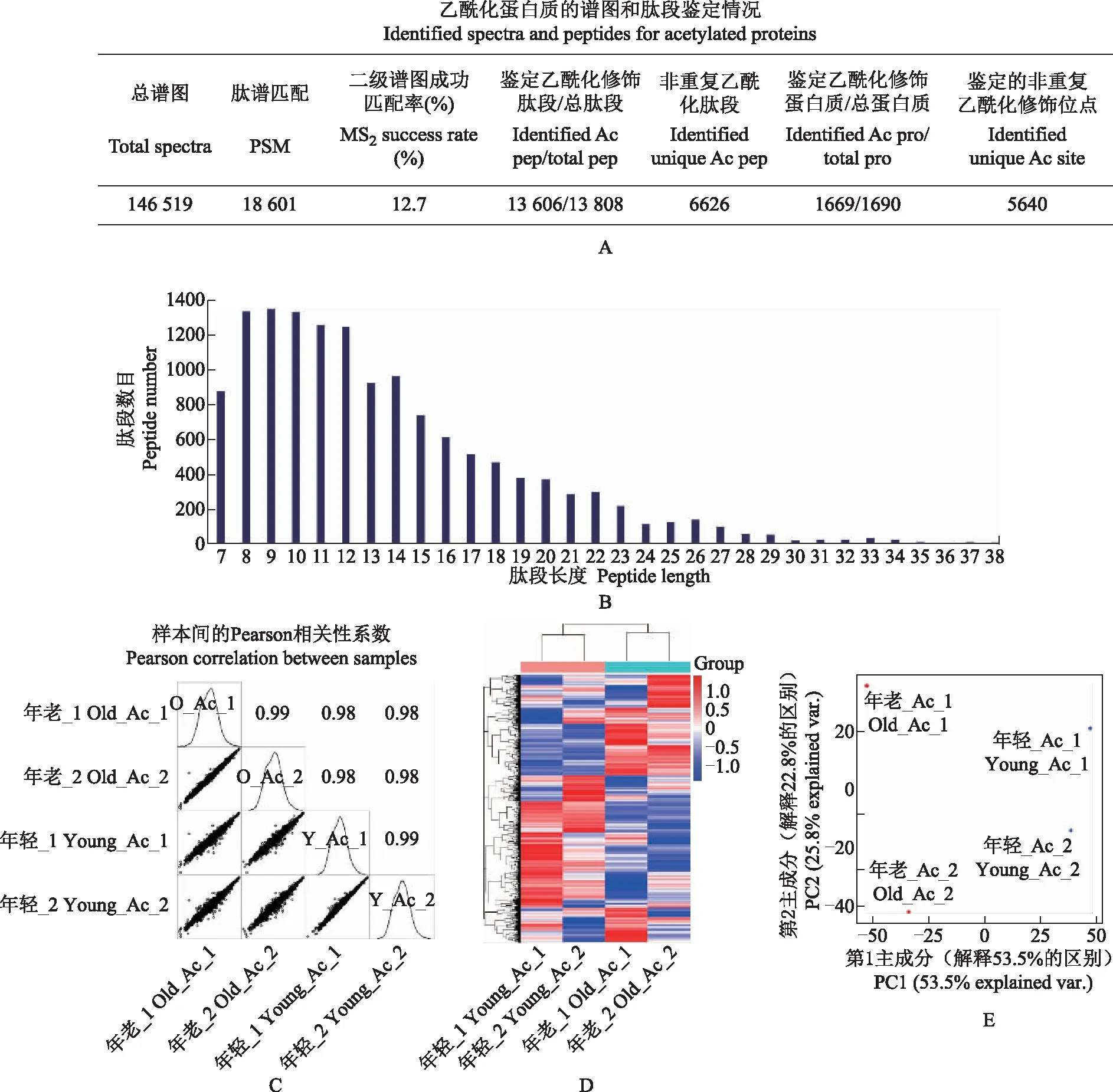
A.乙酰化修饰蛋白质组的谱图、肽段、蛋白质鉴定概况;B.乙酰化修饰蛋白质组全部肽段的长度分布柱状图;C.对乙酰化修饰位点的定量值做log2转换,绘制各样品定量值的散点图和密度分布图,在图上标注样本间的Pearson相关性系数计算结果;D.年轻与年老小鼠肝脏蛋白质乙酰化位点的层次聚类分析(4818可定量的乙酰化位点,聚类距离=欧氏距离);E.年轻与年老小鼠肝脏蛋白质乙酰化位点的主成分分析A.identified spectra and peptides for acetylated proteins;B.length distribution of all the identified acetylated peptides;C.scatter plot and density distribution based on log2(intensity)of quantified acetylated sites,Pearson correlation coefficients were calculated and displayed in the diagram;D.hierarchical clustering of acetylated sites in livers of young and old mice(4818 quantifiable acetylated sites were used;clustering distance=Euclidean distance);E.principle component analysis of acetylated sites in livers of young and old mice图3 年轻与年老小鼠肝脏乙酰化修饰蛋白质组学概况Fig 3 Acetylome profiling of livers in young and old mice
采用Motif-x算法分析肝脏乙酰化修饰位点的基序特征,发现在肝脏发生了乙酰化修饰的蛋白质中,酸性氨基酸,即天冬氨酸与谷氨酸出现在乙酰化修饰赖氨酸邻近位置的频率最高(图4)。
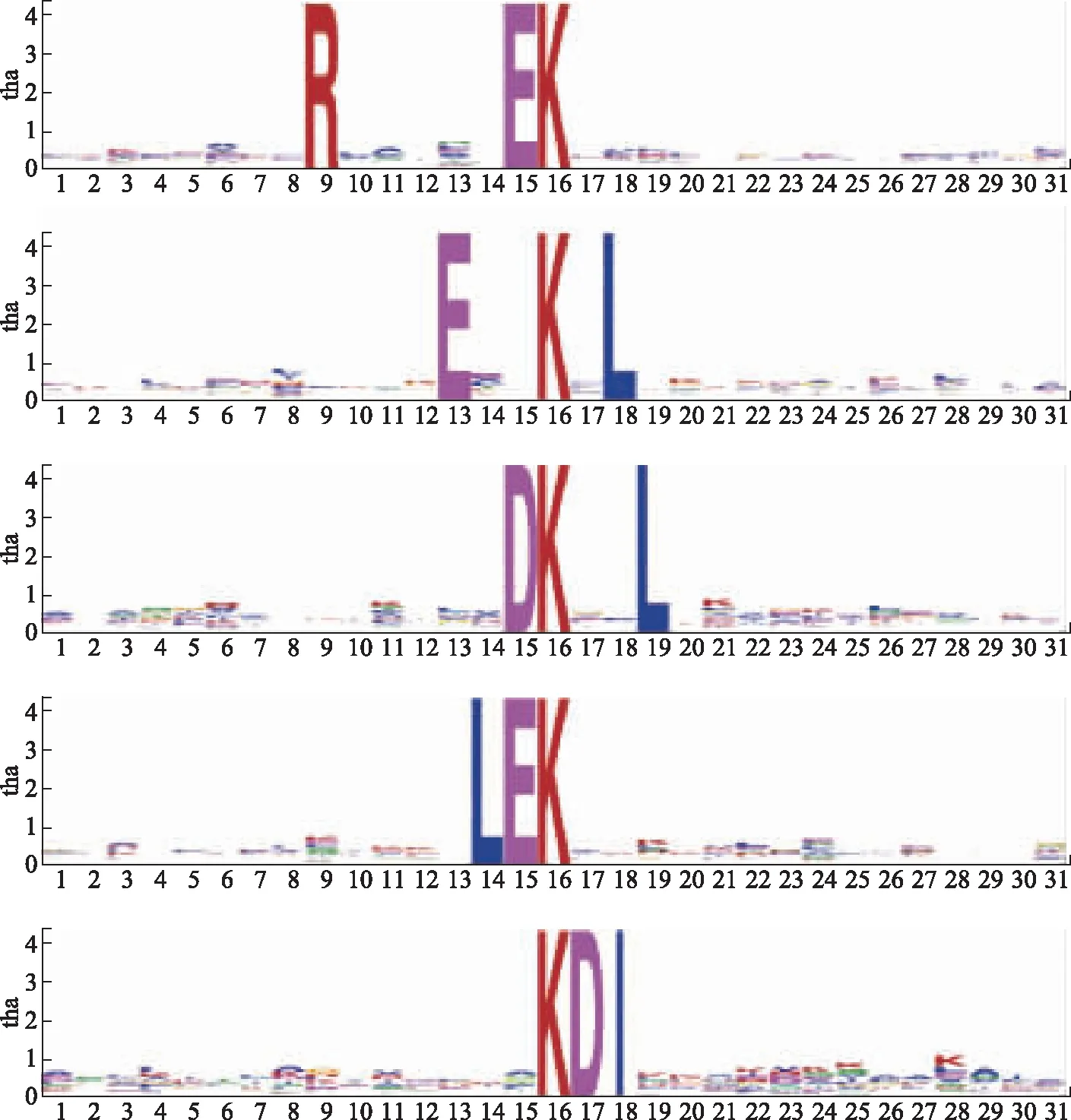
图4 小鼠肝脏乙酰化修饰位点的基序分析Fig 4 Motifs of acetylated sites in mouse liver
年轻与年老小鼠中差异乙酰化修饰蛋白的功能分析采用Significance A(双边,Benjamini-Hochberg FDR<0.05)算法计算差异表达的乙酰化位点,结果显示,衰老过程中小鼠肝脏有60个乙酰化位点(位于39个蛋白质中)上调(上调>1.69倍),53个乙酰化位点(位于38个蛋白质中)下调(下调<0.63倍)。IPA定位分析显示,与定量蛋白质组学相比,乙酰化修饰蛋白质定位于细胞质的比例明显增加(图5A)。与全部乙酰化修饰蛋白质相比,表达差异乙酰化位点的蛋白质定位于细胞核的比例有所下降,定位于细胞外基质的比例有所增加(图5A)。功能富集分析显示,具有上调乙酰化位点的39个蛋白质,与辅因子代谢、小分子分解代谢、磷酸核糖代谢、核糖核苷酸代谢、嘌呤代谢等生物学过程相关(图5B);含下调乙酰化位点的38个蛋白质,主要与含硫化合物代谢、未折叠蛋白反应、氨基酸代谢等生物学过程相关(图5C)。
蛋白质组学与乙酰化修饰蛋白质组学的功能范围比较蛋白质组学与乙酰化修饰蛋白质组学共同鉴定到1262个蛋白质,只被蛋白质组学鉴定到而不被乙酰化修饰的蛋白有3450个;只能在乙酰化富集后被鉴定到的蛋白质有105个(图6A)。功能富集分析显示,能被总蛋白质组鉴定而不发生乙酰化的蛋白质主要与高尔基体囊泡转运、mRNA加工、内膜系统组装、蛋白质在细胞器的定位和RNA剪接相关(图6B);能被总蛋白质组鉴定且发生乙酰化的蛋白质,主要与辅因子代谢、小分子分解代谢、氨基酸代谢、组织酸分解代谢和羧酸分解代谢过程相关(图6C);只能在乙酰化富集后被鉴定到的105种蛋白质,主要与蛋白质乙酰化及酰基化、蛋白质-DNA复合物组装、组蛋白修饰和共价染色质修饰相关(图6D)。
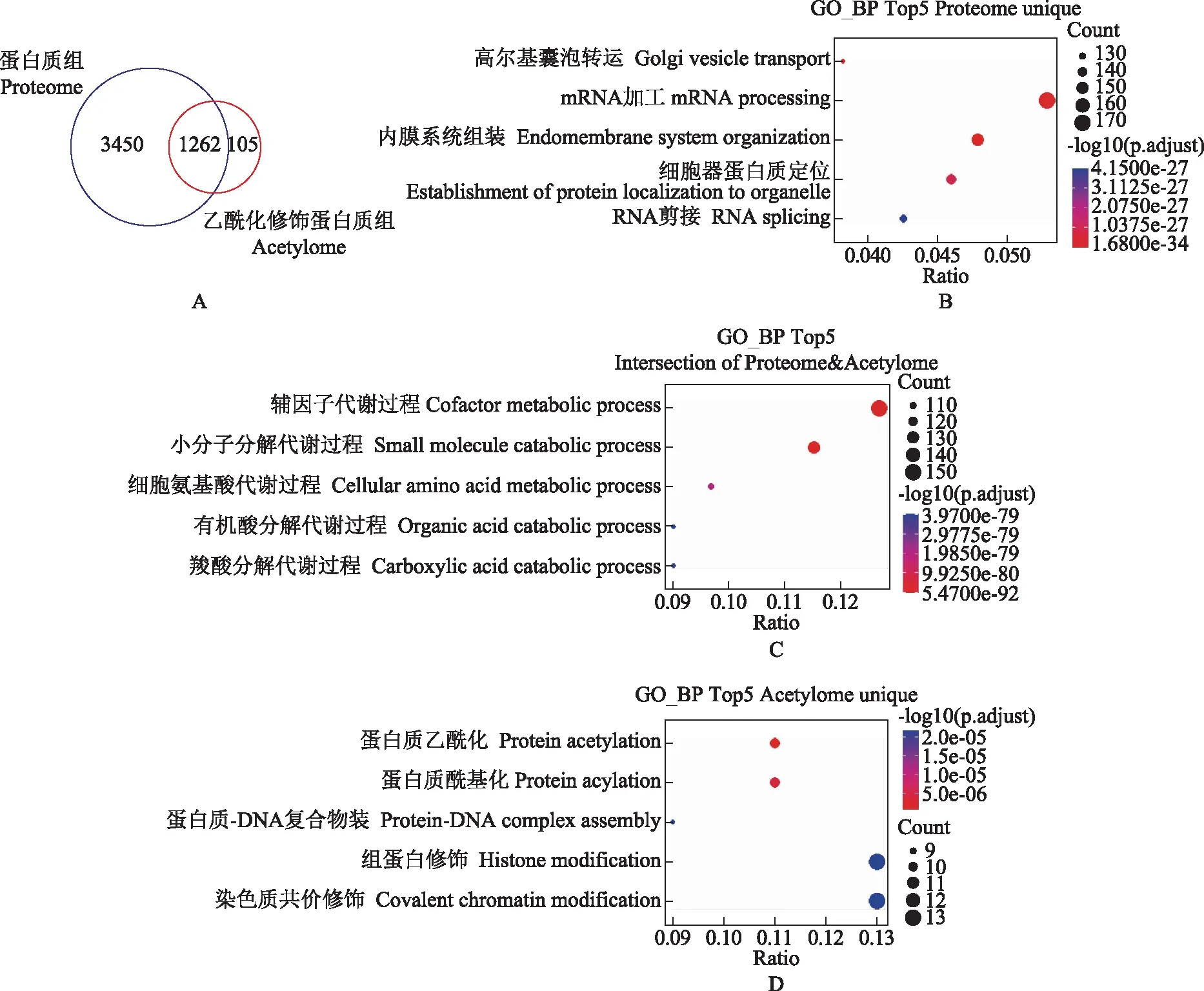
A.韦恩图展示蛋白质组鉴定到的全部可定量蛋白质与乙酰化修饰蛋白质组鉴定到的全部蛋白质的匹配情况;B.仅被蛋白质组鉴定到的3450个蛋白质中富集程度最高的5个GO过程;C.同时被蛋白质组和乙酰化修饰蛋白质组鉴定到的1262个蛋白质中富集程度最高的5个GO过程;D.仅被乙酰化修饰蛋白质组鉴定到的105个蛋白质中富集程度最高的5个GO过程A.Venn diagram of all quantifiable proteins in the proteome and all acetylated proteins in the acetylome;B.top 5 enriched GO processes by the 3450 proteins only identified in the proteome;C.top 5 enriched GO processes by the 1 262 proteins identified in both the proteome and acetylome;D.top 5 enriched GO processes by the 105 proteins only identified in the acetylome图6 蛋白质组学与乙酰化修饰蛋白质组学所鉴定蛋白的功能异同Fig 6 Comparison of biological functions between proteome and acetylome in livers
讨 论
本研究采用TMT标记定量与液质联用技术联合检测生理状态下年轻与年老雄性C57BL/6J小鼠肝脏的蛋白质组学与乙酰化修饰蛋白质组学,为衰老研究提供了可资参考的有效数据集。年轻与年老小鼠的蛋白质组与乙酰化修饰蛋白质组的整体表达模式有区别,但差异较小。本研究与既往自然衰老相关的小鼠多器官蛋白质组学[14]和肝脏转录组学[7]研究结果共同表明,衰老过程中生物大分子的整体表达虽然有所变化,但这种变化并不剧烈。
乙酰化是一种可以将生理过程与基因调控耦联起来的蛋白质翻译后修饰[15],对细胞内代谢改变敏感,代谢过程产生的乙酰辅酶A是乙酰化修饰的碳源[16]。乙酰化位点的表达水平一定程度上受该位点所在蛋白质表达水平的影响。但不同批次的质谱检测结果之间独立性较强,所以蛋白质组学与乙酰化修饰蛋白质组学的定量研究分开进行。在小鼠肝脏衰老过程中,蛋白质组鉴定到的上调蛋白质主要与脂肪酸代谢、环氧合酶P450途径、药物分解代谢、有机羟基化合物代谢、花生四烯酸代谢等代谢过程相关;衰老肝脏下调的蛋白质包含组蛋白,主要与基因沉默、核小体组装、蛋白质异源四聚、干扰素反应、蛋白质-DNA复合物组装等生物学过程相关。本研究发现,乙酰化偏向于修饰代谢过程相关的蛋白质且广泛存在于组蛋白中,可能调节代谢功能和染色质组装[1,4]。
在做液相色谱-质谱检测前,本研究对提取的蛋白质做了等量混合处理。样本混合可以有效减少因个体差异较大导致的数据离散,但也对应用经典的双样本t检验做差异筛选带来限制。Significance A算法可用于分析每组有2个生物学重复的比较组,因此被应用于本研究[17]。本研究选择TMT标记作为定量方法,与非标记定量相比,在蛋白质酶解后即引进TMT标记可减少后续检测步骤引起的系统误差,各样本定量更准确。但TMT标记同时会导致差异幅度被压缩和修饰解析复杂性增强的问题[18]。TMT定量方法不能测定特异性存在于年轻小鼠或特异性存在于年老小鼠的肽段、蛋白质或修饰位点,因为只有同时存在于每个样本的肽段才能被检测到。TMT的技术特点导致获取的差异蛋白质和乙酰化修饰位点数目较少,但也相应排除了大量干扰测定的因素,使鉴定结果更注重整体趋势变化。技术方法与统计分析方法进步将进一步提升衰老相关研究的数据容量与质量。整合不同年龄、性别、器官的多维度数据也将帮助人们规避测量偏差[19],全面认识衰老过程。
综上,本研究为衰老相关机制研究和干预方法探索提供了蛋白质组学与乙酰化修饰蛋白质组学的较为完善的数据集。

