载脂蛋白D对神经干细胞增殖的作用
赵琦琦 李奕昕 焦倩 姜宏
[摘要] 目的 探讨不同浓度载脂蛋白D(Apo D)对体外培养的小鼠大脑皮质神经干细胞(NSCs)细胞活力的影响。
方法 体外培养小鼠胚胎(14 d)大脑皮质NSCs;采用神经球直径大小测量和cell counting kit(CCK-8)细胞增殖试剂盒,检测不同浓度Apo D处理后NSCs细胞活力和增殖的改变。
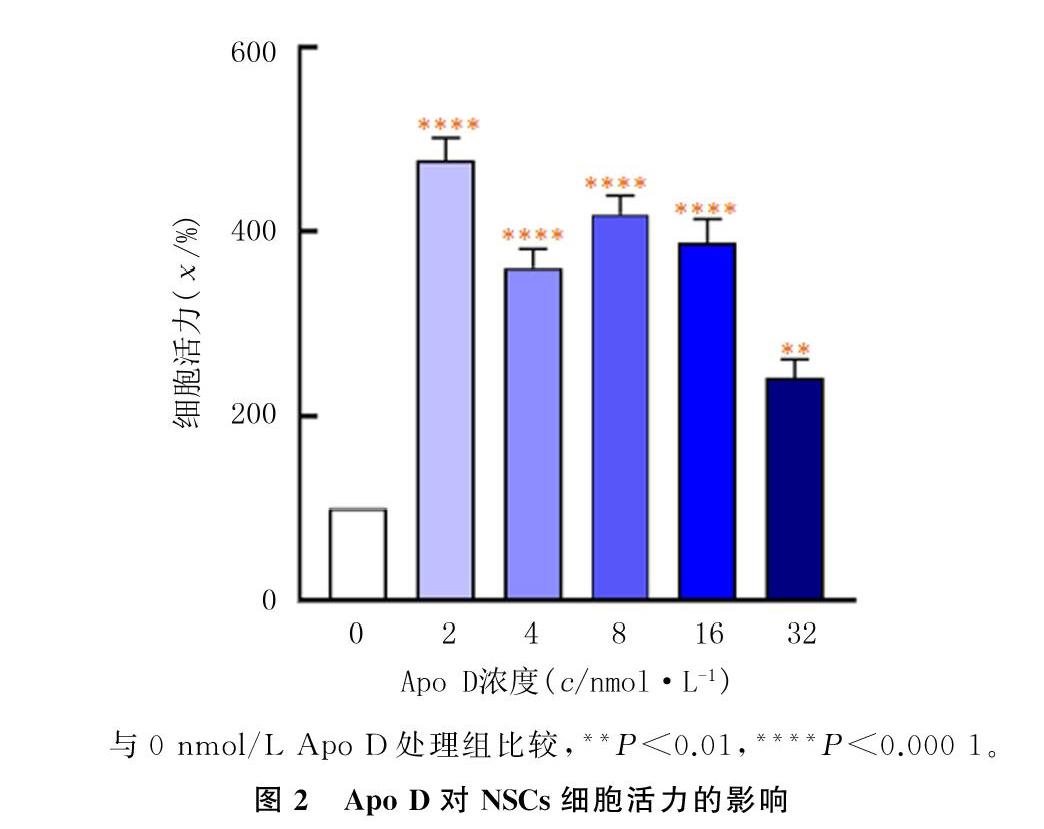
结果 分离培养的大脑皮质NSCs能增殖形成神经球,不同浓度(2、4、8、16、32 nmol/L)Apo D均可增加细胞活力(F=37.66,P<0.001),以2 nmol/L Apo D增加细胞活力的作用最明显。
结论 Apo D可增加NSCs细胞活力,促进NSCs增殖。
[关键词] 神经干细胞;载脂蛋白D类;细胞增殖
[中图分类号] R338.1
[文献标志码] A
[文章编号] 2096-5532(2021)05-0653-04
doi:10.11712/jms.2096-5532.2021.57.133
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20210628.1659.015.html;2021-06-29 13:23:42
EFFECT OF APOLIPOPROTEIN D ON THE PROLIFERATION OF NEURAL STEM CELLS
ZHAO Qiqi, LI Yixin, JIAO Qian, JIANG Hong
(State Key Disciplines: Physiology (in Incubation), Department of Physiology, Qingdao University, Qingdao 266071, China)
[ABSTRACT] Objective To investigate the effect of different concentrations of apolipoprotein D (Apo D) on the viability of mouse cortical neural stem cells (NSCs) cultured in vitro.
Methods Cortex NSCs were isolated from the cerebral cortex of mouse embryos on embryonic day 14 and were cultured in vitro, and measurement of neurosphere diameter and CCK-8 assay were performed to investigate the changes in the viability and proliferation of NSCs after treatment with different concentrations of Apo D.
Results The cortical NSCs isolated and cultured in vitro could proliferate to form neurospheres, and different concentrations (2,4,8,16, and 32 nmol/L) of Apo D increased cell viability (F=37.66,P<0.001), among which 2 nmol/L Apo D had the most significant effect on increasing cell viability.
Conclusion Apo D can increase the viability of NSCs and promote the proliferation of NSCs.
[KEY WORDS] neural stem cells; apolipoprotein D; cell proliferation
神經干细胞(NSCs)是具有自我更新能力和多向分化潜能的细胞,可分化为神经元、星形胶质细胞和少突胶质细胞[1-4]。由于NSCs在特定条件和因子诱导下可以定向分化成不同类型神经细胞,NSCs移植可以弥补丢失的神经元,成为神经系统疾病细胞替代治疗的可行性方案之一,为神经系统退行性疾病和神经损伤等提供了新的治疗策略[2,4-5]。因此,对NSCs增殖、分化调控的研究是揭示临床上常见中枢神经系统发育缺陷疾病致病机制的关键,同时也为一些神经障碍疾病的治疗提供新思路。
载脂蛋白D(Apo D)1963年首次发现于血浆高密度脂蛋白(HDL)中,是具有脂质转运功能的分泌型糖蛋白[6]。Apo D是一种分子量为29 000的糖蛋白,作为载脂蛋白家族成员之一,其在体内分布广泛,在肾脏、脾脏、睾丸和大脑中均具有高水平的表达[6-7]。在人类和其他哺乳动物中枢神经系统中,Apo D主要表达于胶质细胞及其前体[8-9],也可由神经元表达[10]。Apo基因是在衰老的大脑、神经退行性疾病和精神疾病中始终过量表达的少数基因之一[10-12]。大量研究结果表明,在衰老和多种神经系统功能失调疾病中Apo D的含量明显增高[10-11,13],Apo D的增加主要见于星形胶质细胞、神经元和损伤区的少突胶质细胞。相关研究已表明,在衰老或病理条件下的果蝇模型中,Apo D可降低体内因活性氧积累而升高的脂质过氧化物水平[14]。本实验室前期研究显示,Apo D对多巴胺能神经元具有神经保护作用,其保护作用可能与抗氧化应激有关。但Apo D对NSCs增殖的作用未见报道。故本研究通过体外培养大脑皮质NSCs、外源性给予Apo D的方法,观察不同浓度的Apo D对大脑皮质NSCs细胞活力的影响。
1 材料与方法
1.1 实验材料
C57BL/6小鼠(购自北京维通利华实验动物技术有限公司),Apo D(Biovendor公司),DMEM/F12培养液(Hyclone公司),表皮生长因子(EGF)、碱性成纤维细胞生长因子(bFGF)、N-2 supplement、B-27 supplement和胎牛血清(Gibco公司),cell counting kit(CCK-8)试剂盒(上海翊圣生物科技有限公司)。
1.2 实验方法
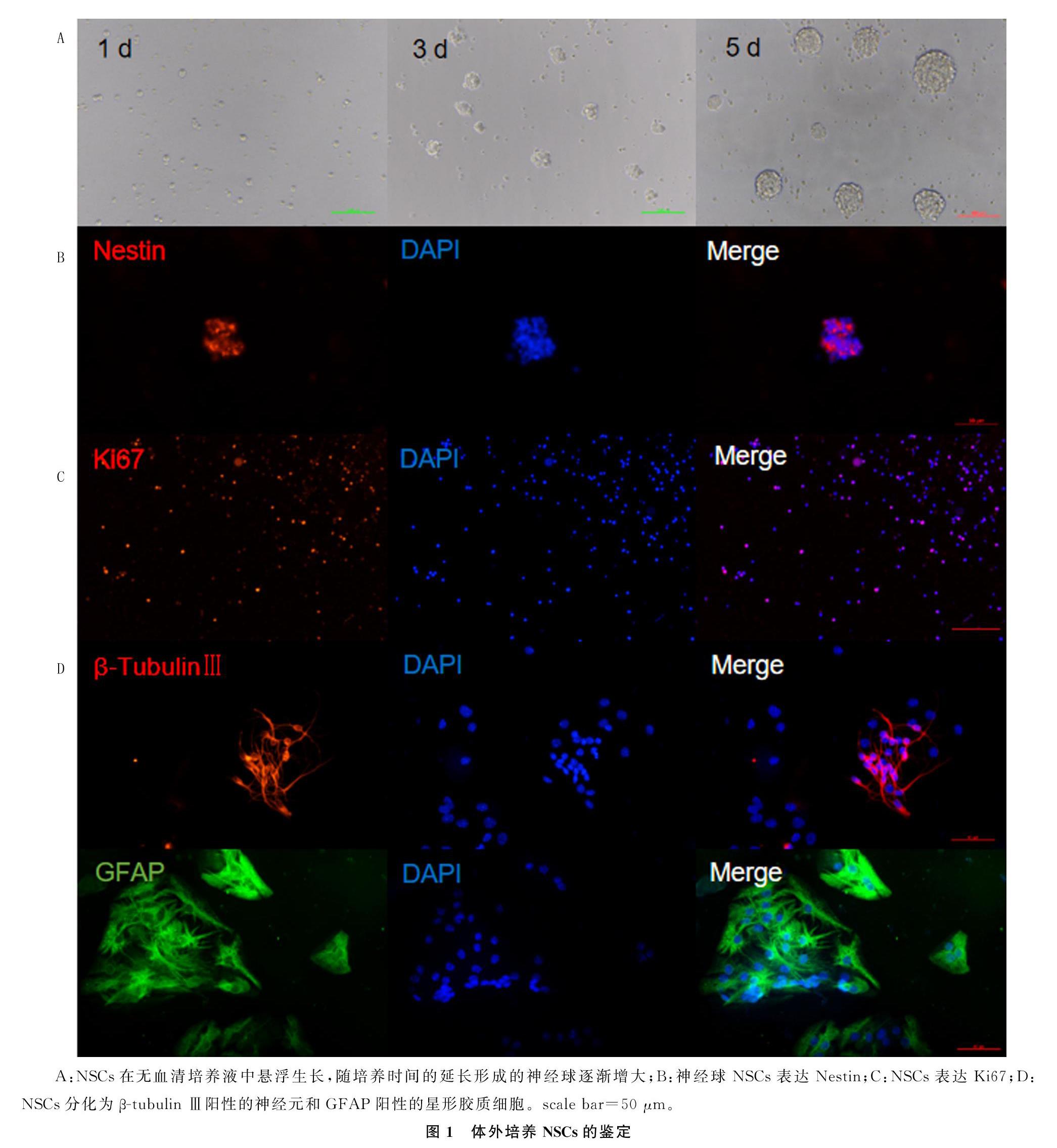
1.2.1 大脑皮质NSCs的分离培养 取孕14 d的C57BL/6小鼠胚胎大脑皮质部位组织,机械剪碎和吹打后过滤离心,细胞计数后种植在75 cm2的培养瓶中,置于温度37 ℃、含有体积分数0.05 CO2的孵箱中,使用含有DMEM/F12(1∶1)、体积分数0.02 N-2 supplement、体积分数0.01 B-27 supplement、10 μg/L bFGF、20 μg/L EGF、10 g/L青霉素-链霉素混合液的完全培养液进行培养。NSCs培养4~5 d时进行传代,传代至第3代时,以1×106/L密度种植于多聚赖氨酸包被的玻片上,使用含体积分数0.01胎牛血清的分化培养液诱导分化,7 d后经预冷的40 g/L多聚甲醛固定30 min,免疫荧光染色后观察NSCs分化情况。
1.2.2 NSCs的鉴定 NSCs贴壁培养7 d后,用多聚甲醛固定细胞,加入含体积分数0.01山羊血清的封闭液,室温封闭1 h;加入Nestin、Ki67、β-tubulin Ⅲ和GFAP抗体,4 ℃孵育过夜;用0.01 mol/L PBS洗3次,每次5 min;加入荧光二抗室温孵育1 h,DAPI室温染色5 min;用0.01 mol/L PBS洗3次,每次5 min;封片,荧光显微镜下观察并拍摄荧光图像。
1.2.3 细胞活力检测 将第3代的皮质NSCs传代种植于96孔板,每孔100 μL,种植密度为1×105/L,以不同浓度(0、2、4、8、16和32 nmol/L)Apo D培养5 d,检测第5天时的NSCs细胞活力。在测定前2~4 h,每孔加入10 μL的CCK-8溶液,于酶標仪(PerkinElmer,Victor nivo)上检测,以450 nm波长处的吸光度(A)值反映细胞活力。
1.2.4 神经球直径测量 将传至第3代大脑皮质NSCs以1×108/L密度种植于96孔板内,培养1~5 d,于光镜下观察并拍摄图像。利用NIS-Elements软件测量培养1~5 d形成的神经球直径。
1.3 统计学方法
应用GraphPad Prism 8软件进行统计学分析。结果以±s表示,多组比较采用单因素方差分析,继以Tukey法进行组间两两比较;两组比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 NSCs的培养与鉴定
大脑皮质NSCs培养3 d时可增殖成直径40~70 μm的神经球;培养5 d时可增殖为直径100~150 μm的神经球(图1A)。神经球免疫双标染色结果显示,Nestin和Ki67阳性(图1B、C)。大脑皮质NSCs诱导分化7 d后,出现β-tubulin Ⅲ阳性的神经元和GFAP阳性的星形胶质细胞(图1D)。
2.2 Apo D对NSCs细胞活力的影响
NSCs经2、4、8、16和32 nmol/L的Apo D培养5 d,检测细胞活力的A值分别为0.195±0.005、0.181±0.004、0.188±0.004、0.185±0.005和0.167±0.005。与对照组(0.150±0.003)相比较,2、4、8、16和32 nmol/L Apo D处理组NSCs细胞活力均显著增高,差异具有统计学意义(n=5,F=37.66,P<0.001),其中2 nmol/L Apo D处理组NSCs细胞活力增高最明显,表明低浓度Apo D对NSCs细胞活力的影响较高浓度Apo D显著。见图2。
2.3 Apo D对神经球直径的影响
NSCs经2 nmol/L Apo D培养5 d,神经球直径为(55.142±0.393)μm,与对照组的(49.912±3.256)μm相比,2 nmol/L Apo D处理组NSCs形成的神经球直径增大,差异有统计学意义(n=6,t=2.841,P<0.05)。
3 讨 论
NSCs具有自我更新和多向分化潜能。当神经退行性病变或中枢神经系统受到损伤时,NSCs会向损伤部位迁移并替代受损细胞[15],从而在很大程度上恢复功能,这为中枢神经系统疾病的治疗带来了希望的曙光。但是,由于成人内源性NSCs很少,这种内源性激活显然不足以达到治疗目的。因此,NSCs的增殖研究成为细胞治疗的一个关键问题。
体外培养的小鼠胚胎大脑皮质NSCs可增殖形成神经球,且随着培养时间的延长,细胞数量增多、体积增大。本研究免疫荧光染色结果显示,NSCs培养至第5天时,神经球内细胞呈Nestin阳性,说明分裂增殖的NSCs仍具有祖细胞的特性。此外,NSCs还有分化为神经元、星形胶质细胞和少突胶质细胞的能力。本研究免疫荧光染色结果显示,体外培养的小鼠胚胎大脑皮质NSCs经诱导分化7 d后,出现β-tubulinⅢ阳性和GFAP阳性细胞,提示NSCs分化为神经元和星形胶质细胞,证实了大脑皮质NSCs的多向分化潜能。
NSCs的增殖受多种因素的影响,除受内在基因的调控外,还受周围包括细胞因子等微环境的影响[2,16-17]。Apo D是血浆HDL的一种成分,在人类胎盘、卵巢、睾丸、脑、胰腺和肾上腺中表达水平较高[18],在老年人的神经胶质细胞和老年病病人的神经元中丰富表达[9,19]。既往研究表明,Apo D参与免疫反应、细胞凋亡、胚胎的发育和分化、神经系统的发生和损伤修复以及肿瘤发生等生命活动和过程[12]。Apo D缺陷小鼠对氧化应激的敏感性及脑脂质过氧化的水平明显增高,而Apo D过表达小鼠存活率增高并能抑制氧化剂作用后脑脂质过氧化物
的增加[20],表明Apo D在應激应答中起保护作用,这可能与抗氧化有关。此外,在神经退行性疾病(例如阿尔茨海默病)病人的周围神经再生部位和脑脊液中Apo D也高浓度表达,提示Apo D可能参与中枢神经系统和周围神经系统的保护和修复[6]。本研究结果证实,不同浓度Apo D均可显著提高体外培养的大脑皮质NSCs细胞活力。Apo D对大脑皮质NSCs细胞活力的影响并不具有浓度依赖的特点,这可能是由于不同浓度的Apo D对神经系统或细胞产生不同生理效应导致的。Apo D对神经系统的具体作用还需要进一步的研究。
综上所述,Apo D可以提高NSCs的细胞活力,增强细胞的存活和增殖能力,进而影响神经再生。
[参考文献]
[1]GAGE F H. Mammalian neural stem cells[J]. Science, 2000,287(5457):1433-1438.
[2]TAUPIN P. Adult neural stem cells, neurogenic niches, and cellular therapy[J]. Stem Cell Reviews, 2006,2(3):213-219.
[3]TEMPLE S. The development of neural stem cells[J]. Nature, 2001,414(6859):112-117.
[4]MARSH S E, BLURTON-JONES M. Neural stem cell therapy for neurodegenerative disorders: the role of neurotrophic support[J]. Neurochemistry International, 2017,106:94-100.
[5]OTTOBONI L, MERLINI A, MARTINO G. Neural stem cell plasticity: advantages in therapy for the injured central nervous system[J]. Frontiers in Cell and Developmental Biology, 2017,5:52.
[6]RASSART E, DESMARAIS F, NAJYB O, et al. Apolipoprotein D[J]. Gene, 2020,756:144874.
[7]EMAMZADEH F N. Role of apolipoproteins and α-synuclein in Parkinsons disease[J]. Journal of Molecular Neuroscience: MN, 2017,62(3/4):344-355.
[8]NAVARRO A, TOLIVIA J, ASTUDILLO A, et al. Pattern of apolipoprotein D immunoreactivity in human brain[J]. Neuroscience Letters, 1998,254(1):17-20.
[9]DEL VALLE E, NAVARRO A, ASTUDILLO A, et al. Apolipoprotein D expression in human brain reactive astrocytes[J]. The Journal of Histochemistry and Cytochemistry, 2003,51(10):1285-1290.
[10]NAVARRO A, VALLE E, JUREZ A, et al. Apolipoprotein D synthesis progressively increases in frontal cortex during human lifespan[J]. AGE, 2010,32(1):85-96.
[11]MUFFAT J, WALKER D W. Apolipoprotein D: an overview of its role in aging and age-related diseases[J]. Cell Cycle (Georgetown, Tex), 2010,9(2):269-273.
[12]DASSATI S, WALDNER A, SCHWEIGREITER R. Apolipoprotein D takes center stage in the stress response of the aging and degenerative brain[J]. Neurobiology of Aging, 2014,35(7):1632-1642.
[13]GANFORNINA M D, PASCUA-MAESTRO R, CORRALIZA-GOMEZ M, et al. Preservation of lysosomal membrane integrity by apolipoprotein D promotes cell survival in Niemann-Pick type A disease[J]. Glia, 2019,67:E236.
[14]BHATIA S, KNOCH B, WONG J, et al. Selective reduction of hydroperoxyeicosatetraenoic acids to their hydroxy derivatives by apolipoprotein D: implications for lipid antioxidant activity and Alzheimers disease[J]. The Biochemical Journal, 2012,442(3):713-721.
[15]PICCIN D, YU F G, MORSHEAD C M. Notch signaling imparts and preserves neural stem characteristics in the adult brain[J]. Stem Cells and Development, 2013,22(10):1541-1550.
[16]ZHAO C M, DENG W, GAGE F H. Mechanisms and functional implications of adult neurogenesis[J]. Cell, 2008,132(4):645-660.
[17]TUN B S, TOPRAK F, TOPRAK S F, et al. In vitro investigation of growth factors including MGF and IGF-1 in neural stem cell activation, proliferation, and migration[J]. Brain Research, 2021,1759:147366.
[18]DRAYNA D, FIELDING C, MCLEAN J, et al. Cloning and expression of human apolipoprotein D cDNA[J]. The Journal of Biological Chemistry, 1986,261(35):16535-16539.
[19]KALMAN J, MCCONATHY W, ARAOZ C, et al. Apolipoprotein D in the aging brain and in Alzheimers dementia[J]. Neurological Research, 2000,22(4):330-336.
[20]PASCUA-MAESTRO R, GONZLEZ E, LILLO C, et al. Extracellular vesicles secreted by astroglial cells transport apolipoprotein D to neurons and mediate neuronal survival upon oxidative stress[J]. Frontiers in Cellular Neuroscience, 2018,12:526.
(本文编辑 馬伟平)

