美洛昔康纳米骨架胶囊的溶出与体内药物代谢动力学研究
张 丹,王小旭,谢贺贺,吴翠栓
(北京德立福瑞医药科技有限公司,北京 102101)
美洛昔康是一种新型非甾体抗炎药(NSAIDs),用于治疗骨关节炎和类风湿关节炎[1-2],与其他NSAIDs相比,引起的胃肠道不良反应更轻[3-4]。但由于美洛昔康的水溶性较差,导致口服生物利用度较低。
口服纳米骨架技术[5-7]是采用具有纳米孔径的介孔二氧化硅和pH敏感高分子材料为载体,制备难溶性药物纳米骨架分散系统。本研究采用纳米骨架技术制备美洛昔康纳米骨架胶囊,并与市售美洛昔康片(莫比可®)进行对比,对自制的美洛昔康纳米骨架胶囊进行体外溶出特征和比格犬体内口服药物代谢动力学研究。
1 仪器与材料
1.1仪器 LC-20AT型高效液相色谱仪(日本岛津公司);RC806D型溶出仪(天大天发科技有限公司);T6新世纪型紫外可见分光光度计(普析通用仪器有限责任公司);AL204型电子天平(瑞士梅特勒-托利多仪器有限公司);BT 25S型电子天平(德国赛多利斯公司);HC-2064型离心机(科大创新股份有限公司中佳分公司);MTN-2800W型氮吹浓缩装置(天津奥特赛思仪器有限公司)。
1.2试药 美洛昔康对照品(批号100679-201102)和吡罗昔康对照品(批号100177-200603),均购自中国食品药品检定研究院;甲醇(色谱纯,Sigma公司,批号WXBB6447V);美洛昔康片(商品名莫比可®,勃林格殷格翰公司,批号384242);美洛昔康纳米骨架胶囊(北京德立福瑞医药科技有限公司,批号MJ201502282);水为自制超纯水,其余试剂均为分析纯。
1.3动物 健康比格犬,10月龄左右,雄性,体质量为8~10 kg,购自北京玛斯生物技术有限公司,实验动物许可证号为SCXK(京)-2011-0003。
2 方法与结果
2.1溶出曲线对比研究
2.1.1溶出曲线测定 取美洛昔康纳米骨架胶囊,参照《中国药典》2015年版通则0931第二法溶出度与释放度测定法,溶出介质体积为900 mL,转速为75 r·min-1,依法操作。经5、10、30、45、60 min时,取溶液10 mL,过0.45 μm 滤膜,取续滤液作为供试品溶液;另取美洛昔康对照品约20 mg,精密称定,置于100 mL量瓶中,加 0.1 mol·L-1氢氧化钠溶液10 mL,超声使溶解,再用溶出介质稀释至刻度,摇匀,精密量取2 mL,置于50 mL量瓶中,用溶出介质稀释至刻度,摇匀,作为对照品溶液;取上述供试品溶液和对照品溶液,参照《中国药典》2015年版通则0401紫外-可见分光光度法,在362 nm波长处分别测定吸光度值A,按外标法计算每片溶出量。
2.1.2溶出曲线测定方法学验证 专属性:称取辅料适量,分别加入不同pH值的溶出介质,过滤,在362 nm波长处测定吸光度值A。结果显示,空白辅料溶液在该波长处均无吸收,未对主成分造成干扰,表明该方法专属性良好。
线性范围:精密称取美洛昔康对照品适量,加入0.1 mol·L-1氢氧化钠溶液使溶解,再加介质稀释成质量浓度分别为0.25、0.50、1.00、2.00、4.00、8.00 mg·L-1的系列溶液,以该溶出介质为空白,分别在波长362 nm处测定其吸光度值A,以吸光度(A)对美洛昔康质量浓度(C)进行线性回归,得回归方程:A1=0.050 4C1+0.002 2,R12=0.999 8(pH=1.0);A2=0.052 5C2+0.003 6,R22=0.999 3(pH=4.5);A3=0.050 9C3+0.003,R32=0.999 8(水);A4=0.053 6C4+0.000 6,R42=0.999 6(pH=7.4)。结果表明,美洛昔康质量浓度(C)在0.25~8.00 mg·L-1范围内与吸光度(A)线性关系良好。
2.1.3溶出曲线对比 按照上述溶出曲线测定方法,分别测定2种制剂在不同pH介质中的溶出曲线。结果表明,对照品制剂莫比可®在pH值为1.0的盐酸介质中,60 min时溶出度低于20%,在pH值为4.5的醋酸盐介质中,60 min溶出度低于40%,在水和pH值为7.4的磷酸盐介质中,30 min溶出度约为80%,呈现明显的pH值依赖性;而美洛昔康纳米骨架胶囊在4种介质中溶出均快于莫比可®,且在酸性介质中溶出度明显提高。溶出曲线见图1。
2.2比格犬体内的药动学对比研究
2.2.1给药方案与血浆样品采集 本研究为单剂量给药实验,采用两周期双交叉实验设计,周期间隔为7 d。将12只比格犬随机分为2组,禁食12 h后分别口服美洛昔康纳米骨架胶囊与莫比可®。分别于给药前(0 h)和给药后 0.5、1.0、2.0、3.0、4.0、5.0、12.0、36.0、72.0 h由前腿小隐静脉采血2 mL。血样取出后立即置于肝素化的EP管中,以4 000 r·min-1离心10 min,分离血浆,于-20 ℃冰箱冷冻保存, 待测。
2.2.2血浆样品处理方法 精密吸取血浆0.5 mL,置于5 mL具塞离心管中,精密加入内标溶液50 μL,1.0 mol·L-1的盐酸溶液100 μL,乙醚4.0 mL(分2次,每次2 mL),涡旋混匀2 min,以4 000 r·min-1离心10 min,合并2次有机相,于50 ℃水浴中氮气吹干。残留物以200 μL流动相涡旋1 min溶解,高速离心后,取上清液供HPLC分析。
2.2.3色谱条件 色谱柱:MERCK Hibar®RP-18e(150 mm×4.6 mm 5.0 μm);流动相:甲醇-0.2 mol·L-1醋酸铵=52∶48;流速:1.0 mL·min-1;柱温:40 ℃;检测波长:355 nm;进样体积:20 μL。
2.2.4方法学验证 专属性:按照2.2.3项下色谱条件测得空白血浆、空白血浆加美洛昔康对照品和内标(吡罗昔康)及比格犬服药后血浆样品的典型色谱图,美洛昔康的保留时间约为14.249 min,内标吡罗昔康的保留时间约为7.743 min;空白血浆的内源性物质未干扰色谱分析。
线性范围:精密称取美洛昔康对照品10.0 mg,置于200 mL量瓶中,加入0.1 mol·L-1的氢氧化钠溶液10 mL使其溶解,用水稀释至刻度,得到50 μg·mL-1的美洛昔康溶液,作为储备液;在空白血浆中加入不同质量浓度的美洛昔康对照品溶液,使其血浆药物质量浓度分别为0.025、0.050、0.100、0.500、1.000、5.000 μg·mL-1,按照2.2项下血浆处理方法处理,进行HPLC分析。以峰面积比(R)对质量浓度(C,μg·mL-1)进行线性回归,得回归方程:C=R×2.121 1-0.015 6,r=0.999 9。结果表明,美洛昔康血浆质量浓度在0.025~5.000 μg·mL-1范围内,线性关系良好。
定量下限:分别精密吸取美洛昔康对照品溶液适量,置于5 mL具塞离心管中,氮气吹干,加入空白血浆0.5 mL,配制成美洛昔康质量浓度为0.025 μg·mL-1的血浆样本5份,按照2.2项下方法处理,代入标准曲线计算,结果5份样品平均准确度为105.26%,RSD值为9.98%。表明质量浓度在最低定量限附近的血浆样本测定准确度、精密度良好。
精密度与准确度:另精密称取美洛昔康对照品10.0 mg,置于200 mL量瓶中,加0.1 μg·mL-1的氢氧化钠溶液10 mL使其溶解,用水稀释至刻度,得到质量浓度为50 μg·mL-1的美洛昔康溶液,作为储备液;在空白血浆中加入不同质量浓度的美洛昔康对照品溶液,制成血浆药物质量浓度分别为0.025、0.050、0.500、5.000 μg·mL-1的血浆样品。按照2.2项下方法处理,进行HPLC分析。在1个分析批内测定多次,计算批内精密度;在不同时间连续制备并测定3个分析批,计算批间精密度。见表1。
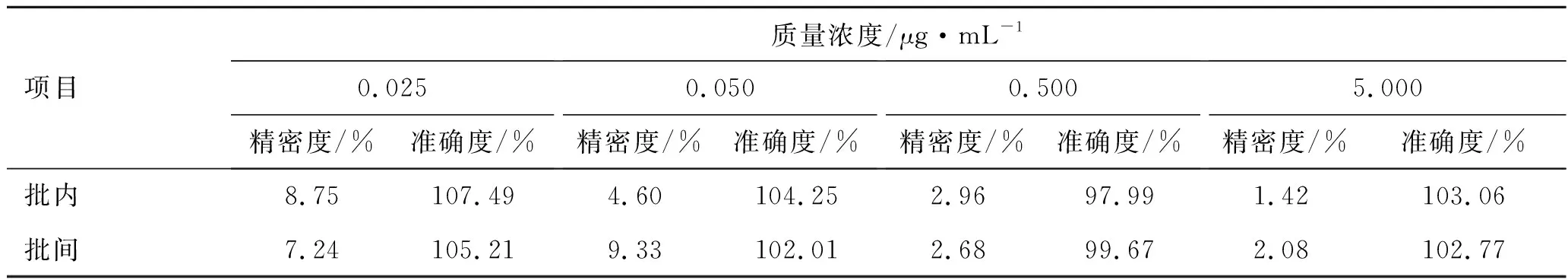
表1 美洛昔康血浆样品精密度测定
提取回收率:美洛昔康回收率实验:取美洛昔康对照品溶液,加入空白血浆中,配制成质量浓度为0.025、0.050、0.500、4.000 μg·mL-1的血浆样品,各5份,置于5 mL具塞离心管中,加入1.0 mol·L-1的盐酸溶液100 μL及乙醚4.0 mL(分2次,每次2 mL),涡旋混匀2 min,以4 000 r·min-1离心10 min,合并2次有机相,于上清液中精密加入内标(吡罗昔康)溶液50 μL,涡旋混匀后于50 ℃水浴中氮气吹干。残留物以200 μL流动相涡旋1 min溶解,高速离心后,取上清液供HPLC分析。计算美洛昔康与内标的色谱峰面积比(As-r)。另取空白血浆6份,加入1.0 mol·L-1的盐酸溶液100 μL,乙醚4.0 mL(分2次,每次2 mL),涡旋混匀2 min,以4 000 r·min-1离心10 min,合并2次有机相,加入与前一步骤等量的美洛昔康对照品溶液适量,配成系列质量浓度水平对照品溶液,各2份,再分别精密加入内标溶液50 μL,涡旋混匀后于50 ℃水浴中氮气吹干。残留物以200 μL流动相涡旋1 min溶解,高速离心后,取上清液供HPLC分析,计算美洛昔康与内标的色谱峰面积比(Ar-r)。按照公式回收率=(As-r)÷(Ar-r)×100%计算美洛昔康血浆样品的回收率,结果表明,4种质量浓度的平均回收率均大于80%,且稳定。见表2。
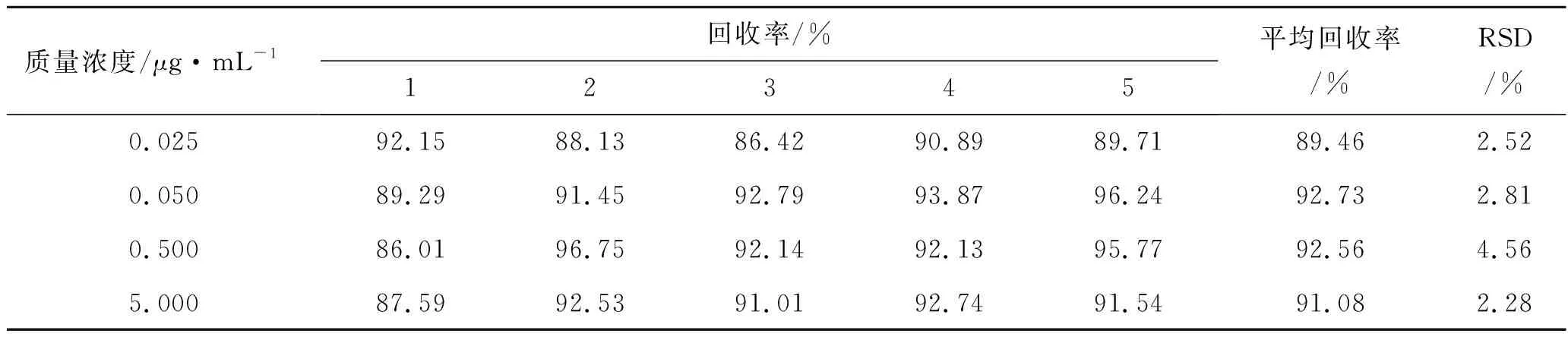
表2 美洛昔康血浆样品回收率 (n=5)
内标吡罗昔康回收率实验:取空白血浆0.5 mL,共5份,置于5 mL具塞离心管中,按照2.2.2项下血浆样品处理方法自“精密加入内标(吡罗昔康)溶液50 μL”起同法操作,并进行色谱分析,记录内标色谱峰面积(As-is)。另取空白血浆2份,加入1.0 mol·L-1的盐酸溶液100 μL,乙醚4.0 mL(分2次,每次2 mL),涡旋混匀2 min,以4 000r·min-1离心10 min,合并2次有机相,于上清液中精密加入内标(吡罗昔康)溶液50 μL,涡旋混匀后于50 ℃水浴中氮气吹干。残留物以200 μL流动相涡旋1 min使溶解,高速离心后,取上清液供HPLC分析。记录内标的色谱峰面积(Ar-is)。按照公式回收率=(As-is)÷(Ar-is)×100%计算内标血浆样品的回收率。结果表明,在内标质量浓度为5.0 μg·mL-1时,5份样品中内标的回收率分别为90.24%、87.16%、91.38%、92.44%、89.09%,平均回收率为90.06%,RSD值为2.27%,内标在该质量浓度水平的平均回收率大于80%且稳定。
稳定性:按照标准曲线测定方法配制0.05、0.50、5.00 μg·mL-13种不同质量浓度的血浆样品,分别考察未处理血浆样品室温放置8 h、冻融循环3次、-20 ℃冰冻15 d、处理后血浆样品自动进样器放置48 h的稳定性。经测定,3种质量浓度样品在不同条件放置后,所测得的质量浓度与标示质量浓度偏差均在±15%范围内,结果表明,稳定性符合要求。综上,高效液相色谱-紫外(HPLC-UV)方法的验证结果表明,该方法的专属性、线性范围、精密度、准确度、定量限、提取回收率和稳定性等均符合要求,可用于美洛昔康血药质量浓度的测定。
2.2.5比格犬体内药动学参数比较 比格犬体内药动学参数经对数转化后进行方差分析,采用双向单侧t检验及[1-2α]%置信区间法进行生物等效性评价。结果与莫比可®相比,美洛昔康纳米骨架胶囊经对数转换后的药物达峰浓度(Cmax)的90%置信区间为135.3%~154.8%,药时曲线下面积(AUC0~t)的90%置信区间为104.5%~179.0%,相对生物利用度(F0~72)=136.8%。2种制剂在比格犬体内药动学参数见表3,平均药-时曲线见图2。
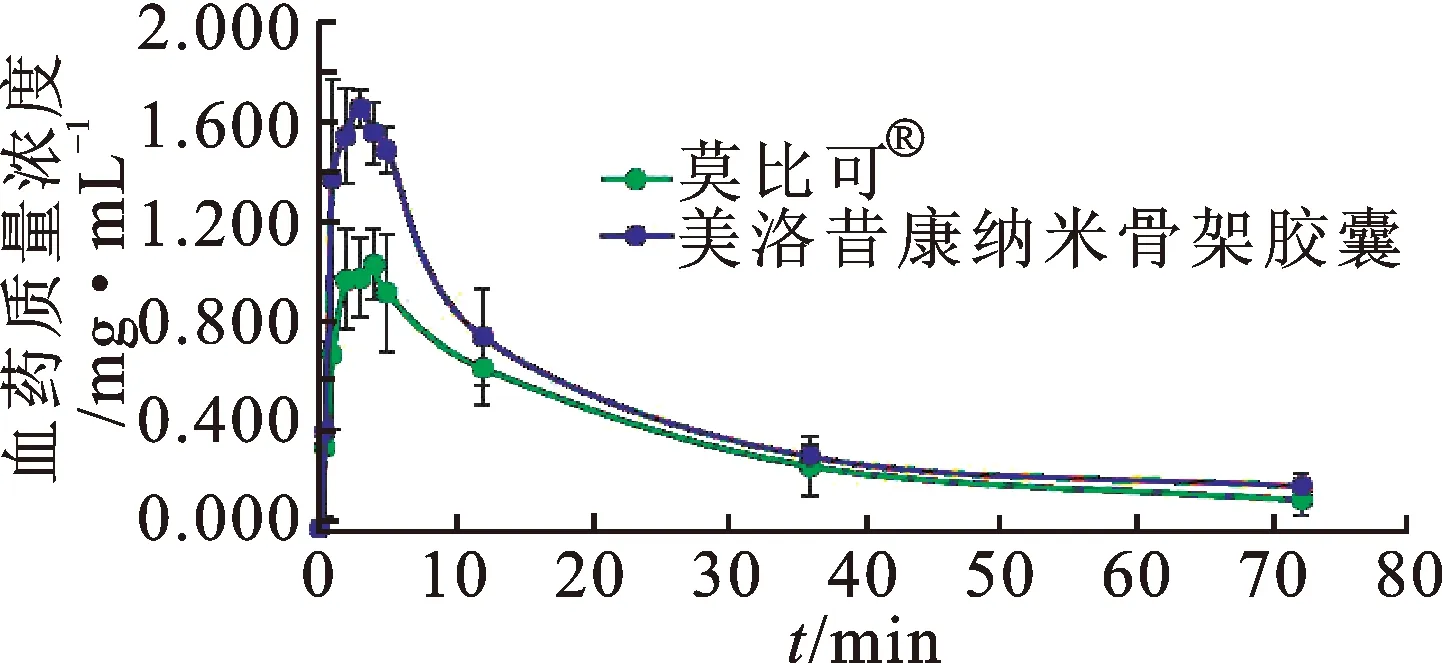
图2 口服2种制剂后的平均药-时曲线
表3 美洛昔康在比格犬体内药动学参数
3 讨论
美洛昔康纳米骨架胶囊是以具有纳米孔径的二氧化硅和pH敏感材料为主要载体,使难溶性药物美洛昔康高度分散,从而制备成的高溶出度、高生物利用度的制剂。其能提高体外溶出及体内吸收,是因为二氧化硅的巨大比表面积具有很强的吸附作用,使药物分散在其中,与溶出介质的接触面积更大,释放速率更快,且更小的粒径使药物的迁移变得更加容易,能够提高药物与胃肠道的接触面积,增加药物的生物利用度。另外,将药物制成固体分散体时易发生晶型转变,药物晶型由结晶转变为无定形,在溶解过程中,无需能量破坏药物的晶格结构,大大提高了药物的溶出速率,同时载体还可作为药物结晶的抑制剂来稳定处于高能态的无定形药物的存在。
根据生物药剂学分类,美洛昔康属于BCS Ⅱ类药物[8],溶出是口服吸收的限速步骤,而增加难溶药物的溶解度对其释药速率尤为重要[9-12]。此外,美洛昔康溶解度具有pH依赖性,在酸性介质中溶解度低[13],图2中莫比可®在酸性介质中的溶出行为有相应体现。而图2显示美洛昔康纳米骨架胶囊在酸性介质中的主药溶出度显著提高,从而确保了其在肠道内更快吸收。体现在比格犬体内药动学对比研究中,与市售莫比可®相比(tmax=3.500 h),美洛昔康纳米骨架胶囊表现出较快的药物吸收速率(tmax=2.833 h)。此外,药动学参数经等效性分析表明,相同剂量下,美洛昔康纳米骨架胶囊Cmax是莫比可®的1.461倍,AUC0-t是莫比可®的1.319倍,生物利用度提高30%左右。结果表明,美洛昔康纳米骨架胶囊显著提高了主药在酸性介质中的溶出量,且提升了其在比格犬体内的吸收速度与程度,临床应用可增强镇痛效果。
尽管美洛昔康是一种选择性COX-2抑制剂,但仍存在10%~20%的胃肠道不良反应发生率[14],且通常与剂量相关[15]。美国食品药品管理局(FDA)等专业医学组织的用药指南中明确强调:NSAIDs应在最短疗程内使用最低有效剂量,以降低心血管和胃肠道等毒性风险[16-17]。故在此基础上可继续开发起效时间快的低剂量美洛昔康制剂,减少药物用量以减缓胃肠道刺激,该研究为进一步开发新型美洛昔康制剂及其临床安全、合理用药提供了依据。

