高磷通过SET8-shRNA调控AKT/Caspase-3通路促进血管平滑肌细胞凋亡
刘 兰,张东雪,朱荣芳,梁向楠,李 晖,张胜雷(河北医科大学第四医院肾内科,石家庄 050011;通讯作者,E-mail:lei06352511@126.com)
血管钙化是引起心脑血管疾病发生甚至死亡的重要危险因素[1]。血管平滑肌细胞(vascular smooth muscle cells,VSMCs)凋亡是引发血管钙化的众多机制中重要的机制之一[2]。高磷血症是引起血管钙化的始动因素,高磷可使VSMCs钙化[3,4]。赖氨酸甲基转移酶SET8可甲基化非组蛋白TWIST、p53等,参与调控细胞凋亡、增殖等[5,6]。干扰SET8基因表达可促进VSMCs发生钙化[7]。但SET8在VSMCs钙化中的研究较少,通过何种机制起作用尚不明确。鉴于此,本研究以大鼠VSMCs为模型,探讨SET8在大鼠VSMCs钙化中的作用及机制。
1 材料与方法
1.1 主要试剂
β-甘油磷酸购自美国Sigma公司;DMEM培养液及胎牛血清均购自美国Gibco公司;RNA提取及反转录试剂盒均购自美国Thermo Fisher公司;实时荧光定量PCR试剂购自广州易锦生物技术有限公司;SET8质粒选自广州复能基因有限公司;茜素红S染料购自北京索莱宝有限公司;钙含量测定试剂盒购自中生北控生物科技股份有限公司;SET8、AKT及Caspase-3抗体选自英国Abcam公司;p-AKT购自美国Cell Signaling Technology公司。
1.2 实验模型的制备与分组
取4周龄清洁级、体质量约80-100 g的雄性SD大鼠(选自河北医科大学,编号:1305090)。体外分离大鼠胸主动脉,采用组织贴壁法,将组织块贴于瓶底,进行原代培养,传代至第3-4代,为验证高磷在血管平滑肌细胞钙化中的作用,将血管平滑肌细胞分为两组:①正常组:DMEM完全培养基;②高磷组(HP):完全培养基中加入10 mmol/L β-甘油磷酸。
为进一步验证SET8的调控作用,将血管平滑肌细胞分为6组:①正常组:完全培养基;②空质粒组:完全培养基,转染SET8-shRNA的对照质粒,浓度为2 μg/L;③SET8低表达组:完全培养基,转染SET8-shRNA质粒,浓度为2 μg/L;④高磷组:完全培养基中加入10 mmol/L β-甘油磷酸,细胞未转染;⑤空质粒+高磷组:完全培养基中加入10 mmol/L β-甘油磷酸,转染SET8过表达的对照质粒;⑥SET8过表达+高磷组:完全培养基中加入10 mmol/L β-甘油磷酸,转染SET8过表达质粒,浓度为2 μg/L。然后检测细胞钙化和凋亡情况。
为进一步验证AKT对钙化的影响,将细胞分为3组:①正常组:完全培养基;②对照组:完全培养基中加入1 μl DMSO;③AKT抑制剂组:完全培养基中加入1 μl DMSO溶解的AKT通路抑制剂LY294002。然后检测细胞凋亡情况。
1.3 茜素红染色检测各组血管平滑肌细胞钙化情况
干预后的血管平滑肌细胞,室温条件下,用4%多聚甲醛固定25 min,用茜素红(质量浓度为0.1%,pH8.4)染色,于37 ℃环境孵育30 min,观察橘红色钙结节情况,留取照片。
1.4 甲基麝香草酚蓝比色法检测各组血管平滑肌细胞钙离子含量
细胞刺激后弃上清液,加入1 mol/L的稀盐酸,进行脱钙过夜,取上清液,并测定钙含量,VSMCs用0.1 mol/L的氢氧化钠和0.1%的SDS孵育30 min,测定蛋白质含量,用蛋白校正(mg/g)。
1.5 MTT法检测各组血管平滑肌细胞增殖情况
取3代VSMCs以(3-10)×103个/ml接种于96孔板,生长至60%-70%融合时转染2 μg/L的SET8质粒。每组设3个复孔。实验结束前4 h加入5 mg/ml的MTT 20 μl,培养4 h后,弃培养液,各孔加入二甲基亚砜150 μl,室温振荡10 min。于酶标仪490 nm波长处测定吸光度(A)值,记录结果。
1.6 血管平滑肌细胞凋亡检测
取3代VSMCs接种于24孔板,生长至60%-70%融合时转染2 μg/L的SET8质粒和SET8-shRNA质粒。转染72 h后,4%多聚甲醛固定25 min,PBS液洗2遍,参照TUNEL染色试剂盒进行染色,加入50 μl反应工作液,避光孵育1 h,滴加DAPI染色液封片,显微镜下观察,蓝色荧光代表所有的细胞核,绿色荧光代表凋亡细胞核。
1.7 实时荧光定量PCR检测各组血管平滑肌细胞的SET8、AKT、Caspase-3 mRNA的表达
提取刺激后VSMCs的mRNA,测定SET8、AKT、Caspase-3 mRNA的表达。基因引物序列见表1,以GAPDH为内参。SET8、AKT、Caspase-3及GAPDH的反应条件为:即95 ℃预变性10 min;95 ℃变性10 s、60 ℃退火30 s、72 ℃延伸20 s,40个循环。收集图像并分析。

表1 各目的基因引物序列Table 1 Primer sequences of genes
1.8 Western blot检测各组血管平滑肌细胞的SET8、AKT、Caspase-3蛋白的表达
提取刺激后的VSMCs蛋白,测定SET8、AKT、Caspase-3的表达。取50 μg蛋白质加入10%的SDS-聚丙烯酰胺凝胶中,恒压95 V电泳1.5 h,恒压95 V转膜1 h,牛奶封闭1 h,放入一抗(p-AKT 1 ∶2 000,AKT 1 ∶1 000,SET8 1 ∶500,Caspase-3 1 ∶2 000,GAPDH 1 ∶5 000)稀释液,4 ℃孵育过夜。次日洗膜,将膜置于二抗(1 ∶5 000),室温下孵育1 h,于蛋白成像仪上显色。以Image-ProPlus分析光密度,以GAPDH为内参,结果以目的蛋白的相对表达量表示。目的蛋白相对表达量=目的蛋白积分光密度值(IOD)/内参积分光密度值(IOD)。实验重复3次。
1.9 统计学方法

2 结果
2.1 高磷在VSMCs钙化中的作用
2.1.1 给予高磷刺激后VSMCs钙化情况 茜素红染色显示,与正常组比较,高磷组橘红色钙化结节显著增多,钙离子含量显著升高(P<0.05,见图1)。

图1 茜素红染色观察高磷对VSMCs钙化的影响Figure 1 Effect of high phosphorus on calcification of VSMCs by Alizarin red staining
2.1.2 给予高磷刺激后VSMCs的AKT与Caspase-3的表达情况 与正常组比较,高磷组SET8和p-AKT蛋白相对表达量降低,Caspase-3蛋白相对表达量升高,差异有统计学意义(P<0.05,见图2)。

与正常组比较,*P<0.05图2 Western blot检测各组VSMCs凋亡相关蛋白表达Figure 2 The expression of apoptosis-related proteins in VSMCs detected by Western blot
2.2 SET8在VSMCs钙化中的作用
2.2.1 干扰SET8表达和给予SET8过表达后VSMCs钙化情况 茜素红染色显示,与正常组和空质粒组比较,SET8低表达组橘红色钙化结节显著增多,钙离子含量显著升高(P<0.05);与高磷组和空质粒+高磷组比较,SET8过表达+高磷组橘红色钙化结节显著减少,钙离子含量显著降低(P<0.05,见图3)。

与正常组比较,*P<0.05;与空质粒组比较,#P<0.05;与高磷组比较,&P<0.05;与空质粒+高磷组比较,△P<0.05图3 干扰SET8和过表达SET8对各组VSMCs钙化的影响Figure 3 Effects of interference with SET8 and SET8 overexpression on calcification of VSMCs in each group
2.2.2 SET8对VSMCs增殖的影响 MTT法检测结果显示,与正常组和空质粒组比较,SET8低表达组细胞增殖能力显著降低(P<0.05);与高磷组和空质粒+高磷组比较,SET8过表达+高磷组细胞增殖能力显著升高,差异有统计学意义(P<0.05,见图4)。
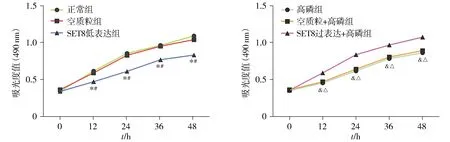
与正常组比较,*P<0.05;与空质粒组比较,#P<0.05;与高磷组比较,&P<0.05;与空质粒+高磷组比较,△P<0.05图4 MTT检测SET8对VSMCs增殖能力的影响Figure 4 Effect of SET8 on the proliferation of VSMCs by MTT assay
2.2.3 SET8对VSMCs凋亡的影响 TUNEL染色结果显示,与正常组和空质粒组比较,SET8低表达组中绿色荧光显著增多,提示SET8低表达组细胞凋亡增多;与高磷组和空质粒+高磷组比较,SET8过表达+高磷组中绿色荧光显著减少(见图5),提示SET8过表达+高磷组细胞凋亡减少。

绿色为TUNEL染色阳性,蓝色为DAPI染色细胞核图5 TUNEL染色检测细胞凋亡 (×200)Figure 5 Apoptosis detected by TUNEL staining (×200)
2.2.4 干扰SET8表达和给予SET8过表达后VSMCs中的AKT和Caspase-3的表达 与正常组和空质粒组比较,SET8低表达组AKT及SET8的表达显著降低(P<0.05),Caspase-3表达显著升高(P<0.05);与高磷组和空质粒+高磷组相比,SET8过表达+高磷组AKT及SET8的表达显著升高(P<0.05),Caspase-3表达显著降低,差异有统计学意义(P<0.05,见图6,7)。

与正常组比较,*P<0.05;与空质粒组比较,#P<0.05;与高磷组比较,&P<0.05;与空质粒+高磷组比较,△P<0.05图6 实时荧光定量PCR检测各组VSMCs凋亡相关基因表达Figure 6 Expression of apoptosis-related genes in VSMCs in each group by real time fluorescence quantitative PCR
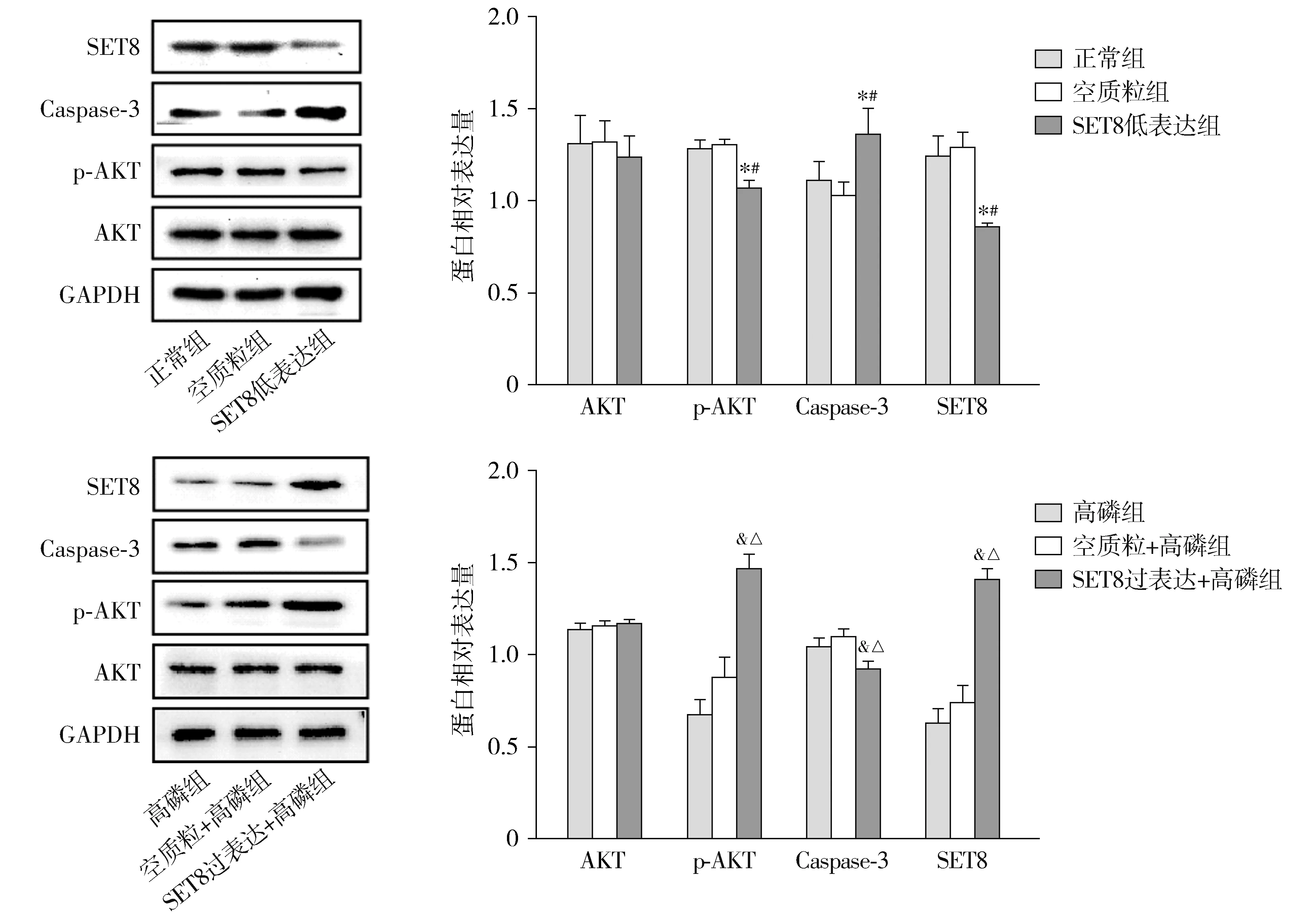
与正常组比较,*P<0.05;与空质粒组比较,#P<0.05;与高磷组比较,&P<0.05;与空质粒+高磷组比较,△P<0.05图7 Western blot检测各组VSMCs凋亡相关蛋白表达Figure 7 The expression of apoptosis-related proteins in VSMCs was detected by Western blot
2.3 AKT在VSMCs钙化中的作用
与正常组和对照组相比,AKT抑制剂组Caspase-3的mRNA和蛋白表达显著升高,p-AKT的mRNA和蛋白表达显著降低,差异有统计学意义(P<0.05,见图8)。

与正常组比较,*P<0.05;与对照组比较,#P<0.05图8 实时荧光定量PCR和Western blot检测凋亡相关基因和蛋白的表达Figure 8 The expression of apoptosis-related genes and proteins detected by real-time fluorescence quantitative PCR and Western blot
3 讨论
血管钙化是导致心血管疾病发病率增高的重要原因[8]。导致血管钙化的重要危险因素之一是高磷血症[9]。研究表明高磷可诱导血管平滑肌细胞发生钙化[4]。其中VSMCs发生钙化的重要机制有VSMCs的凋亡[10]。本研究采用大鼠VSMCs为模型,发现干扰SET8表达可以加重VSMCs钙化,可能是通过抑制AKT表达,促进Caspase-3表达,从而促使VSMCs发生凋亡,进而加重了VSMCs的钙化。
SET8是一种赖氨酸甲基转移酶,能够特异性地催化组蛋白H4赖氨酸20位(H4K20)单甲基化,主要调节细胞凋亡、增殖等生物学功能[7,11]。研究表明干扰SET8基因表达可导致细胞发生凋亡[7,12]。研究显示高磷环境VSMCs会发生转分化,进而导致细胞发生凋亡[8,13]。本项研究建立高磷诱导的VSMCs钙化模型,发现给予高磷刺激后,VSMCs发生钙化,且SET8和AKT表达降低,Caspase-3表达升高,与研究结果一致[7,13]。Yang等[14]研究显示SET8和TWIST能够相互作用,SET8可催化H4K20单甲基化进而可以调控TWIST靶基因的转录,而TWIST能够增强AKT表达,进而促进细胞增殖[15,16]。本研究为了验证SET8在VSMCs钙化中的作用,干扰SET8表达,发现钙化程度加重,且AKT表达降低,Caspase-3表达升高。而在高磷环境增高SET8表达,发现VSMCs钙化显著降低,且AKT表达升高,Caspase-3表达降低。MTT检测细胞增殖能力,结果显示干扰SET8表达后细胞增殖能力降低,而在高磷环境增高SET8表达后细胞增殖数增加。TUNEL检测细胞凋亡情况,结果显示,VSMCs给予高磷刺激后凋亡增多;干扰SET8表达后VSMCs凋亡增多,而在高磷环境增高SET8表达后VSMCs凋亡减少。表明高磷可能通过抑制SET8表达,而抑制AKT表达、促进Caspase-3表达,进而促进VSMCs凋亡,增加VSMCs钙化的发生。
有研究表明活化的AKT可以使Caspase-3失活,从而抑制细胞发生凋亡,进而抑制了细胞发生钙化[17,18]。本研究为验证AKT是否通过抑制Caspase-3,而减轻VSMCs钙化,给予AKT通路抑制剂,观察Caspase-3的表达情况。结果显示给予AKT通路抑制剂后,AKT表达降低,且凋亡基因Caspase-3的表达升高。表明活化的AKT可抑制Caspase-3的表达,与研究结果一致。
综上所述,高磷可促进大鼠VSMCs钙化,可能通过SET8-shRNA,抑制AKT表达,进而促进Caspase-3表达,使VSMCs的凋亡增加,从而诱导了VSMCs的钙化。
——一道江苏高考题的奥秘解读和拓展

