新疆吐鲁番坎儿井饮用水中微生物多样性分析
日孜万古力·艾山 努尔古丽·热合曼 麦日艳古·亚生 伊力米热·热夏提
(1.新疆师范大学生命科学学院,新疆 乌鲁木齐 830054;2.新疆特殊环境物种保护与调控生物学实验室,新疆 乌鲁木齐 830054)
吐鲁番的坎儿井已有2 000多年的历史,是吐鲁番盆地生产、生活的重要水源[1-2]。坎儿井依靠地下暗渠输水,不受季节风沙影响、蒸发量小、流量稳定,结构为整个水系提供独特的水质和稳定的微生物菌群的自然环境的同时[3-4],这一相对封闭的环境有利于这一宝贵的水资源远离污染。有研究[5]表明,长期饮用坎儿井水对人体有益。
目前国内外关于坎儿井的研究主要集中在对其水质分析[6-7]及对农业生产[8-9]和生态环境[10-11]的影响等方面,但对坎儿井微生物多样性方面的研究尚未见报道。阿尔菲娅[12]研究表明,用坎儿井水和面不添加酵母粉也可以烤制出具有特殊风味的馕,而且其品质显著优于用自来水或其他饮用水制备的。但这一特殊的味道来自于面粉中的微生物还是坎儿井水中的微生物,坎儿井水质能否影响面团发酵过程,这方面还未见相关研究报道。研究拟以新疆吐鲁番坎儿井水为研究对象,通过Illumina Miseq测序分析坎儿井水中的微生物群落多样性,为坎儿井水的合理应用及食用安全性提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 样本来源
于2020年9月11日,样品分别采自阿木尔坎儿井(位于吐鲁番市托克逊县夏乡喀格恰克村),沙依坎儿井(位于吐鲁番市葡萄乡达甫散盖村),奥吾提坎儿井(位于吐鲁番市葡萄乡英萨村),米依木阿吉坎儿井(位于吐鲁番市亚尔乡亚尔村)(样品特点见表1)。每个样点取10 L装入无菌的水样瓶内,带回实验室保存于4 ℃。每个样品做3个平行,通过抽滤法在0.22 μm的纤维滤膜上富集微生物,抽滤完成后再将滤膜装于无菌离心管中,用封口膜紧密地包装并立即存放在-80 ℃冰箱冻存,用于检测微生物多样性。
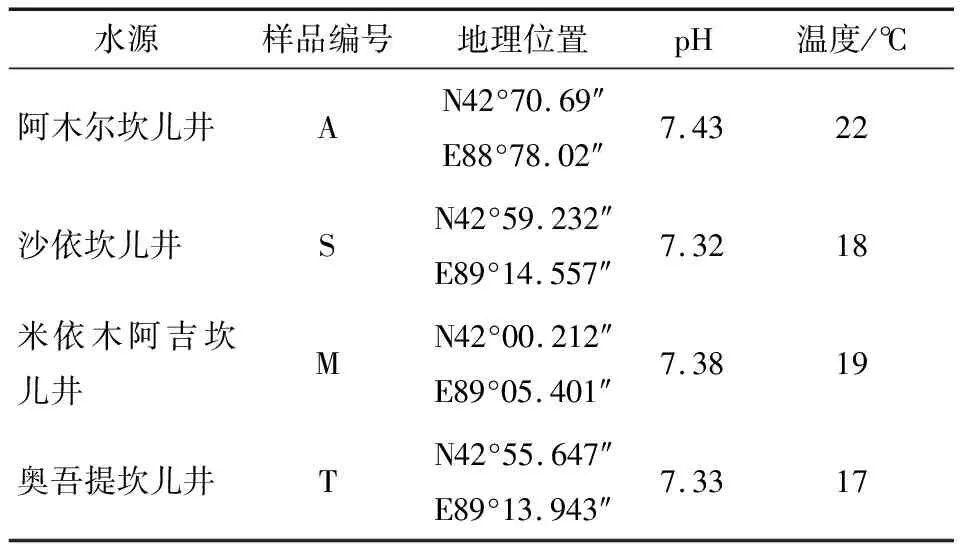
表1 样本信息
1.1.2 主要仪器设备
离心机:Eppendorf 5430R型,合肥艾本森科学仪器有限公司;
超微量分光光度计:NanoDrop2000型,美国Thermo Fisher Scientific公司;
酶标仪:BioTek ELx800型,美国Biotek公司;
微型荧光计:QuantiFluorTM-ST型,美国Promega公司;
电泳仪:DYY-6C型,北京六一仪器厂;
PCR仪:ABI GeneAmp®9700型,美国ABI公司;
测序仪:Illumina Miseq型,美国Illumina公司。
1.2 高通量测序及分析
1.2.1 高通量测序流程
取样→环境样品DNA抽提→设计合成引物接头→PCR扩增与产物纯化→PCR产物定量与均一化→构建PE文库→高通量测序
1.2.2 DNA提取、扩增 样品总DNA提取完成后,检测利用1%琼脂糖凝胶电泳提取的基因组DNA。在后续操作之前,应将其贮藏在-20 ℃[13]。
采用TransGen AP221-02:TransStart Fastpfu DNA Polymerase,PCR扩增细菌16S rRNA的V3~V4区,真菌26S rRNA的ITS区,细菌和真菌所使用的正向引物和反向引物分别为338F和806R、ITS1F和ITS2R。细菌和真菌引物列表如表2所示,用ABI GeneAmp.9700型PCR仪进行扩增。PCR扩增反应程序如表3所示。
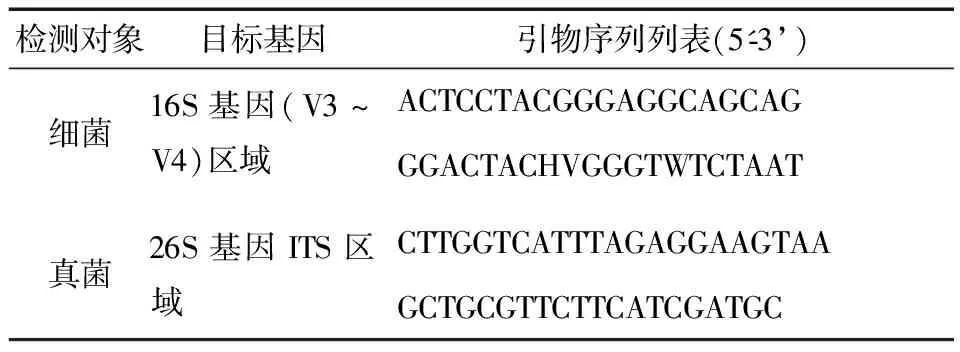
表2 细菌、真菌特异性引物列表

表3 PCR扩增反应程序
PCR扩增完成后,全部PCR产物采用AxyPrepDNA 凝胶回收试剂盒进行回收,用Tris-HCl洗脱,QuantiFluorTM-ST蓝色荧光定量系统进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混匀后完成文库制备,将文库进行测序。文库的构建与上机测序流程均由上海美吉生物医药科技有限公司完成。
1.2.2 生物信息分析 使用fastp(https://github.com/OpenGene/fastp,version 0.20.0)软件对原始测序序列进行质控,使用FLASH(http://www.cbcb.umd.edu/software/flash,version 1.2.7)软件对每个样品的Reads进行拼接,得到的序列为原始Tags数据;拼接得到的原始Tags数据,经过过滤得到高质量的Tags数据(Clean Tags)。参照Qiime(V1.9.0,http://qiime.org/scripts/split_libraries_fastq.html)的Tags质量控制流程,进行Tags截取、长度过滤后进行去除嵌合体序列的处理,使用UPARSE软件(http://drive5.com/uparse/,version 7.1),根据97%的相似度对序列进行OTU 聚类并剔除嵌合体。
利用RDP classifier(http://rdp.cme.msu.edu/,version 2.2)对每条序列进行物种分类注释,通过Mothor方法比对Silva 16S rRNA数据库(设置比对阈值为70%),获得在各个分类水平上的信息。通过Qiime软件计算Sobs、Chao、Shannon、Simpson、coverage等多样性指数,用R软件(Version 2.15.3)绘制稀释曲线及Alpha多样性指数组间差异分析。通过Qiime软件(Version 3.3.1)计算Unifrac,并通过R软件进行物种组成分析及Beta多样性指数组间差异分析。
2 结果与分析
2.1 细菌和真菌序列丰度及多样性分析
通过测序,对原始测序序列进行拼接、质控、优化后共获得细菌16S rRNA和真菌26S rRNA有效基因序列。无抽平得到的细菌原始序列为细菌583 710条,真菌716 621条。原始序列进行过滤、优化、拼接后总共获得有效序列为细菌446 700条,真菌407 376条。基于97%一致性对OTUs进行注释,共得到2 586个OTUs。其中细菌1 456个OTUs、真菌1 130个OTUs。稀释曲线趋于平缓,说明测序数据量合理,再增加测序量已不太可能检测到新的微生物种[14]。如图1所示,随着样本量的增加,细菌和真菌sobs曲线急剧上升,说明样品群落中大量的物种被检测到,随后曲线逐渐平稳,说明可以进行以后的数据分析。
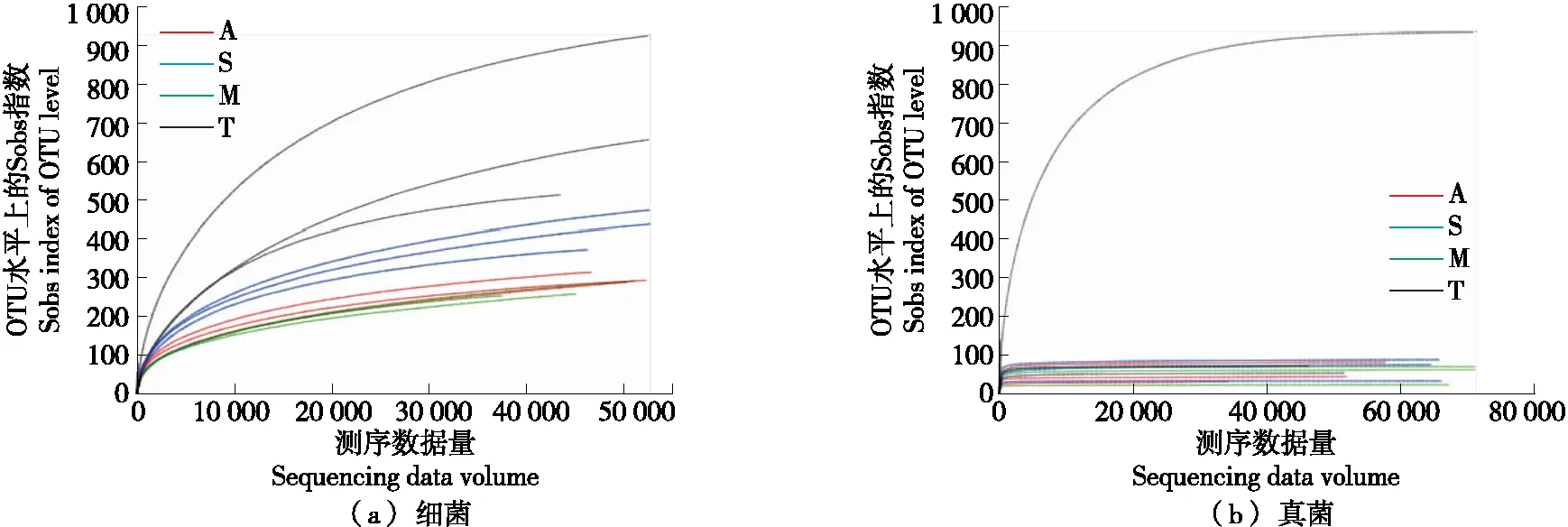
图1 Sobs稀释曲线
如图2(a)所示,样品T在横坐标上的宽度要比其他组宽度较宽,横坐标上的范围也大,表明样品T物种丰度高;其他样品的垂直曲线逐渐平坦,表明物种分布均匀。如图2(b)所示,样品T的物种多样性高,而其他样品中优势菌群的所占比例很高,多样性较低。

图2 Rank-Abundance曲线
如表4所示,细菌的测序深度远高于真菌。细菌和真菌样品A和M 的Sobs指数与Chao指数最低,说明样品A和样品M 的微生物群落丰富度最低。样品T的Sobs指数与Chao指数最高,说明该样品的微生物群落丰富度最高,多样性也高。但是各样品之间微生物群落多样性无显著性差异。Coverage指数对所有样本的覆盖率均在0.99以上,表明该测序水平可识别各样本中所有的细菌和真菌系统类型,所得数据可靠。
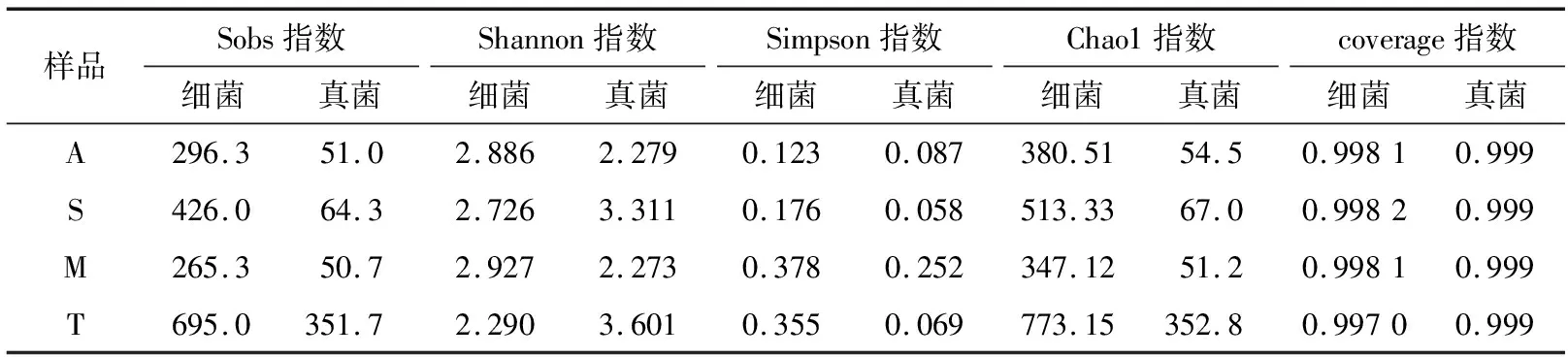
表4 Alpha多样性指数
2.2 物种组成分析
由图3(a)可知,细菌4组样品共有173个核心OTUs,样品A独有105个OTUs、样品S独有91个OTUs、样品M独有45个OTUs、样品T独有487个OTUs。表明样品T中细菌微生物群落较其余组丰富。
由图3(b)可知,真菌4组样品共有13个核心OTUs,样品A独有48个OTUs、样品S独有56个OTUs、样品M独有52个OTUs、样品T独有868个OTUs。表明样品T中真菌微生物群落较其余组丰富。
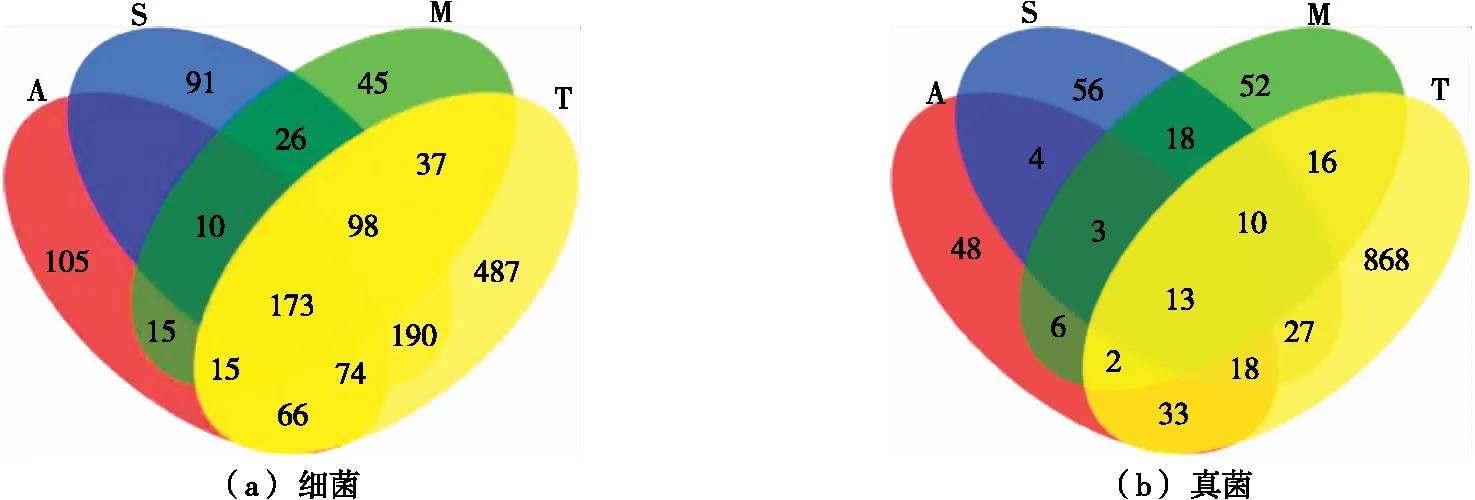
图3 OTU水平上的Venn图分析
2.3 不同样品在细菌和真菌属水平上的差异性分析
由图4(a)可知,4组样品细菌物种丰度均独立,各样品组内聚在一起,组外距离较远,未出现重叠现象,表明这些样品在细菌群落结构上具有显著差异。
由图4(b)可知,来自吐鲁番市内的3组样品交叉聚集在一起,来自托克逊县的样品与其余组存在一定的差异。样品A与其他3组样本虽距离较近,但未相互重叠,群落组成相互独立。4组样品的群落组成结构可以分为2种类型:样品M、T、S 3组相互重叠,表明3组样品的真菌群落组成较相似。这3种样品都有大丰富度油壶菌属(Olpidium)分别占31.84%,16.38%,15.77%为主导优势,真菌的菌群组成和丰富度的区别较小。此外样品A分布相互独立,未出现重叠现象,组内分布较散,表明该组的真菌群落组成结构差异较大。
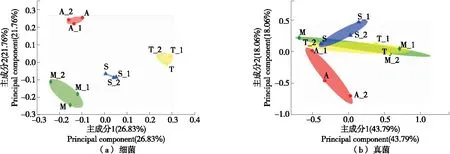
图4 基于加权 Uni Frac 距离的不同样品 PCoA图
2.4 微生物群落结构分析及优势菌属
2.4.1 不同样品中细菌群落结构分析及优势菌属 为了研究样品的物种组成多样性信息,对所有样品有效序列进行聚类,以97%的序列相似性将序列聚类成为OTU(可操作分类单元,相当于种水平)再深度分析。结果显示,4种样品细菌16S rRNA共涉及到40个门,变形菌门(Proteobacteria)是绝对优势菌门,占据87.48%~94.90%,其次是拟杆菌门(Bacteroidota)占据0.49%~3.70%,详见表5。
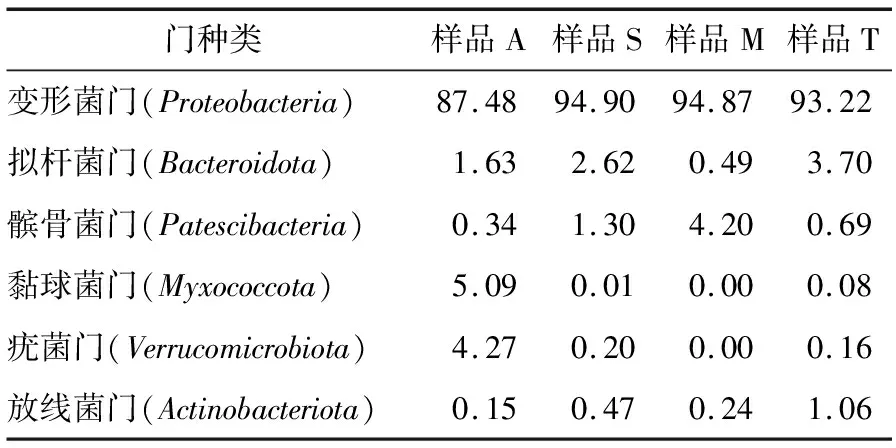
表5 门水平上各样品细菌相对含量(序列所占比例)
基于16S rRNA分析,从4种样品中共测出537个细菌属,其中嗜氢菌属(Hydrogenophaga)为优势菌属,其次是未鉴定的丝毛单胞菌属(unclassified_f_Comamonadaceae)、曲杆菌属(Curvibacter)、假单胞菌属(Pseudomonas)(详见图5)。
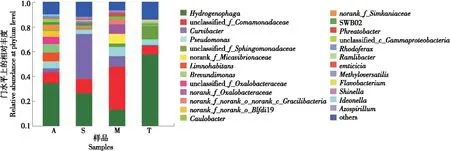
图5 细菌属水平群落Bar图
样品A中特有的优势菌属为嗜氢菌属(Hydrogenophaga)占34.31%;样品S中特有的优势菌属为曲杆菌属(Curvibacter)占36.33%;样品M中特有的优势菌属为未鉴定的丝毛单胞菌属(unclassified_f_Comamonadaceae)占34.84%;样品T中特有的优势菌属为嗜氢菌属(Hydrogenophaga)占57.66%。优势菌可能来自地下坎儿井水附近的土壤中的微生物,其成为优势的原因可能是坎儿井依靠地下暗渠输水环境相对封闭,不受外界及四季变化的影响,其温度常年几乎是恒定的,这些优良自然特征仍待进一步研究。
对4种坎儿井水中的细菌进行分析结果表明,在16S rRNA门水平上,样品A、S、M、T中的优势菌门均为变形菌门(Proteobacteria),分别占87.48%,94.90%,94.87%,93.22%。在属水平上,样品A、T中优势菌属是嗜氢菌属(Hydrogenophaga),分别占34.31%,57.66%;样品S中优势菌属是曲杆菌属(Curvibacter),占36.33%;样品M中优势菌属是不可鉴定的丝毛单胞菌属(unclassified_f_Comamonadaceae),占34.84%。在种水平上,样品A、S、T中优势菌种是不可鉴定的嗜氢菌种(unclassified_g_Hydrogenophaga),分别占32.02%,23.69%,57.53%;样品M中优势菌种是未鉴定的丝毛单胞菌种(unclassified_f_Comamonadaceae),占34.84%。
2.4.2 不同样品中真菌群落结构分析及优势菌属 基于ITS测序门水平,4种样品共涉及12个门,子囊菌门(Ascomycota)是主要优势菌门,占据44.59%~61.07%,其次是油壶菌门(Olpidiomycota)、担子菌门(Basidiomycota)、未鉴定的真菌门(unclassified_k_fungi)、其他真菌门丰富度<5%(详见表6)。
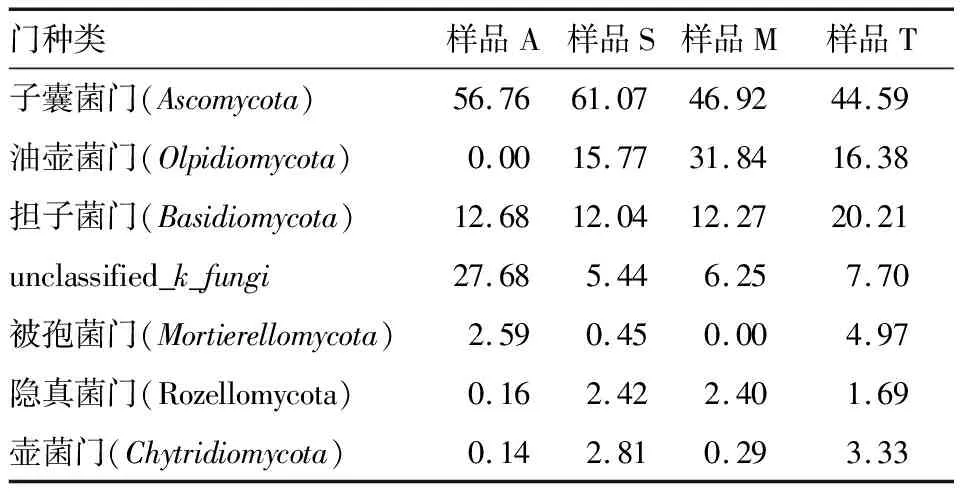
表6 门水平上各样品真菌相对含量(序列所占比例)
基于ITS分析,4种样品共涉及568个真菌属,其中油壶菌属(Olpidium)为优势菌属,其次是未鉴定的真菌属(unclassified_k_fungi)、枝孢属(Cladosporium)(详见图6)。
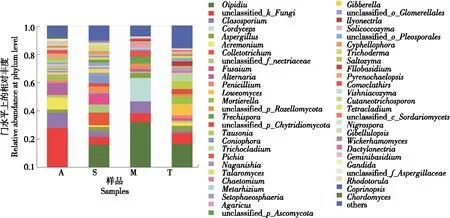
图6 真菌属水平群落Bar图
样品A特有的优势菌属为未鉴定的真菌属(unclassified_k_fungi)占27.68%;样品S特有的优势菌属为油壶菌属(Olpidium)占15.77%;样品M特有的优势菌属为油壶菌属(Olpidium)占31.84%;样品T特有的优势菌属为油壶菌属(Olpidium)占16.38%。坎儿井饮用水的自我净化能力、民间流传的助于消化、消除疲劳等功能等科学问题,仍待通过进一步研究水质分析、分离鉴定其中可培养的微生物菌株及其产酶活性检测等研究结果才能得到解析。
对4种坎儿井水中的真菌进行分析结果表明,在26S rRNA 门水平上,样品A、S、M、T中优势菌门均为子囊菌门(Ascomycota),分别占56.76%,61.07%,46.92%,44.59%。在属水平上,样品A中优势菌属为未鉴定的真菌属(unclassified_k_fungi),占27.68%;样品S、M、T中优势菌属为油壶菌属(Olpidium),分别占15.77%,31.84%,16.38%。在种水平上,样品A中优势菌种是未鉴定的真菌种(unclassified_k_fungi),占27.68%;样品S、M、T中优势菌种是油壶菌种(Olpidiumsp),分别占15.77%,31.49%,16.38%。此外还检出Candida、Pichia、Mortierella、Aspergillus、Alternaria等菌属,以上属的占比虽少,但它们能影响传统发酵酸奶风味的形成及成熟过程[15-16]。Candida、Pichia等属还参与传统发酵饮料博扎的发酵过程,而且是博扎发酵过程中的优势菌属[17-18]。Candida也是发酵饮料开菲尔中的酵母之一,它给开菲尔带来醇味、脂香和CO2的同时起到改善开菲尔口感的作用[19]。
阿尔菲亚等[12,20]曾采用阿木尔坎儿井水(试验中的样品A)制成的传统馕饼酸面团进行微生物多样性分析,结果显示其优势菌门为Firmicutes、Ascomycota。该结果与试验中的相比较,虽然在门水平有共同点,但是在属水平存在很大的差距。与吐鲁番传统馕饼面团相比,用坎儿井水和的面团芳香类物质种类丰富,相对百分含量较高[20]。因此推测:坎儿井水中微生物并非是新疆馕饼传统发酵酸面团中优势微生物直接来源,可能是坎儿井水中某些成分影响面团发酵过程中优势微生物变化趋势,影响了酸面团挥发性物质的种类及其变化,从而改善了馕饼风味。
变性菌门是细菌中最大的一个门,包括很多病原菌,如大肠杆菌、沙门氏菌、幽门螺杆菌等。试验过程中未从坎儿井水中检测出对人体有毒有害的微生物信息,符合GB 8537—2018《食品安全国家标准 饮用天然矿泉水》和GB 5749—2006《生活饮用水卫生标准》对食品加工用水微生物的要求。
3 结论
采用高通量测序技术对新疆吐鲁番4种不同坎儿井饮用水进行微生物群落组成及多样性分析。结果表明:细菌在属水平,嗜氢菌属占优势,其次为不可鉴定的丝毛单胞菌属、曲杆菌属、单胞菌属;在种水平,不可鉴定的嗜氢菌种占优势,其次是不可鉴定的丝毛单胞菌种。关于真菌多样性方面在属水平上,油壶菌属占优势,其次是不可鉴定的真菌属;在种水平,油壶菌种占优势,其次是不可鉴定的真菌种。但关于坎儿井水质的物理化学等其他指标能否符合国家标准、当地居民能否安心饮用、能否满足于食品加工用水的要求、坎儿井水对饮食文化及人类健康的贡献等方面之后再进一步深度研究。

