河南商丘月季黑斑病病原菌鉴定及生物学特性
娄喜艳 郭洋洋 裴冬丽

摘要:月季是一种世界上常见的、重要的观赏植物。2019年10月在河南省商丘市平原路、长江路、文化路等绿化带发现月季植株患有黑斑病,为鉴定河南省商丘市月季黑斑病病原菌,采集月季患病植株叶片,使用单孢分离法对该病原菌进行分离,纯化得到1株病原菌SQYJAA-1。对该病原菌SQYJAA-1进行形态学鉴定,利用室内人工接种的方法对其进行致病性测定,对其rDNA ITS、GPD和EF1-α等3个基因序列进行PCR扩增和测序分析。结果表明,病原菌的分生孢子为棕褐色,呈倒棒状,表面有横隔膜和纵隔膜。该菌株能使健康月季离体叶片出现黑斑病病症。多基因系统进化分析表明,该病原菌菌株SQYJAA-1(ITS序列MN495846,GPD序列MK683866,EF1-α序列MT133312)与链格孢(Alternaria alternata)(ITS序列MN495797,GPD序列MK683865,EF1-α序列KY094931)聚于1个分支,由此确定河南省商丘市月季黑斑病病原菌SQYJAA-1为链格孢。生物学特性分析表明,SQYJAA-1菌丝最适宜生长的温度为28 ℃,pH值为6.0,光照条件为24 h光照,最适宜SQYJAA-1菌丝生长的碳源为葡萄糖,氮源为蛋白胨。研究结果为河南省商丘月季黑斑病的防治提供了理论依据和应用价值。
关键词:月季;黑斑病;链格孢;形态学鉴定;分子生物学鉴定;生物学特性分析
中图分类号:S436.8+1 文献标志码: A文章编号:1002-1302(2021)19-0138-06
月季(Rosa chinenisis)被称为花中皇后,一年四季开花,是一种重要的观赏植物,也是表达友谊、欢庆和祝贺的首选花卉[1]。月季属于蔷薇科(Rosaceae)蔷薇属(Rosa),栽培面积非常广,自然花期从8月到次年4月。月季的花朵成大型,由内向外发散形地生长,有浓郁扑鼻的香气,可广泛用于园艺栽培和切花,花朵可提取香精,也可入药[2]。
浇水、施肥、光照、虫害等环境外因与月季自身生长内因促使其发病。据统计,目前已发现的月季常见病害有黑斑病、白粉病、灰霉病、霜霉病、叶霉病、灰斑病、锈病、叶枯病、枝枯病、炭疽病、褐斑病、根癌病、花叶病等共13种病害[3]。其中,黑斑病最为严重,是月季病害的世界性三大病害之一,在我国大多数的月季种植区经常发生,发病率很高,尤其是月季的叶片上发病率很高,破坏性很强。初始,月季叶片上形成黑色小斑点,之后小斑点间相互联结形成大斑点[4]。月季黑斑病已报道的病原菌主要为蔷薇盘二孢和链格孢属[5],链格孢属又分为链格孢和细极链格孢。Abbas等首次报道在巴基斯坦暴发的月季黑斑病主要由链格孢属(Alternaria spp.)的菌种引起[6]。在国内,2013年陕西省生物技术重点实验室在西安市采集具有典型黑斑症状的月季植株,分离纯化鉴定为蔷薇盘二孢(Marssonina rosae)[7]。2017年6—7月山西省运城学院花圃采集具有典型黑斑症状的月季植株,分离纯化鉴定为链格孢(A. alternata)[5]。
2019年10月在河南省商丘市平原路、长江路和文化路等多个绿化带发现月季植株患有黑斑病,本试验为明确河南省商丘市月季黑斑病病原菌的种类,对其进行分离纯化,从形态和分子方面进行鉴定,并对引起月季黑斑病病原菌链格孢的生物学特性进行研究,为生产实践中月季黑斑病科学防控提供依据。
1材料与方法
1.1材料
1.1.1供试植株2019年10月于河南省商丘市平原路、长江路、文化路等绿化带采集患有黑斑病的月季叶片。
1.1.2试剂和培养基
1.1.2.1试剂DNA Marker(DL2000)、2×Taq Mixture、10×Loading buffer等试剂购于大连TaKaRa公司;ITS1引物(5′-TCCGTAGGTGAACCTGCGG-3′)、ITS4引物(5′-TCCTCCGCTTATTGATATGC-3′)、GPD1引物(5′-CAACGGCTTCGGTCGCATTG-3′)、GPD2引物(5′-GCCAAGCAGTTGGTTGTGC-3′)、EF1-728引物(5′-CATCGAGAAGTTCGAGAAGG-3′)和EF1-986R引物(5′-TACTTGAAGGAACCCTTACC-3′])由生工生物工程(上海)股份有限公司合成。DNA测序由生工生物工程(上海)股份有限公司测序完成。
1.1.2.2马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基的配制先把马铃薯清洗干净并且把皮去掉,把芽眼也去掉,然后把称取好的200 g的马铃薯切成玉米粒大小的块状,开始加水煮烂,直到这些小块状的马铃薯能被玻璃棒一碰就戳破即可。用8层纱布过滤,把滤液倒入烧杯中,把称取好的20 g琼脂粉也倒在盛有滤液的烧杯中,用玻璃棒充分搅拌并混匀,待琼脂完全溶解后,在向其中加入20 g葡萄糖,稍微冷卻后用蒸馏水定容至1 L,调节pH值至7.0,然后将配制好的培养基分装至锥形瓶中,包扎好放入灭菌锅中灭菌,灭菌结束后,取出锥形瓶,冷却后贮存备用。
1.2方法
1.2.1病原菌分离采用单孢分离法进行病原菌分离。首先选取有明显黑斑病病斑的叶片,在病健交界处切取5 mm×5 mm大小的组织块,在75%乙醇溶液中浸泡消毒,30 s后用无菌水连续漂洗3次,再用2%次氯酸钠溶液浸泡1 min,然后用无菌水浸洗3次,放在灭过菌的滤纸上晾干后转移至PDA培养基上于28 ℃恒温培养,用第3次的清洗液涂布平板作为阴性对照,4~5 d后观察菌落生长状况。然后重新把菌丝尖端放置于新的PDA培养基中,在 28 ℃ 下恒温培养,一直重复操作到分离菌株纯化为止。
1.2.2病原菌形态学鉴定观察菌落的正反面颜色、菌丝疏密程度等菌落特征,然后在光学显微镜下进行镜检,观察月季黑斑病病原菌的菌丝以及分生孢子的特征,如分生孢子的大小、形状、孢子梗和有无隔膜等。
1.2.3病原菌分子生物学鉴定提取DNA使用CTAB法[4],具体操作步骤为:试验开始前先将异丙醇放入-20 ℃冰箱中预冷,70%乙醇4 ℃预冷,水浴锅加热到58 ℃。用灭过菌的枪头刮取0.1 mL菌丝置于1.5 mL离心管中,向保存菌丝的离心管中加入少量石英砂(约20 μL),加300 μL的2%CTAB提取缓冲液,开始用研磨棒研磨,直到研磨充分为止。然后加入200 μL的2% CTAB提取缓冲液,把离心管放置于58 ℃水浴锅中,水浴1 h后冷却至室温(水浴时每10 min颠倒混匀1次)。水浴结束后,在离心管中加入等体积的500 μL的三氯甲烷/异戊醇(24 ∶1),在10 000 r/min离心10 min的条件下充分振荡混匀,离心期间将10%CTAB提取缓冲液 65 ℃ 水浴加热。离心后取300 μL的上清液于新的离心管中,向离心管中加入30 μL的提前预热好的10%CTAB提取缓冲液,振荡混匀,然后加入 330 μL 的三氯甲烷/异戊醇(24 ∶1),在10 000 r/min离心10 min的条件下充分振荡摇匀。离心结束后取250 μL的上清液于新的离心管中,加入250 μL提前预冷好的异丙醇,轻轻混匀,在-20 ℃的条件下静置30 min(最多1 h以上)。静置后再次离心,然后在12 000 r/min、4 ℃的条件下离心10 min。然后将上清液缓慢移去,倒置片刻,加入1 mL提前预冷的70%乙醇洗涤,在10 000 r/min的条件下离心5 min。再重复1次洗涤,洗涤完成后移去上清液,把剩余的液体用灭过菌的枪头小心的吸去,最好不要吸到沉淀,在工作台上完全风干(30 min左右)。最后加入30 μL的去离子水,在-20 ℃的条件下保存以便进行下一步的操作。
PCR反应体系50 μL,其中模板3 μL,上游引物1 μL,下游引物1 μL,2×Taq Mixture 25 μL,去离子水20 μL。设置PCR反应程序:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火45 s,35个循环;72 ℃延伸10 min。将扩增产物送到生工生物工程(上海)股份有限公司进行比对测序,把得到的序列在GenBank上用BLAST进行同源性比对,下载与月季黑斑病病原菌相关的同源序列,联合rDNA ITS序列、GPD序列和EF1-α序列,利用MEGA 7.0软件的邻位方法构建系统发育树。
1.2.4致病性测定采用离体接种法进行病原菌的致病性测定[8],在接种前用无菌水对健康无病的月季叶片进行冲洗,除去表面杂质,用灭菌接种针进行刺伤处理。将在28 ℃条件下培养4~5 d的病原菌用打孔器制成直徑为5 mm的菌饼,接种于接种点处,用无菌PDA培养基圆片用来当作对照。将接种后的叶片放置于铺有湿润脱脂棉的培养皿内,于25 ℃下保湿培养3~5 d,每天观察发病状况。
1.2.5病原菌生物学特性的测定(1)不同温度、pH值和光照对病原菌菌丝生长的影响试验。采用平板测定法[9],把直径为5mm的SQYJAA-1菌饼接种在PDA培养基的正中央,分别设置温度为4、20、28、30、37、40 ℃;把直径为5 mm的SQYJAA-1菌饼接种在pH值为4.0、5.0、6.0、7.0、8.0、9.0、10.0的PDA培养基正中央;分别在全光照、全黑暗、光—暗12 h—12 h条件下,把直径为5 mm的SQYJAA-1菌饼接种在PDA培养基的正中央,把以上处理分别放在培养箱中培养,定期测量菌落直径[10],每个处理重复3次。
(2)碳源和氮源对病原菌菌丝生长的影响试验。采用平板测定法[9],把直径为5 mm的SQYJAA-1菌饼接种在不含蔗糖的查氏培养基中,以乳糖、蔗糖、葡萄糖、麦芽糖、果糖、淀粉为6种碳源;把直径为5 mm的SQYJAA-1菌饼接种在不加硝酸钠的查氏培养基中,分别加入蛋白胨、硫酸铵、硝酸铵、硝酸钾和硝酸钠5种氮源,把以上处理分别放在培养箱中培养,定期测量菌落直径[10],每个处理重复3次。
1.3数据分析
利用IBM SPSS Statistics 21软件对试验数据进行统计分析,利用邓肯氏多重比较法对试验数据进行差异显著性分析。
2结果与分析
2.1月季黑斑病发病症状
月季黑斑病主要发生在叶片上。发病初期,叶片正面出现小的暗褐色斑点,随着时间的推移渐渐扩大为圆形的或近圆形的黑色斑点。发病后期,月季黑斑病斑点上有散在的黑色颗粒,呈散生或者轮状排列,有些品种的斑点是相互连接的。叶柄上开始产生椭圆形的暗褐色斑点,略凸起,斑点边缘无明显菌丝。月季花瓣上大多数是椭圆形状的褐色斑点。当月季黑斑病发生严重时,植株中下部的叶片几乎全部脱落,只留下顶部的几张绿叶,整个植株下部的叶片呈枯黄色[11]。
2.2月季黑斑病病原菌的形态特征
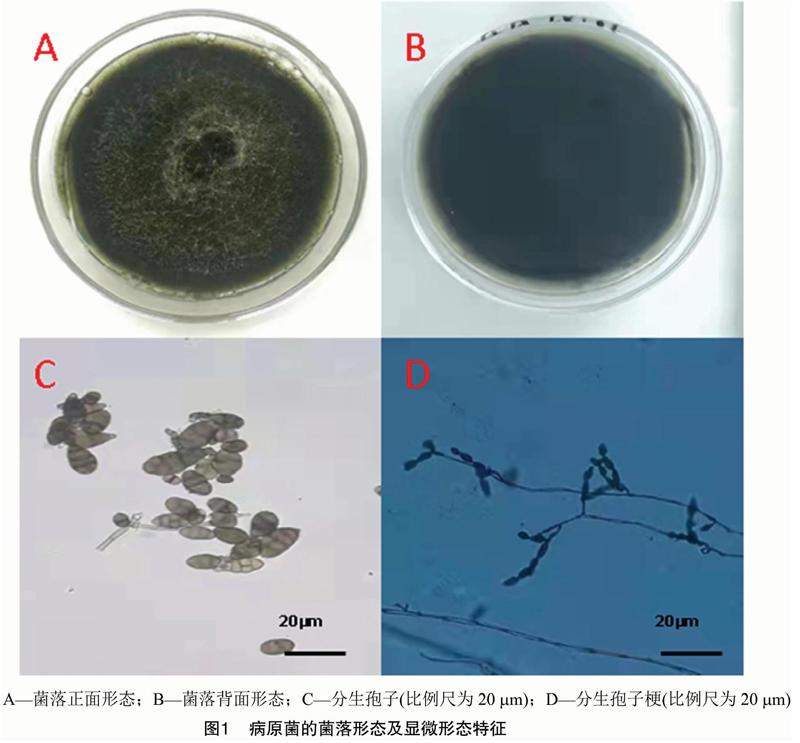
从月季黑斑病叶片病斑中分离出1株病原菌菌株,编号为SQYJAA-1,而第3次的清洗液涂布平板上无菌落生长。SQYJAA-1在PDA平板上培养2 d后可产生零星的白色菌丝,培养3 d后开始产孢,7 d后长满平板,菌落表面湿润并且不光滑,呈现黑褐色,没有轮纹(图1-A,图1-B)。显微观察表明,病原菌分生孢子梗为灰褐色,有隔膜。孢子为长卵形或倒棍棒形,横隔膜4~9个,纵隔膜2~5个,分生孢子大小为18.6 μm×24.8 μm、3.6 μm×7.1 μm(图1-C、图1-D),初步鉴定为链格孢。
2.3系统进化分析
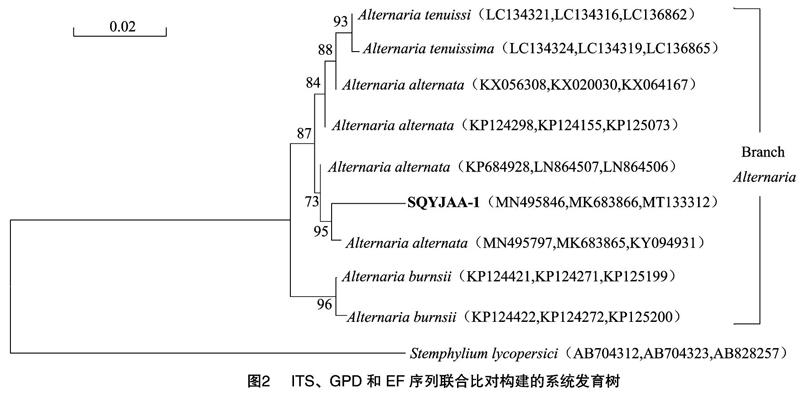
以月季黑斑病病原菌菌株SQYJAA-1的DNA为模板,以ITS1/ITS4引物、GPD1/GPD2引物和 EF1-728/EFI-986R引物对菌株DNA进行PCR扩增,再对PCR扩增产物测序,将所得的rDNA ITS序列(MN495846)、GAPDH序列(MK683866)和 EF1-α 序列(MT133312)在NCBI基因数据库中进行BLAST同源性比对,在NCBI分别下载与菌株SQYJAA-1的rDNA ITS序列、GPD序列和EF1-α序列具有同源性的序列,以番茄葡柄霉(Stemphylium lycopersici)(ITS序列AB704312,GPD序列AB704323,EF序列AB828257)为外群,利用MEGA 7.0软件构建系统发育树(图2)。结果表明,菌株SQYJAA-1(ITS序列MN495846,GPD序列MK683866,EF序列MT133312)与链格孢(ITS序列MN495797,GPD序列MK683865,EF序列KY094931)聚于一个分支。将病原菌的亲缘关系分析结果和它的形态特征、培养性状以及致病性结果结合起来对该病原菌进行鉴定,确定SQYJAA-1菌株为链格孢。
2.4月季黑斑病病原菌的致病性鉴定
采集形状、大小相近的健康月季叶片,用无菌水清洗干净,用灭过菌的竹签分别对称刺伤叶片,并将菌饼放入叶片左上方和右下方2处,观察SQYJAA-1菌株发病时间并记录。3~5 d后,接种叶片上出现了黑褐色病斑,并且叶片上产生的症状与田间月季黑斑病发病症状极其相似,发病率为100%(图3-C)。而只接PDA培养基圆片的对照组(图3-B)未发病。从患病的接种叶片组织中再次分离出真菌,观察到的菌落形态和孢子形态与接种菌株一致。由此证明河南省商丘市月季黑斑病由链格孢病原菌SQYJAA-1侵染所致。
2.5致病菌最适生长条件的测定
2.5.1温度对菌丝生长的影响从图4可以看出,
月季黑斑病病原菌SQYJAA-1在温度为20~30 ℃时都可以生长,最适宜SQYJAA-1菌丝生长的温度为28 ℃,不同温度条件下SQYJAA-1菌丝的生长差异显著。
2.5.2pH值对菌丝生长的影响从图5可以看出,月季黑斑病病原菌SQYJAA-1在pH值4.0~10.0时都可以生长,在pH值4.0~6.0时,SQYJAA-1菌丝的半径随着pH值的升高逐渐增大。最适宜SQYJAA-1菌丝生长的pH值为6.0,此时,SQYJAA-1菌生长最快,最适合菌落生长。pH值为5、6、7、8、9、10时,菌丝半径差异不显著,表明该菌SQYJAA-1的pH值适应范围很广。
2.5.3光照对菌丝生长的影响从图6可以看出,月季黑斑病病原菌SQYJAA-1在不同的光照条件下都可以生长,在24 h光照情况下生长最快,在24 h黑暗情况下次之,在12 h光照/12 h黑暗交替生長时最慢。24 h光照和24 h黑暗对SQYJAA-1菌丝的生长差异不显著,24 h 光照/12 h光照12 h黑暗交替生长对SQYJAA-1菌丝的生长差异显著,24 h 黑暗和12 h光照/12 h黑暗交替生长对SQYJAA-1菌丝的生长差异显著。
2.5.4碳源对菌丝生长的影响从图7可以看出,月季黑斑病病原菌SQYJAA-1能在6种碳源下生
长,然而菌丝在不同碳源上的生长明显不同。在无碳源对照条件下,SQYJAA-1菌丝生长最慢。在碳源为葡萄糖时SQYJAA-1菌生长最快,在乳糖、麦芽糖、蔗糖、果糖、淀粉作为碳源时,生长速率依次降低。表明不同碳源对SQYJAA-1菌丝的生长有显著影响。
2.5.5氮源对菌丝生长的影响从图8可以看出,在无氮源对照条件下,SQYJAA-1菌丝生长速率最慢。SQYJAA-1菌丝在5种氮源上均能生长,以蛋白胨为氮源时生长最快,以硝酸钠、硝酸钾、硫酸铵和硝酸铵为氮源时生长速率依次降低,并且硫酸铵和硝酸铵的生长速率相等。说明不同氮源对SQYJAA-1菌丝的生长有显著影响。
3讨论与结论
本试验对河南商丘月季黑斑病病原菌进行显微形态学鉴定、致病性鉴定、分子生物学鉴定和生物学特性分析。本试验结果表明,月季黑斑病病原菌SQYJAA-1最开始菌落颜色为灰白色,最后变为黑褐色。在健康的月季叶片上接种菌饼,3~5 d后,叶片上出现了黑褐色病斑,并且叶片上产生的症状与田间月季黑斑病发病症状极其相似。系统进化分析结果表明SQYJAA-1与链格孢(ITS序列MN495797,GPD序列MK683865,EF序列KY094931)聚于1个分支,由此确定河南省商丘市月季黑斑病病原菌SQYJAA-1为链格孢。最适宜SQYJAA-1菌丝生长的温度、pH值、光照条件、碳源、氮源为28 ℃、6.0、24 h光照、葡萄糖、蛋白胨。冯宝珍等报道,月季黑斑病在初期时菌落为灰白色,后渐变为暗色至黑褐色,其分生孢子为黑褐色,呈倒梨形、卵形或倒棍棒形[5]。而刘宝军报道的月季黑斑病的大部分致病菌为蔷薇盘二孢,有分生孢子盘,位于角质层下,形状为圆形至不规则形,颜色为黑色,分隔处略缢缩[12]。
链格孢真菌在自然界中的很多地方都有存在,主要分布在土壤、空气和农作物残体中,主要通过腐生、内生和致病这3种形式存在。链格孢真菌种类多种多样,是世界上分布最广的半知菌类真菌之一。该真菌95%以上的种类兼性寄生于植物上,能够使多种植物产生病害,如花椒穗枯病[13]、麦的黑胚病和菊花的黑斑病[14]、梨树黑斑病[15]、三七黑斑病[16],给大田生产带来了巨大的经济损失。链格孢菌侵染月季,在月季叶片上产生黑斑,病害严重时造成叶片脱落,植株枯死。
本试验对河南省商丘市月季黑斑病病原菌进行鉴定,对月季黑斑病病原菌的生物学特性进行研究,试验结果有利于植物病害的检疫,有利于月季更好地生长,在今后的相关研究中可以有效筛选月季抗病性品种,为有效预防月季黑斑病提供有力的技术支撑。
参考文献:
[1]中国花卉协会月季分会.中国月季发展报告:第2版[J]. 农业科技与信息(现代园林),2014,11(5):44-47.
[2]孙海楠,吕运舟,汪有良. 基于不同提取方法的月季香氣成分比较分析[J]. 江苏农业学报,2020,36(5):1342-1344.
[3]韩云艳.浅析月季主要病害的诊断与综合防治技术[J]. 种子科技,2019,37(10):104-105.
[4]金一锋,郭广兵,杨清淼,等. 月季黑斑病病原鉴定与抗性鉴定方法研究[J]. 北方园艺,2013(18):114-117.
[5]冯宝珍,李培谦.月季黑斑病病原菌鉴定及室内药剂初步筛选[J]. 植物保护学报,2019,46(5):1147-1154.
[6]Abbas M F,Khan A,Rafique K,et al. First report of Alternaria black spot of rose caused by Alternaria alternata in Pakistan[J]. Plant Disease,2017,101(9):1676.
[7]徐玲玲,陶贵荣,姚武伟,等. 月季内生真菌分离及抗黑斑病活性菌株的筛选[J]. 安徽农业科学,2013,41(15):6699-6701.
[8]方中达.植病研究方法[M]. 3版.北京:中国农业出版社,1998:110-155.
[9]张强. 罗非鱼片真空微冻保鲜工艺的研究[D]. 海口:海南大学,2011:23.
[10]何靖柳,秦文,刘晓燕,等. 红阳猕猴桃中葡萄座腔菌的生物学特性及致病性研究[J]. 食品与机械,2017,33(12):115-119,124.
[11]张鑫,冒浩宇,李禹,等. 月季黑斑病病原鉴定及室内药剂筛选[J]. 中国园艺文摘,2015,31(9):46-48,70.
[12]刘宝军. 月季黑斑病菌蔷薇盘二孢(Marssonina rosae)形态多样性、致病性多样性和遗传多样性研究[D]. 泰安:山东农业大学,2009.
[13]刘峰,杨文香,张娜,等. 花椒枯穗病病原鉴定[J]. 植物病理学报,2013,43(3):310-313.
[14]许高娟,陈发棣. 菊花黑斑病菌的分离鉴定[J]. 江苏农业学报,2009,25(4):752-757.
[15]杨晓平,胡红菊,王友平,等. 梨黑斑病病原菌的生物学特性及其致病性观察[J]. 华中农业大学学报,2009,28(6):680-684.
[16]何迟,王慧玲,金鑫,等. 云南、广西三七黑斑病病原链格孢菌的鉴定[J]. 植物病理学报,2020,50(2):246-250.
基金项目:河南省高等学校青年骨干教师培养资助项目(编号:2018GGJS191)。
作者简介:娄喜艳(1984—),女,河南商丘人,硕士,副教授,主要从事植物生理学教学与研究工作。 E-mail:lounan2005@163.com。
通信作者:裴冬丽,博士,教授,主要从事植物分子遗传学研究。E-mail:peidongli@126.com。

