单细胞测序技术及其在毛囊发育中的应用
叶娜 张晓兰 包鹏甲 王兴东 阎萍 潘和平
(1. 西北民族大学生命科学与工程学院,兰州 730030;2. 中国农业科学院兰州畜牧与兽药研究所 甘肃省牦牛繁育工程重点实验室,兰州 730050)
皮肤是哺乳动物中最大、最复杂的器官之一,主要由表皮及其附属器官构成[1]。小鼠表皮主要由不同生理功能的两个部分组成,滤泡间上皮(interfollicular epithelium,IFE)和毛囊(hair follicle,HF),还包括皮脂腺(sebaceous gland,SG)[2]。滤泡间上皮细胞是构成上皮细胞和扁平复层上皮的主要成分,在保护皮肤屏障功能方面起着关键作用[3]。毛囊的形成是表皮上皮和间质真皮及其特殊衍生物真皮浓缩物(dermal concentrate,DC)、真皮乳头(dermal papilla,DP)等相互作用并进行信号传递的结果。成熟的HF结构复杂,主要由毛干和内根鞘上皮细胞组成的同心环、隆起部储备的干细胞以及毛球底部的基质细胞等构成[4-6]。胚胎期HF的形态发生经历诱导期、器官发生和细胞分化3个时期。出生后HF的生长会发生动态变化,并以周期性的方式持续下去。毛发生长周期可分为3个阶段:休止期、生长期和退行期[7-10],每个阶段都受到特定遗传模式的调节[11]。在毛发的生长阶段,DP起着信号指导的作用[12-14],促使转运扩大祖细胞增殖、向上迁移并分化为几层轴鞘和内根鞘细胞系[14-15]。目前HF的复杂性还未得到充分的揭示,在HF周期性生长分子调控机制的研究中,多以多种类型组织(真皮、表皮、HF)等混合的皮肤做为起始样本,没有从中分离出匀质性单细胞,这使得细胞之间相互作用的生物差异有可能被平均值所掩盖或是被误认做为技术噪音。或仅对HF自身进行了研究,而忽略了HF组织周围真皮、表皮与HF互作对周期性生长的影响。但随着技术的更新,HF的研究更上一个层次。有报道利用scRNA-seq对HF形态发生过程中的调控机制进行研究[16-18]。亦有对小鼠成熟HF不同发育阶段的空间调控机制的研究[19-20]。但HF发育调控机制上还有许多问题没有解决,有待进一步的研究。
由于技术限制,传统的转录组测序只能测得细胞群体中多数基因表达水平的“平均数据”,主要反映优势细胞亚群的生物学信息,而小细胞亚群的作用往往被忽视,从而可能掩盖了这部分细胞所携带的重要信息[21]。随着高通量测序技术的发展,大规模测序平台使大量DNA和RNA分子同时测序成为可能,这为各个领域的研究人员同时研究生物体的遗传信息和转录信息提供很大帮助。因此,利用全基因组、转录组和表观遗传修饰的数据进行更深入的分析,对全面揭示基因表达调控的异质性更为必要[22]。理解器官的发育和功能需要对其成分加以了解,即组成器官或组织的不同细胞类型。剖析器官的细胞组成类型或探索同一类型细胞间转录组异质性的理想方法是对样本中随机抽取的单个细胞进行单独的分析。单细胞水平的分析方法包括RNA原位杂交,蛋白质免疫染色,或荧光嵌合蛋白,都是基于细胞特异性表达的表面标记物或荧光报告蛋白进行,这些方法只能监测每个试验中的少数基因。单细胞转录组测序技术是一种能够获得细胞中所有mRNA的单细胞水平的分析方法,它可对单个细胞进行无偏、高通量以及高分辨率的转录组测序分析。2009年,北京大学的汤富酬教授在Nature Methods上首次报道了单细胞转录组测序的研究,从此掀开了单细胞测序技术的篇章[23]。scRNA-seq是通过二代测序技术(next generation sequencing)来识别单个细胞的转录组表达信息,分析细胞间遗传和基因表达水平的差异,同时解决用组织样本测序无法解决的细胞异质性难题,从而更好地了解单个细胞在微环境中的功能[24],并可以揭示复杂和稀有的细胞群体以及基因之间的调节关系,跟踪不同细胞谱系在发育过程中的轨迹,揭示单个细胞的独特性,进而解决批量分析中无法解决的问题[25-26]。目前,scRNA-seq已被应用于鉴别健康组织的细胞类型[27]、发现新的细胞类型[28-30]、探索发育生物学过程的动力学[31-32]、识别基因调控机制[33],以及描述肿瘤的异质性等[34-35]。本文就单细胞技术的发展、分离技术及其在HF发育调控研究中的应用展开叙述,以期为揭示HF发育的分子调控机制研究提供理论参考。
1 scRNA-seq的发展历程
scRNA-seq始于单细胞qPCR的发展,跟单分子FISH一样,都是对转录物靶向分析的一种方法[36]。2009年,汤富酬首次报道单细胞测序的研究,但是该方法只适用于少数珍贵细胞基因表达的深度测序[23],2011年,Islam等[37]研发了一种基于单细胞标记逆转录测序方法,即单细胞标记逆转录测序(single-cell tagged reverse transcription sequencing,STRT-seq),它是利用5′tag计数转录本的单细胞方法之一,在microfluidigm C1平台(STRT-C1)上进行的STRT-seq是一种灵活的scRNA-seq方法,可在单细胞水平上对转录本进行准确、敏感和重要的分子计数[38]。随后,Hashimshony等[39]又研发出CEL-seq(cell expression by linear amplification and sequencing),该方法克服了RNA在细胞中由于起始量小的局限,通过给样本汇集条形码来满足IVT(in vitro transcription)线性扩增对材料的要求,从而允许从单个细胞中高效线性扩增RNA,同时通过测序对其进行分析。扩增后DNA的两端深度测序能够准确检测两条链的序列,该方法比基于PCR的扩增方法具有更高的重复性、敏感性,CEL-Seq支持转录组量化,将有助于不同细胞类型群体的复杂组织的转录组分析。这种方法的缺点是具有强烈的3′端偏好。2013年,Picelli[40]引入了Smart-seq2,该方法可以完整覆盖转录本的全长,实现了转录本异构体和SNV检测,同时改进了逆转录、模板转换和前置扩增等功能,以增加单个细胞生成的cDNA文库的产量和长度。与Smart-seq[41]转录组库相比,Smartseq2转录组库在检测、覆盖率、偏倚和准确性方面都有所提高,并且使用现成的试剂生成,成本更低,但其只能对具有poly(A)尾巴的mRNA进行扩增和检测。2014年,Jaitin[27]研发的MARS-seq(massively parallel single cell RNA-seq)问世,它是一种自动化的大规模单细胞RNA测序方法,用于分析数千个单个细胞的体内转录状态。2015年,哈佛大学的两个团队开发出 inDrop[42]和 Drop-seq[43]两种单细胞测序技术,两种方法都是基于高通量液滴微流控装置,将数千个细胞分离成纳米大小的液滴,然后不同的条形码再与每个细胞的RNA联系起来并通过二代测序进行后续分析。2017年,商业化的10×Genomics Chromium出现,该项技术由10×Genomics公司和Fred Hutchinson癌症研究中心共同研发,它可实现大量细胞的快速标记、测序与分析,并获得单细胞水平的基因表达谱和差异情况,通过对复杂的细胞群体进行的细致分析,绘制大规模单细胞表达图谱[44]。2017年,浙大教授开发了microwell-seq,一个使用简单、廉价设备的高通量、低成本的scRNA-seq平台,利用该平台,该团队首次绘制出哺乳动物的细胞图谱,还构建了一个基于单细胞数字表达精确定义细胞类型的“单细胞MCA(ScMCA)”工具[45]。同年还有一种基于微孔阵列的Seq-Well技术,这是一个简单、便携、低成本的大规模并行的scRNA-seq平台,它将单个细胞和条形码mRNA捕获珠密封在微孔阵列板中,从而实现高效的细胞裂解和转录本捕获[46]。另外还有一种基于组合标记的SPLiT-seq[47],该技术成本低廉,能够在一次试验中对成千上万个固定的细胞或细胞核进行转录分析且不需要将单个细胞划分为单独的隔间(液滴、微孔),而是依赖于细胞本身作为隔间。测序的整个工作流程只包括移液步骤,不需要复杂的仪器。
2 单细胞制备
2.1 单细胞悬液准备
单细胞分离是单细胞测序最关键的步骤,为了在下游分析过程中保持细胞的存活力,寻找温和有效的单细胞分离方法非常必要。单细胞测序前需将组织解离为单细胞悬液,其分离方法多样,一般用酶消化法,对于结构较复杂的组织多采用机械和酶组合的方式解离,比如毛囊单细胞的解离,对皮肤组织进行清洗消毒后,剪成0.5 cm×0.2 cm的小长条用dispase酶消化2 h,在体式显微镜下拔出单根毛囊置于培养皿中,再添加0.25%胰蛋白酶消化0.5 h后经反复吹打、过滤、离心制备成单细胞悬液。之后再通过清洗、稀释、利用微流控或者是FACS对细胞进行捕获。为减少细胞聚团,在酶消化过程中可加入DnaseⅠ消化核酸而不损伤完整的细胞。
在细胞捕获前,原代解离的细胞悬液会存在一定的杂质、较大的细胞碎片或者团块,一般采用孔径大于最大细胞直径的细胞筛过滤,过滤两次,较小的杂质可采用离心清洗来去除,离心过程中要使细胞汇集不能太紧实,而且上清液中的细胞要尽可能少,一般使用300×g,离心5 min[48],由重力差细胞汇集到底部,杂质会漂浮在上清液中,弃上清后用含0.04%牛血清蛋白无钙镁离子的磷酸盐缓冲液(PBS)进行重悬,为尽量减少剪切力对细胞的损伤,一般采用宽移液管对细胞进行重悬。细胞悬液制备好后,防止细胞放置时间长导致活率降低应尽快完成后续试验。
2.2 单细胞的分离技术
近年来,众多研究者对单细胞分离的方法进行持续的探究和改进,常用的单细胞分离技术有:有限稀释法、荧光激活细胞分选、显微操作技术、微流控技术和激光捕获显微切割技术(图1)。
2.2.1 有限稀释法 有限稀释法(limiting dilution)多用于不同组织的干细胞或前体细胞的体外克隆分析,该方法将细胞悬液经过一系列不同梯度稀释,直至获取单个细胞(图1-a),凭借梯度稀释计算,不能直观的分选单细胞,这种方法对设备和操作的要求较小,操作简单,成本低廉,但分离单细胞的成功率不高,对梯度稀释的计算依赖性强,容易出现分离误差或细胞丢失,耗时长,通量低,不能准确地过滤靶细胞[49-51]。
2.2.2 显微操作法 显微操作法(micromanipulation)主要在目标细胞稀少的情况下应用,利用显微操作仪联合显微镜观察,操作者选择一个特定的细胞,近距离移动口吸管,并通过对口吸管施加吸力来对单个细胞进行挑选,挑选出来再对其进行更深一步的研究(图1-b)。显微操作主要用于培养细胞系或者是从早期胚胎中分离单个细胞。这种方法对细胞的活性和状态影响较小,成本低,但容易造成RNA降解、通量低、投入人力较多,不利于规模化应用[52-53]。
2.2.3 荧光激活细胞分选技术 流式细胞术是一种通过单种或多种激光对PBS中的单个细胞或者离子快速分析的技术[54](图1-c)。流式细胞仪的荧光激活分选系统通过激光激发,被荧光抗体标记物标记的细胞经过特定的激光束,再根据不同细胞接收的激光信号的偏转情况捕获单个细胞,该过程细胞悬浮液是通过流动细胞的压力驱动的,细胞流迅速通过激光束被光激发,下游使用光学检测器来捕获细胞特定的信号而达到分选的目的。虽然实验过程复杂,但是实验技术已经成熟,且有统一的标准可供参考。该技术的准确度和通量都很高,能快速检测细胞的物理和化学参数;但是对悬浮细胞的数量要求较大(>10 000),不适用于低丰度的细胞以及没有表面标记抗体和未知的细胞的分选。
2.2.4 激光捕获显微切割技术 激光显微切割技术(laser capture microdissection)是单细胞水平上对固体组织分析的有力工具,多用于从固定组织样本中分离单个细胞[55](图1-d)。基本原理是在显微镜下使用UV(320-400 nm)激光选择性地从冰冻或石蜡包埋组织切片热塑膜的涂片上准确的切割单细胞,但是该技术成本高、通量低、精度有限。细胞核很容易被切割掉,导致一些染色体片段在操作过程中丢失,切割过程中可能涉及原生质体成份或相邻细胞受损的细胞核,且分离过程中原始的RNA极容易降解,没有全长分子用于反转录,RNA失去了它的完整性从而导致细胞群体出现偏差[56-57]。最近一项名为Smart-3SEQ[58]的新技术避免了该情况的出现,它结合了SMART[41]方法中的模板切换和Smartseq2[40]的优化步骤采用 3SEQ[59]的 3′端表达定位法而产生一个非常简单的程序。在3SEQ中,RNA在反转录之前被碎裂,这样便消除了完整样品和降解样品之间的差异。反转录仍然是由锚定寡核苷酸(dT)引物启动的,在每个转录物中,只有含poly(A)尾部起始的片段被测序。Smart-3SEQ与石蜡切片组织的相容性打开了大量存档的临床样本,与LCM相结合,它允许对小细胞群体和原位分离的单个细胞进行前所未有的研究[58]。
2.2.5 微流控技术 近年来,基于液滴技术的微流控或者芯片设备被开发出来用于单细胞的分离与分析[60-61](图1-e)。随着微流控装置的引入,迅速使其成为分离细胞的首选技术,相对于先前使用方法,它需要的试剂体积更小。在微流控器件中,流体动力通量使得细胞在几十到几百微米的通道中被分离和处理,此外,微流控设备还可以自动处理一些下游的RNA反应,并允许测量和控制细胞外试剂浓度[62]。微流控技术(microfluidics)的基本原理是微液滴技术通常利用油相来剪切水相,形成表面活性剂稳定的水液滴,两种不混溶的流体在T型管中汇合时,来自水相的单细胞被包裹在液滴中,形成油包水的状态[63]。该技术不仅可以在短时间内产生大量的油包水液滴,而且可以提供独立的分离室进行单细胞分析,防止交叉污染。虽然基于液滴的单细胞分离取得了巨大的进展,但要保证油包水中不超过一个细胞的封装仍然是一个挑战。传统的方法是根据泊松分布使用有限的稀释,这将导致单细胞的占用率低,且会出现大量的空液滴。为了最大限度地提高单细胞液滴的比例,可以在乳化前通过惯性聚焦均匀间隔单细胞,将单细胞占用效率提高到80%[63]。综上所述,基于液滴的技术具有成本低、通量高、制作简单、规模大、速度快等优点,但仍存在着单细胞含液滴率低、实时监控不便的问题。
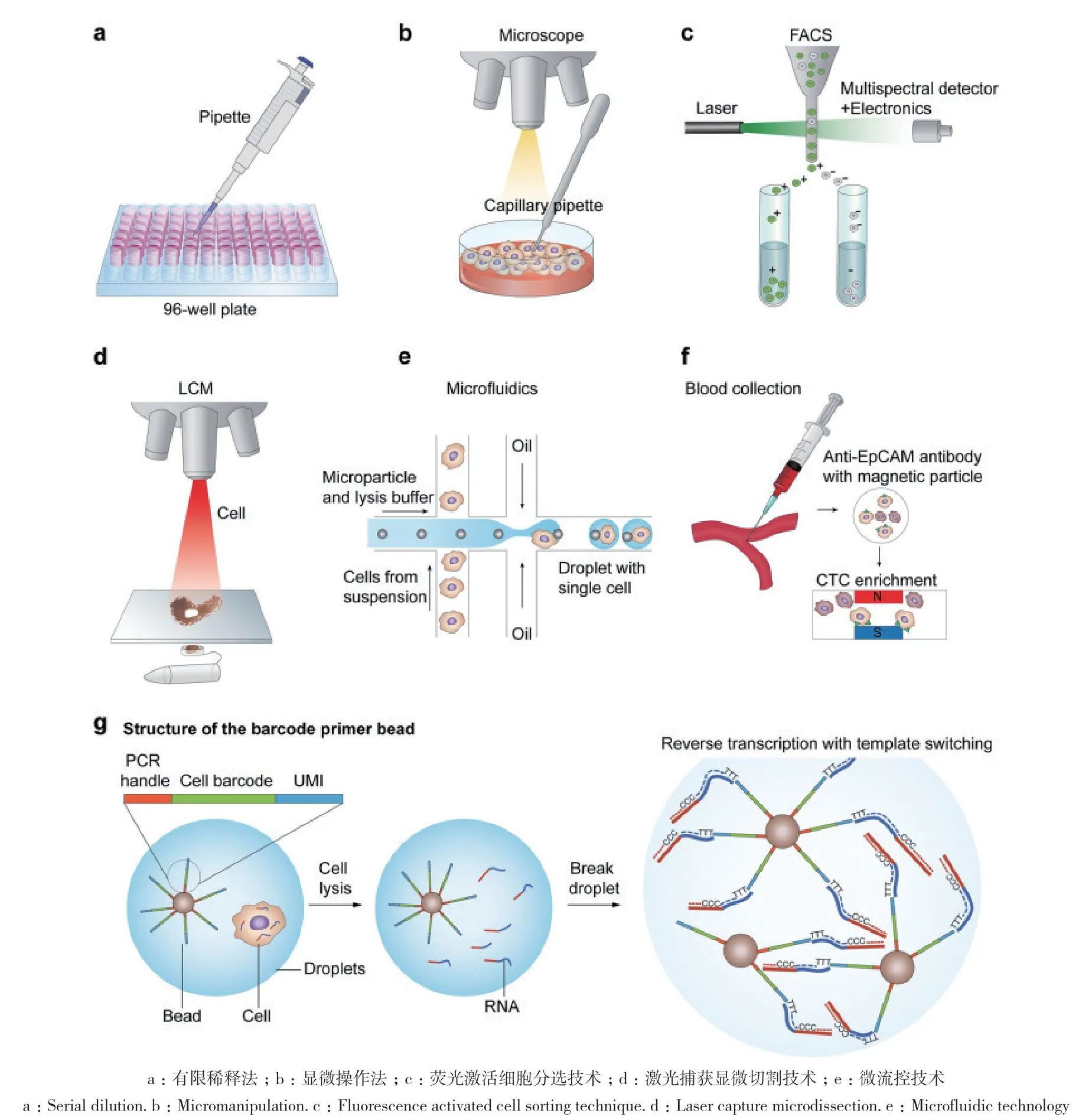
图1 常用的单细胞分离技术部分引自[26]Fig. 1 Commonly used single cell isolation techniques Part cited from [26]
3 scRNA-seq不同测序方法比较
scRNA- seq方法可分为3个步骤进行:(1)反转录;(2)cDNA扩增;(3)测序文库构建。反转录非常关键,scRNA-seq的效果很大程度上取决于这一步的效率。反转录过程中,约有10%-20%转录本被成功的反转录为cDNA[64],这就导致一些低表达量的基因无法被检测到,从而引入较高的技术偏差,也即技术噪音(technical noise)。单细胞测序中,常以尽量减少操作和利用单管反应来避免部分RNA损失,再用反转录法合成cDNA。除了基于引物设计的RNA测序DP-Seq[65],为了防止捕获核糖体RNA或转移RNA占比较高的细胞RNA,一般使用poly(T)启动来执行反转录,使用这个方法,非多聚腺苷酸化编码蛋白质的RNA不会被捕获[66]。后来开发的SUPeR-seq弥补了这一缺陷,它被用于对单个细胞中的多聚嘌呤化和非多聚腺苷化RNA进行测序[67]。该方法使用具有固定锚定序列的随机引物(AnchorX-T15N6)代替常用的寡核苷酸(DT)进行cDNA的合成。SUPeR-seq能检测到单个细胞的多聚腺苷酸和非多聚腺苷酸RNA,且基因组DNA和rRNAs的污染可忽略不计[67]。但是该方法还没有与除了Tang 2009以外的其他较广泛使用的方法相比较。据后来报道称MATQ-seq比Smart-seq2更为敏感和准确[68]。MATQ-seq提供了完整的基因覆盖和允许检测总共RNA,这是一个很大的改进,这种改进是基于MALBAC(多重退火和循环扩增循环)引物的使用。这些MALBAC引物包含27个常用序列,其后是5个随机核苷酸,它们仅在3′端不同,分别为T20或G3/A3/T3,这样大大提高了反转录和PCR扩增的效率。
反转录后,可以采用不同的方法合成第二链,一是SMART技术采用转录酶和M-MLV转录酶(小鼠白血病病毒逆转录酶)的一链转换活性将模板转换寡核苷酸作为下游PCR扩增的接头[69]。SC3-seq[70]、STRT-seq[71]、Smart-Seq2[40]三个平台都是使用PCR的方法进行扩增,PCR虽然是一种快速和广泛使用的方法,但其缺点是会导致指数扩增,使得高表达的转录物最终在文库中被过度表达[72]。此外,由于对不同转录种的扩增效率不同,PCR扩增会造成定量偏差,导致原始转录物丰度信息的丢失和非特异性转录片段的积累。为了避免这一情况的出现,CEL-seq2[73]和 MARS-Seq[27]利用 IVT 线性扩增来合成cDNA,通过在polyd(T)引物中加入T7启动子,在第二链合成后进行IVT。互补RNAs要么被碎片化与3′端接头连接,要么用随机引物进行另一轮反转录以提高敏感性(CEL-seq2)。与PCR相比,IVT优势在于线性扩增,即使实验中对低表达转录物的敏感性很低,它也不会以指数的形式消耗难以处理的序列。IVT比PCR工作强度更大,因为它需要对扩增的RNA进行额外的一轮的反转录,这通常会导致提前终止和富集3′端RNA片段的积累(强烈的3′端偏好性),从而无法检测到样本完整的转录组信息[74-75]。以上涉及的单细胞测序技术均列表比较(表1)。
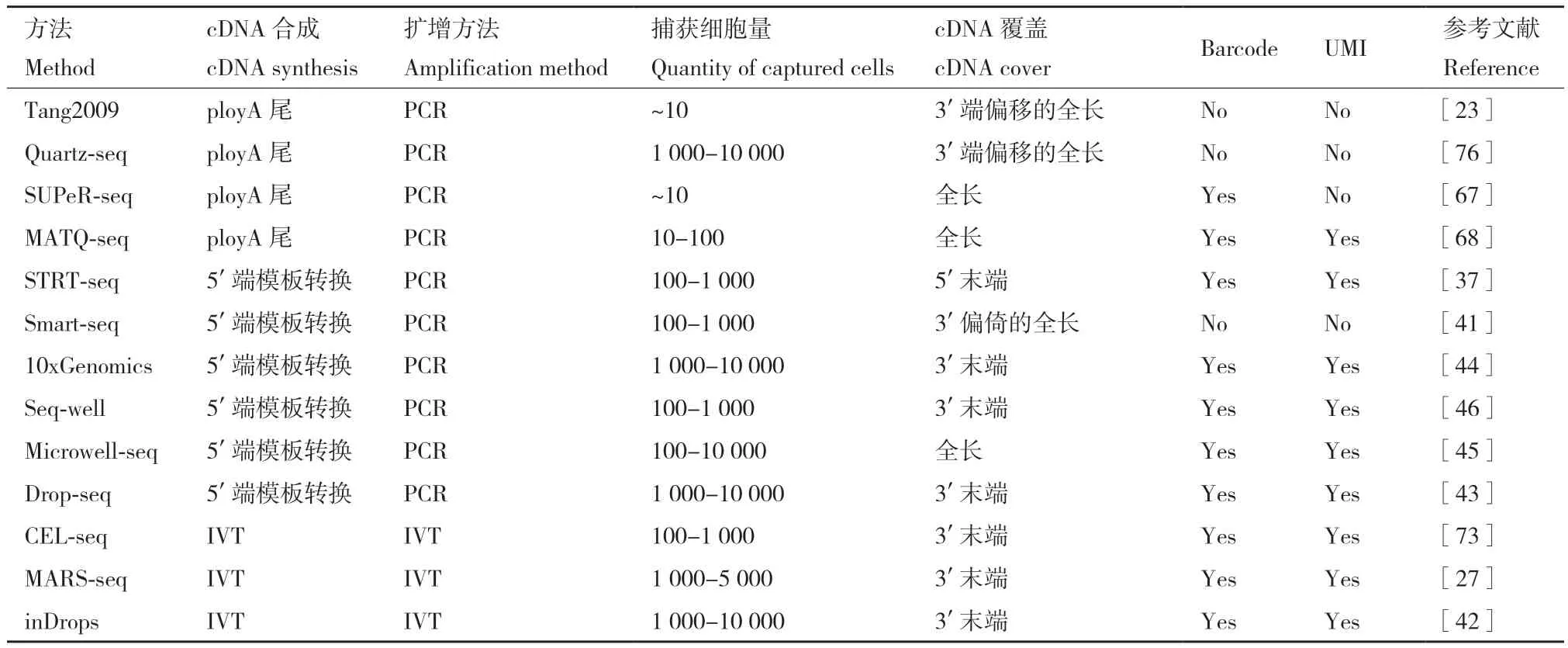
表1 单细胞测序技术汇总Table 1 Summary of single cell sequencing techniques
目前,大多数测序都是使用NextEra试剂盒进行文库构建,Illumina平台进行测序,然而,扩增后得到的cDNA文库与所有平台都兼容,比如:SC3-seq被设计使用SOLiD系统进行测序[70]。最近使用唯一分子标识符(UMIs)来改善scRNA-seq建库,它在反转录过程中对细胞内的每个单独的mRNA分子标记上条形码。从PCR复制标签产生的排序读数将具有相同的随机条形码序列。因此,如果考虑到实验的初始RNA捕获率(或效率),则给定细胞裂解物中转录本的拷贝数等于与映射到转录本的所有标签相关联的UMI的数量。使用UMIs时的一个重要考虑因素是,为了实现转录本丰度的准确量化,需要进行饱和测序。到目前为止,最广泛使用的方法是在反应细胞裂解物中加入外部mRNA,这提供了关于分子输入数量和观察到的测序读数之间的关系的信息。
4 scRNA-seq在HF发育研究中的应用
scRNA-seq对揭示组织、器官以及胚胎的发育过程的异质性具有很好的优势,HF的发育是一个非常复杂的过程,如果能够通过高通量测序技术识别HF形态发生和周期性生长阶段不同细胞亚群的基因表达谱,从基因表达调控的整体特征上研究HF形态发生和周期性生长阶段的分子机制,筛选特异调控HF形态发生和周期性生长阶段的调控元件或功能基因,从而揭示参与HF发育整个过程的细胞群体的异质性,将对畜禽品种的培育以及治疗人类毛发疾病具有很好的理论指导。利用scRNA-seq对HF的研究最早在2016年,Joost等[19]利用scRNA-seq对成年小鼠HF进行测序,通过对休止期HF的1 422个单细胞进行了转录组学分析,聚类到25类不同转录水平的细胞亚群,解释了表皮的转录异质性是由表皮分化和HF近-远轴相关的基因表达模式的相互作用形成的,并揭示了形成表皮和HF的分化轨迹和空间特征。后来又运用scRNA-seq和单分子RNA荧光原位杂交(FISH)对小鼠生长期和休止期HF的分子解剖学进行研究,并得到56个表皮细胞和基质细胞群的基因表达谱和空间位置,并揭示了协调毛发生长的细胞类型和状态的分子机制、潜在的祖细胞谱系分化、成纤维细胞的异质性和上皮-基质细胞的相互作用的细胞类型和状态[20]。还有研究运用scRNA-seq对绒山羊胚胎期HF形态发生过程进行测序,鉴定到胚胎期HF形态发生过程中的主要细胞类型以及相关细胞的标记基因,构建了绒山羊真皮以及表皮细胞谱系在HF形态发生中的分化轨迹[77]。
4.1 发现新的细胞亚群
单细胞质控完成后,相同类型的细胞一般具有相似的表达谱。因此可以通过表达相似性对细胞进行聚类,从而将各细胞类型的细胞分离成独特的细胞群。小鼠休止期HF单细胞测序研究人员[19]对其进行两个水平的聚类,一水平的聚类分为外凸(outer bulge)、内凸(inner bulge)、毛囊上部(upper HF)、上皮基部(basal IFE)四大类,第二水平将这4类再进行亚聚类,经再次聚类upper HF分为7个亚群,其中5个是已知的(uHF III-VII),发现两个新的细胞群(uHF I and uHF I)[19]。新的亚群位于皮脂腺开口的周围,通过Rbp1表达以及Defb6和Cst6高表达来区分。接着研究人员又利用单细胞RNA测序和单分子RNA FISH来对小鼠生长期和休止期皮肤进行了研究,作者鉴定出毛囊外根鞘(ORS)部分,并定义了3个细胞群。分别为Msx2 progency cluster(Msx2+)、Suprabasal outer layers cluster1(sbOL)、basal outer layers cluster2(bOL),其中后面两个细胞群之前未报道过,在UMAP上,bOL和sbOL簇之间的表观距离表明,这两个细胞群体在成熟的生长期HF中是不通过中间状态连接的。后面根据未剪接和剪接的mRNA的表达模式(RNA速率)来验证了这两类细胞身份的动态[78],并发现bOL和sbOL在生长后期是不同的细胞群,因为RNA速率中并未发现两个细胞簇之间有任何过渡迹象。这些新的发现揭示了ORS和内部HF层如何协调头发的产生。
4.2 发现新的标记基因
由于技术的更新,发现很多保守的标记基因已经不仅仅在特定组织中特异性表达,而是在不同类型的细胞中也能监测到。在2015年,Sennett等[79]利用免疫荧光对不同类型的早期胚胎HF细胞进行了标记,通过流式分选,得到8个不同类型细胞群,经RNA-seq测序建立了整个胚胎皮肤不同类型细胞的基因表达谱,并发现了许多标记基因。这是首次对HF形态发生过程中不同类型细胞的特异性分子进行描述。流式分选对表面抗原标记基因的保守性要求很严格,只有分选到高纯度的目的细胞群才能反映其特异的基因表达谱。在当时还没发现某些细胞群体在分化过程中会经历不同的阶段,因此这样得到的特异性分子保守性并不高。
后来,该团队带着DC特化的时间过程与祖细胞和信号传递之间的关系等问题进一步利用实时成像、流式分选、scRNA-seq和RNA-seq等方法根据特化过程中基因的动态变化和细胞在发育中的拟时序命运的分子时间推移,定义了从Fb到DC前体的细胞命运轨迹。DC特化过程总共经历了fibroblast、pre-DC、DC1以及DC2四个阶段,但是在前面的研究中中间的分化阶段是不存在的,技术的发展借助于单细胞测序,使得细胞之间的异质性得以展现,且还发现了新的标记基因,pre-DC阶段的标记基因有Smad3、Lef1和Twist2;DC1阶段特异性表达Foxd1、Prdm1、Sox18和Trps1;DC2阶段特异性表达 Glis2、Foxp1、Alx4、Hey1 以及 Hes5[18,77]。葛伟[77]在研究绒山羊胚胎期HF形态发生过程中决定表皮与真皮细胞命运的基因表达转录谱中发现绒山羊与小鼠的DC细胞特化过程的基因表达谱与分化阶段是一致的,都依次经历fibroblast、pre-DC、DC1以及 DC2 四个阶段[18]。
scRNA-seq在IFE和HF的亚型分类研究中具有较高的分辨率,可以区分基底和漏斗处干细胞群的静止和中间细胞状态[80]。毛囊干细胞(hair follicle stem cells,HFSCs)位于HF永久部分的下部的隆起区[5-6],在哺乳动物的毛发周期中参与自我更新、迁移和分化。近期,研究者采用单细胞测序阐述HFSCs在生长中期自我更新的异质性研究中,在主要类群中发现了一个由增殖细胞组成的亚群(Proli)不与任何凸起(Bu)或ORS种群聚集,并通过基因富集分析(GSEA)鉴定到新的标记基因,分别为 Bu新标记基因 Dmkn1、Crip1、Sostdc1、Ptn和Calml3;外根鞘上基底层(upORS-BL)新标记基因Gnmt、Abi3bp、Edn2、Angptl4和Igfbp4;外根鞘下基底层(lowORS-BL)新标记基因Tagln、Slc39a10、Acta2、Igfbp7和Rasl11a;外根鞘上基部(ORS-SB)新标记基因 Pthlh、Ctsc、Mgst1、Wfdc18、Cldn[81]。这些标记基因在未来可作为细胞消融、谱系追踪和基因靶向研究的有力工具。
4.3 揭示HF发育过程的分化轨迹
单细胞基因表达研究使人们能够对复杂的生物过程和高度异质性的细胞群体中涉及的转录调控进行进一步的认知。HF的形态发生是一个连续的过程,在发育过程中经历了许多的中间分化状态,而这些中间分化状态最好的展现就是分化轨迹图,分化轨迹的出现有利于发现某些细胞亚群在阶段分化过程中的特异性表达基因。在对细胞的异质性以及基因表达谱描述之后,利用细胞谱系关系构建分化轨迹图,细胞间的变化轨迹图能清晰的反应细胞随着时间的变化过程,例如:在绒山羊胚胎期HF不同发育阶段分化过程的细胞轨迹图中表现出真皮谱系分化主要涉及DP和DC细胞的特化过程,而表皮细胞谱系分化主要涉及角化细胞、毛干细胞以及上皮细胞的特化过程[77]。细胞谱系关系在分化轨迹上呈现之后,就可以分析参与阶段性分化过程的关键基因的表达趋势,进而挖掘到新的标记基因。这样也可以使我们对HF发育过程中细胞之间关系了解得更加透彻。
4.4 揭示HF发育过程中的关键调控因子
HF发育的谱系分化过程经分化轨迹图展示以后,将进一步探索整个命运获取过程中的基因表达谱和参与转录调控的关键转录因子。上述的研究通过scRNA-seq分析建立从Fb到DC2的分化轨迹的伪时间排序后,单细胞拟时序分析发现在pre-DC命运获取、DC1聚类和DC2毛发胚生长下降阶段出现了3处基因上调的峰,这3处峰包含了许多的转录因子,比如在pre-DC阶段,Lef1、Twist2、Smad3等显著高表达。这表明这些因子在DC特化过程的pre-DC阶段起到了关键作用。有报道称,小鼠的Twist2基因敲除之后背部皮肤会出现毛发稀少,还伴随着其他异常情况[82],Lef1敲除则会导致胡须和背部毛囊无法形成[83],为了验证这一结果,研究人员通过FISH证实了Twist2基因只在pre-DC阶段的mRNA中表达,而在随后的DC1阶段却不表达,这一结果更加证实了这些转录因子在阶段表达中起到的重要作用。到了DC1阶段中间表达的转录因子包括 Prdm1、Trps1、Sox18、Tshz1和 Foxd1。这一点与前人相关研究报道一致,Trps1基因的突变与阿姆布拉斯综合征(一种高度变性疾病,表现为毛囊数量异常增多)高度相关[84]。Sox18在小鼠中的突变会影响真皮乳头的分化[85],另外,在DC2阶段有许多特异性高表达的转录因子,包括Hey1、Hes5、Glis2、Foxp1和Alx4。其中Foxp1是一个已知的在毛囊发育过程中维持HFSCs静止(未分化)状态的重要转录因子[86]。通过以上的研究可知,scRNA-seq对HF发育研究是一个非常有利的工具。
5 展望
近年来,scRNA-seq技术取得了很大进步,多种scRNA-seq平台相继问世。scRNA-seq的发展和创新很大程度上促进了单细胞转录组的研究,并为调控皮肤表皮和HF相关细胞的表达特异性和动态平衡提供了更大的清晰度。原位杂交联合单细胞测序的方法为我们对HF的研究带来很大的便利,通过这些方法可以让我们对研究方向有更进一步的认识,利用单细胞测序技术解析哺乳动物HF形态发生以及生长发育的调控机制,对于治疗人类毛发疾病也将有一定的借鉴意义。此外,随着细胞条形码和微流控技术的进步,scRNA-seq的通量得到显著增加。同时,对固定和冷冻样品的scRNA-seq方法最近被提出,这将极大地有利于高度异质性临床样品的研究。但是,目前可用的scRNA-seq方法仍然存在基因丢失率高的问题,这种情况下低表达的基因会在检测过程中被遗漏。近些年随着对HF单细胞由于分离技术限制性的克服,对HF单细胞水平的调控机制研究正在兴起。我们相信不久的将来随着技术的不断发展,一定会为HF发育的分子调控机制和动力学会提供更科学、深入的解析。