养殖虹鳟体内土腥味物质分布及其与水质关系的研究*
韩 萃, 魏发奕, 李 丽,2**, 董双林,2, 高勤峰,2
(1.海水养殖教育部重点实验室(中国海洋大学),山东 青岛 266003;2.青岛海洋科学与技术试点国家实验室 海洋渔业科学与食物产出过程功能实验室,山东 青岛 266237)
鲑科鱼类富含长链不饱和脂肪酸、氨基酸、维生素等多种营养物质,深受广大消费者青睐[1-3]。随着中国鲑科鱼类市场需求量逐年上升,鲑科鱼养殖产业逐渐兴起[3]。虹鳟(Oncorhynchusmykiss)、大西洋鲑(Salmosalar)和银鲑(O.kisutch)是目前中国主要养殖的鲑科鱼种类,其养殖模式以水库低温水养殖和循环水养殖为主,其中绝大部分以淡水养殖,少数以半咸水或海水养殖[4]。然而,低盐度养殖鱼类的异味问题对水产养殖业造成了巨大冲击[5-6],异味中又以土腥味最为严重。
目前认为水体中产生的土腥味物质有5种,即土臭素(Geosmin,GSM)、二甲基异茨醇(2-methylisoborneol,MIB)、2-isobutyl-3-methoxy-pyrazine(IBMP)、2-isopropyl-3-methoxy-pyrazine(IPMP)、2,3,6-trichloroanisole(TCA),其中以GSM和MIB最为常见[7-8]。水环境中GSM和MIB的含量分别达到9和4 ng·L-1,就能使水产品产生土腥味[9]。鱼肉中GSM或MIB任一含量超过0.7 μg·kg-1,这种鱼类就带有土腥味[10]。
鱼类产生土腥味的原因通常是由于水体污染,造成某些种类的浮游藻类和放线菌生长过剩,不断产生和分泌异味物质到水中[11],进而渗透到鱼体中。因此,水质是影响土腥味物质产生的关键因素。大量研究表明,盐度、温度、光照、水中磷含量、总悬浮固体含量等均能显著影响土腥味物质的产生[12-17]。另外,有研究指出土腥味物质能在脂含量丰富的组织中积累,MIB和GSM在鱼体中的分布可能因组织和规格不同而异[18-19],但目前鲜有这方面的研究。
本文比较了不同规格虹鳟和虹鳟不同组织中GSM和MIB含量,研究土腥味物质在虹鳟体内的分布规律。另外比较了虹鳟、大西洋鲑和银鲑体内的GSM和MIB含量及其养殖水体水质,分析了鱼体中GSM和MIB与水质因子的关系。以期发现土腥味物质在鲑科鱼体内的蓄积规律,筛选出影响鲑科鱼体内土腥味含量的关键水质因子。本研究将为优化鲑科鱼类养殖模式以及提升养殖鱼类品质提供一定的科学依据。
1 材料与方法
1.1 样品采集
在甘肃某养殖场采集4种规格((351.00±11.27)、(1 216.67±57.74)、(1 650.00±50.00)和(3 050.00±86.60) g)虹鳟各3尾。另外分别于2018年7月在甘肃、山东烟台和山东东营采集虹鳟、大西洋鲑和银鲑各6尾,甘肃养殖场采用天然水库网箱养殖方式,山东烟台和山东东营养殖场采用循环水系统养殖方式。投喂饲料均为鲑鳟成鱼配合饲料6.0(北京汉业科技有限公司)。采集的鱼类样本经MS-222麻醉后,测定其体长和体重,然后取其背肌、肝脏和鱼皮组织用真空袋密封(21 cm×23 cm,HandheldVac,中国),置于干冰中运回中国海洋大学养殖生态实验室后,于-80 ℃冰箱保存。
取1 L水样加入HgCl2固定,每个采样点3个重复,置于干冰中运回实验室后迅速测定水质指标。
1.2 水质及脂含量测定
养殖用水的温度(T)、溶解氧(DO)、pH和盐度值均采用YSI-6920多参数水质分析仪(Yellow Springs Instruments,USA)进行现场测定。
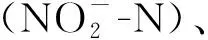
取部分背肌样品,经冷冻干燥,研磨成粉后,采用索氏抽提法测定其脂含量[21],剩余背肌样品用于测定土腥味物质。
1.3 土腥味物质分析
1.3.1 土腥味物质提取 采用微波蒸馏装置(见图1)提取鱼组织中的土腥味物质:微波加热功率为350 W,氮气流速为70 mL·min-1。氮气将气化的异味物质带出,经冷凝装置对其冷凝液化后,收集馏分。
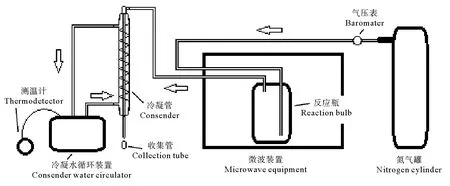
图1 微波蒸馏装置示意图
取10 mL馏分于20 mL顶空瓶(美国Agilent公司)中,再加入3 g NaCl和微型磁力搅拌子,立即用带PTFE涂层硅橡胶垫的瓶盖密封。将顶空瓶置于加热磁力搅拌台(IKA® RCT basic加热型磁力搅拌器,德国IKA公司)上,将50/30 DVB/CAR/PDMS萃取头(美国Supelco公司)插入瓶内顶空吸附,搅拌速度1 500 r·min-1,60 ℃萃取45 min。随后取出萃取头迅速插入气相色谱-质谱仪(美国Agilent公司)进样口,进行气相色谱-质谱(GC-MS)联用分析。
1.3.2 土腥味物质测定 GC-MS联用使用的色谱柱为HP-5MS毛细管柱(美国Agilent公司,30 mm×0.25 mm×0.25 μm);采用不分流进样,进样口温度250 ℃,热解析15 min;程序升温:初温40 ℃,保持2 min,以8 ℃·min-1升温至250 ℃,保持10 min;载气:He;流量:0.8 mL·min-1,不分流;质谱条件:离子源温度230 ℃,传输线温度280 ℃。数据采集:TIC(Total Ion Chromatograms,总离子流色谱图);EIC(Extract Ion Chromatograms,选择离子色谱图),GSM和2-MIB的定量特征离子质荷比m/z分别为112和95。
1.4 数据分析
数据以平均值±标准差(X±SD)表示。采用Kolmogorov-Smirnov检验和Levene检验方法分别进行数据的正态分布检验和方差齐性检验。若符合正态分布且方差齐,组间差异采用ANOVA单因素方差及Turkey多重比较法进行分析。相关性分析采用Pearson分析方法,显著水平P<0.05。所有分析均由SPSS 19.0软件实现。
2 结果
2.1 虹鳟不同组织中的土腥味物质含量差异
虹鳟不同组织中的MIB和GSM含量见图2。在肝脏、肌肉和鱼皮中,MIB含量较GSM高。MIB和GSM在肝脏中积累最多,其次是肌肉,最后是鱼皮,经差异分析得出,肝脏、肌肉和鱼皮中MIB和GSM含量存在显著差异(P<0.05)。MIB在肝脏、肌肉和鱼皮中的含量分别为(2.89±0.34)、(0.94±0.20)和(0.28±0.05) μg·kg-1。GSM在肝脏、肌肉和鱼皮中的含量分别为(1.18±0.08)、(0.63±0.08)和(0.12±0.03) μg·kg-1。
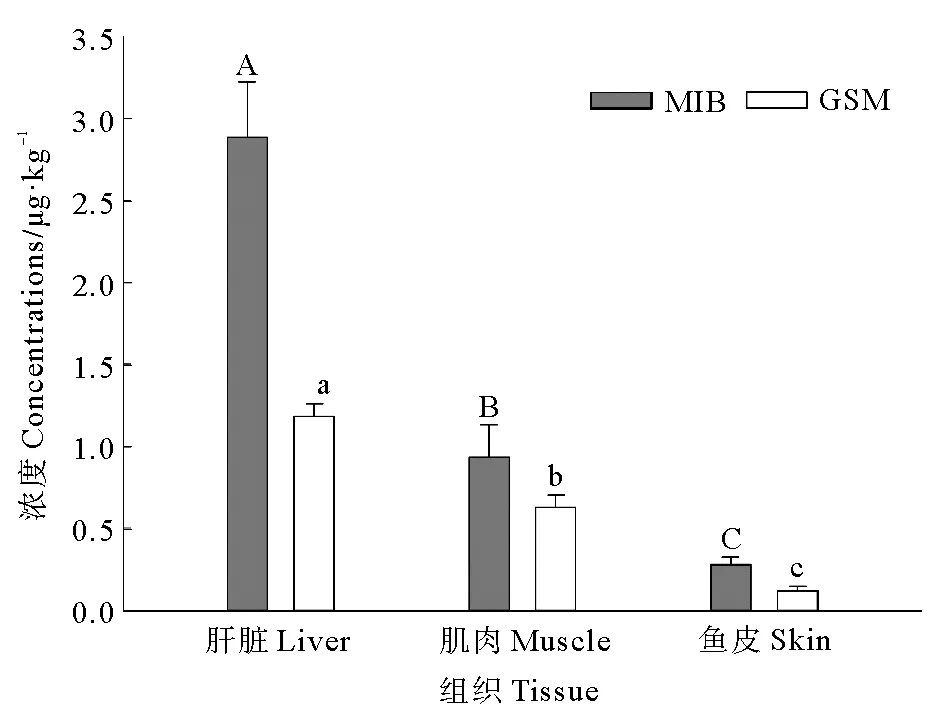
(不同大写字母表示MIB含量在虹鳟不同组织间差异显著P<0.05,不同小写字母表示GSM含量在虹鳟不同组织间差异显著P<0.05。Different capital letters indicate that the concentration of MIB varies significantly among different tissues of rainbow trout P<0.05,while different lower-case letters indicate that the concentration of GSM varies significantly among different tissues of rainbow trout P<0.05.)
2.2 不同规格虹鳟体内土腥味物质含量比较
如表1所示,不同规格的虹鳟,其体重、体长及脂含量存在显著差异(P<0.05),此外,随着虹鳟规格增大,其背肌脂含量增高。

表1 不同规格虹鳟的体重、体长及脂含量
不同规格虹鳟背肌中MIB和GSM含量如图3所示,两种物质含量均随规格增加而升高,不同规格虹鳟体内两种物质含量差异及其显著(MIB:P=0.003;GSM:P=0.002),虹鳟体内两种物质含量均是规格C和D的显著高于规格A的(P<0.05),规格B与其他规格无显著差异(P>0.05)。另外,4个规格的虹鳟背肌中均是MIB含量高于GSM含量,规格C和D的虹鳟背肌中MIB含量超过了0.7 μg·kg-1,分别达到了(0.79±0.12)和(0.94±0.20) μg·kg-1。4个规格的虹鳟背肌中GSM含量均低于0.7 μg·kg-1。

(不同大写字母表示MIB含量在不同规格虹鳟体内差异显著P<0.05,不同小写字母表示GSM含量在不同规格虹鳟体内差异显著P<0.05。Different capital letters indicate that the concentration of MIB varies significantly among different sizes of rainbow trout P<0.05,while different lower-case letters indicate that the concentration of GSM varies significantly among different sizes of rainbow trout P<0.05.)
经相关性分析发现,虹鳟背肌中的MIB和GSM含量与虹鳟体重、体长及脂含量呈显著正相关关系(P<0.05, 见表2)。虹鳟背肌中的MIB和GSM与虹鳟体重的相关系数分别为0.84和0.84,与虹鳟体长的相关系数分别为0.89和0.86,与虹鳟背肌脂含量的相关系数分别为0.80和0.76。

表2 虹鳟体内MIB和GSM含量与虹鳟体重、体长及脂含量的相关性分析
2.3 鱼体内土腥味物质含量与水质的关系
2.3.1不同种类鲑科鱼体内土腥味含量 银鲑、虹鳟和大西洋鲑背肌中MIB和GSM含量如图4所示。虹鳟体内的MIB含量显著高于银鲑和大西洋鲑体内的(P<0.01),达到了0.73 μg·kg-1。银鲑和大西洋鲑背肌中MIB含量无显著差异,P>0.05。GSM的含量排列顺序为:银鲑>虹鳟>大西洋鲑,银鲑、虹鳟和大西洋鲑体内GSM的含量分别达到了4.58、0.48和0.02 μg·kg-1,种类间GSM含量差异极其显著(P<0.01)。
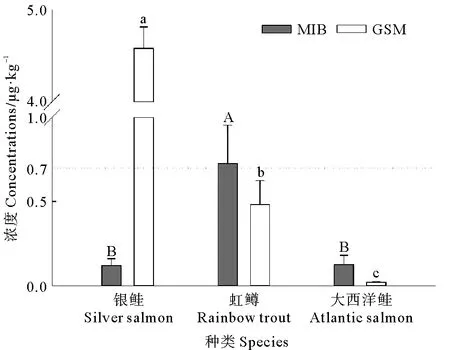
(不同大写字母表示MIB含量在不同种类间差异显著P<0.05,不同小写字母表示GSM含量在不同种类间差异显著P<0.05。Different capital letters indicate that the concentration of MIB varies significantly in different species P<0.05,while different lower-case letters indicate that the concentration of GSM varies significantly in different species P<0.05.)
2.3.2 不同养殖水体水质比较 本文比较了3种鲑科鱼类养殖水体的水质,如表3所示。3种鲑科鱼养殖水体中温度、pH及溶解氧的范围分别为15.3~20.3 ℃、6.85~8.46、6.96~12.05 mg·L-1,其中,虹鳟养殖用水水温最高、溶解氧含量最低,分别为20.3 ℃和6.96 mg·L-1。虹鳟、银鲑和大西洋鲑的养殖用水分别为淡水、半咸水及海水,盐度分别为0.2、15.0和30.1。氨氮、活性磷及总磷在银鲑养殖用水中最高,硝氮、亚硝氮、总氮及总悬浮物固体含量在大西洋鲑养殖用水中最高,分别为3.43 mg·L-1、0.21 mg·L-1、7.57 mg·L-1和0.14 g·L-1。经差异分析,所有水质指标在3种鲑科鱼类养殖水体间均存在显著差异(P<0.01)。

表3 不同种类鲑科鱼养殖用水水质
2.3.3 鱼体内土腥味物质含量与水质的相关性 对鲑科鱼体内的土腥味物质(MIB和GSM)与水质因子进行Pearson相关性分析,结果表明,鱼体中MIB含量与水温和pH呈显著正相关(见表4,P<0.05),与盐度、溶解氧、氨氮、总磷及总悬浮物固体呈显著负相关(P<0.05)。鱼体中GSM含量与氨氮、活性磷及总磷呈显著正相关(P<0.05),与亚硝氮、硝氮及总氮呈显著负相关(P<0.05)。

表4 鱼体MIB和GSM含量与水质的相关性分析
3 讨论
3.1 鲑科鱼类土腥味物质含量
近几年,养殖鲑科鱼类的土腥味问题时常被报道。本文测得虹鳟体内MIB含量和银鲑体内GSM含量分别为(0.73±0.22)和(4.58±0.23) μg·kg-1,超出了人类感官阈值0.7 μg·kg-1。国外许多学者也对养殖鲑科鱼的土腥味问题进行了研究,根据已发表数据,鲑科鱼体内MIB和GSM的含量范围为0~0.99 μg·kg-1和0.1~7.2 μg·kg-1[14,22],部分鱼类有明显的土腥味。由此看来,土腥味问题在鲑科鱼养殖业中普遍存在。因此,研究影响鱼类土腥味产生及分布的因素对鱼类土腥味控制有实际参考价值。
3.2 MIB和GSM在虹鳟体内的分布规律
水体中的土腥味物质能通过鱼鳃、体表和肠上皮细胞进入鱼体内[19],在富含脂质的组织如鱼皮和内脏中富集[19]。本文比较了虹鳟背肌、肝脏以及鱼皮中MIB和GSM的含量,发现两种异味物质均在虹鳟肝脏中积累最多,肝脏中的MIB的含量是背肌中的3倍,鱼皮中的10倍。肝脏中GSM的含量是背肌中的2倍,鱼皮中的10倍。因此,MIB和GSM在鱼体中的分布因组织不同而异,相比于肌肉和鱼皮组织,肝脏能积累更多的土腥味物质。目前鲜有对鱼类不同组织中土腥味物质含量比较及其蓄积机制的研究,因此不同组织对土腥味物质的富集途径还不清楚。
本实验测得养殖在相同水体中的虹鳟,规格越大,背肌中MIB和GSM含量也越高。有研究表明,GSM和MIB属于亲脂性化合物,能在脂肪中积累[23],GSM和MIB在鱼体内的富集能力取决于鱼体脂肪含量。本文测定了不同规格的虹鳟肌肉脂含量,表明脂含量随规格增加而上升,相关性分析得出虹鳟背肌脂含量与MIB和GSM含量显著正相关。相似的是,Yarnpakdee等[19]也发现脂含量较高的鱼体肌肉中MIB和GSM含量也较高,尼罗罗非鱼(Oreochromisniloticus)和斑点胡子鲶(Clariasmacrocephalus)腹部肌肉脂肪较背部肌肉丰富,腹部肌肉中GSM和MIB的含量要高于背部肌肉中的。因此,脂含量较高的鱼体内会富集更多的GSM和MIB。
鱼体中的土腥味物质主要源于水环境。Petersen等[24]研究了水体中MIB和GSM与虹鳟体内的MIB和GSM关系,指出水中的GSM超过20 ng·L-1时,96%的鱼有强烈的土腥味,低于10 ng·L-1时,18%的鱼有强烈的土腥味。Petersen等[24]建议为确保虹鳟的风味品质,其养殖水体中GSM和MIB的含量之和不能超过10 ng·L-1。本文得出结论,鱼体脂含量能影响鱼体土腥味物质的富集,因此,在养殖脂含量较高的鱼类时,要求养殖水体中土腥味物质的含量要更低。
3.3 鱼体背肌土腥味物质含量与水质的关系
MIB和GSM是萜类化合物,主要由蓝绿藻和放线菌类产生[12,25]。已有大量研究指出了放线菌和蓝藻合成MIB和GSM的途径[25-29]。因此,控制养殖水体中蓝藻和放线菌的数量是解决土腥味问题的关键,而养殖水体中微生物群落结构与功能与水质息息相关。
本文中相关性分析得出鱼体内MIB含量与水温和pH呈显著正相关关系。大量研究表明温度会显著影响产生MIB微生物的代谢[14-16,30-33]。弱碱(pH为8~9)条件能促进某些颤藻释放异味物质[34-35]。本文测得虹鳟养殖水体也偏弱碱性(pH=8.46)。因此温度超过20 ℃和偏弱碱性的环境可能促进了某些产MIB的蓝藻或放线菌的生长和代谢,导致产生大量的MIB渗透到鱼体中。本文中相关性研究表明鱼体内GSM含量与养殖水体中的氨氮、总磷和溶解性活性磷浓度呈显著正相关。朱健明等[36]研究发现鲢体内GSM含量与总磷浓度存在显著相关性。Dzialowski等[17]研究也指出溶解性活性磷的含量是影响GSM产生的重要决定因素。因此,养殖水体中的氨氮和磷可能为某些产生GSM的微生物提供了营养条件[37-39],从而导致产生大量的GSM被鱼体吸收,使鱼体产生较重土腥味。
目前认为减少鱼体土腥味的方法有两种:第一种是将带有土腥味的鱼转移至不含土腥味物质的净水中养殖[36,40]。朱健明等[36]研究表明将土腥异味较重的鲢在清水中净化32 d可有效改善其体内土腥味。大西洋鲑在净水中养殖10 d,鱼肉中的土腥味物质含量显著降低[40]。第二种方法是原位移除养殖水体中土腥味物质[36,40]。有研究表明[41],枯草芽孢杆菌和蜡状芽孢杆菌作为水产养殖中的益生菌,能有效降解GSM和2-MIB。另外,枯草芽孢杆菌能有效降低水体中的氨氮、硝氮、亚硝氮浓度以及水体pH,其胞外酶还能分解水体和底泥中的有机质,具有水质净化作用[41-42]。因此,对于本文中自然水库网箱养殖的鲑科鱼,可以采用净水养殖方式减少鱼体土腥味。对于循环水系统养殖的鲑科鱼,可以在生物过滤器上接种一些GSM和2-MIB降解菌,以改善水质同时去除水体中GSM和2-MIB。
4 结语
MIB和GSM在虹鳟鱼体内的富集程度与鱼体自身条件有关,虹鳟规格越大,脂含量越高,土腥味越严重。MIB和GSM在虹鳟不同组织内的含量为肝脏>背肌>鱼皮。水温和pH是影响虹鳟体内MIB产生的主要环境因子,氨氮和磷是影响虹鳟体内GSM含量的主要环境因子。对于本文中鲑科鱼的土腥味问题,可以采用净水养殖和添加能降解土腥味物质的益生菌两种方法解决。

