原儿茶醛对大鼠脑缺血再灌注损伤后神经血管单元稳态破坏的保护作用
冯晋 徐娅玲 孟庆婷 颜汉文 何芳雁


摘 要 目的:研究原兒茶醛对大鼠脑缺血再灌注损伤(CIRI)后神经血管单元(NVU)稳态破坏的保护作用。方法:将SD大鼠随机分为假手术组、模型组和原儿茶醛高、低剂量组(10、20 mg/kg),每组11只。给药组大鼠灌胃相应药物,假手术组和模型组大鼠灌胃等体积水,灌胃体积均为10 mL/kg,每日1次,连续5 d。末次给药后,采用线栓法复制大鼠CIRI模型,采用透射电镜观察大鼠脑组织中NVU超微结构的变化;采用Western blot法检测大鼠脑组织中NVU相关蛋白[神经元标志蛋白(MAP-2)、胶质纤维酸性蛋白(GFAP)、水通道蛋白(AQP-4)]的表达水平;采用免疫荧光染色法检测大鼠大脑皮层中上述蛋白的阳性表达水平。结果:与假手术组比较,模型组大鼠血脑屏障(BBB)结构被严重破坏,血管腔变窄,内皮细胞外侧严重水肿,基底膜厚薄不一;神经元核固缩,周围组织存在大面积水肿;胶质细胞结构严重破坏,胞体皱缩、细胞器损失;脑组织(或大脑皮层)中MAP-2蛋白表达水平(或阳性表达水平)均显著降低(P<0.05或P<0.01),GFAP、AQP-4蛋白表达水平(或阳性表达水平)均显著升高(P<0.01)。经原儿茶醛干预后,大鼠BBB损伤减轻,血管腔和基底膜形态未完全被破坏;神经元损伤减轻,神经元核固缩减少,染色质均匀、异染色质减少;胶质细胞结构破坏减轻,脑组织中GFAP、AQP-4(低剂量组除外)蛋白表达水平以及大脑皮层中MAP-2、GFAP蛋白阳性表达水平均显著逆转(P<0.05或P<0.01)。结论:原儿茶醛可保护CIRI模型大鼠的NVU稳态免受破坏;其作用机制可能与上调大鼠大脑皮层中MAP-2蛋白表达,下调脑组织中GFAP、AQP-4蛋白表达有关。
关键词 原儿茶醛;脑缺血再灌注损伤;神经血管单元;大脑皮层;大鼠
ABSTRACT OBJECTIVE: To observe the protective effect of protocatechuic aldehyde (PAL) on neurovascular unit (NVU) homeostasis damage in rats after cerebral ischemia-reperfusion injury (CIRI). METHODS: SD rats were randomly divided into sham operation group, model group, PAL high-dose and low-dose groups (10, 20 mg/kg), with 11 rats in each group. Administration groups were given relevant medicine intragastrically. Sham operation group and model group were given the same volume of normal saline intragastrically, 10 mL/kg once a day, for 5 days. After last administration, CIRI model was induced by suture method; the ultrastructural changes of NVU were observed by transmission electron microscope. Western blot assay was used to detect the expression of NUV related proteins (MAP-2, GFAP, AQP-4) in cerebral tissue. Immunofluorescence staining was used to observe the positive expression of above proteins in cerebral cortex. RESULTS: Compared with sham operation group, blood-brain barrier (BBB) structure of model group was destroyed severely, the vascular lumen became narrower, lateral edema of endothelial cells was severe, and the thickness of basement membrane varied; the nuclei of neurons were pyknosis and there was a large area of edema in the surrounding tissues; the structure of glial cells was seriously damaged, the cell body was shrunk and organelles were lost; protein expression (or positive expression) of MAP-2 in brain tissue (or cerebral cortex) were significantly decreased (P<0.05 or P<0.01), while protein expression (or positive expression) of GFAP and AQP-4 were increased significantly (P<0.01). After PAL intervention, the rats had less BBB damage, and the morphology of vascular lumen and basement membrane were not completely destroyed; the damage of neurons was alleviated, the pyknosis of neurons was decreased, the chromatin was homogeneous and the heterochromatin was decreased; the damage of glial cell structure was alleviated; protein expression of GFAP and AQP-4 (except for low-dose group) in cerebral tissue and positive expression of MAP-2 and GFAP protein in cerebral cortex were reversed significantly (P<0.05 or P<0.01). CONCLUSIONS: PAL can protect the stability of NVU from damage in CIRI model rats; the mechanism may be related to up-regulating the expression of MAP-2 protein in cerebral cortex and down-regulating the expression of GFAP and AQP-4 protein in brain tissue.
KEYWORDS Protocatechuic aldehyde; Cerebral ischemia-reperfusion injury; Neurovascular unit; Cerebral cortex; Rats
《中国脑卒中防治报告(2018)》显示,脑卒中居我国死亡原因之首[1]。其中,缺血性脑卒中(ischemic stroke,IS)是脑卒中发病率最高的病种,其是由于脑血流的突然中断导致脑细胞死亡和神经缺陷的一类疾病[2]。在IS的病理发展过程中,血栓脱落、血栓自溶以及缺血区侧支循环的建立与开放等均会引起缺血区的血流重建,从而造成脑缺血再灌注损伤(CIRI),进而导致IS恶化[3]。IS的发生不仅影响神经元,还影响位于“胶质细胞-神经细胞-血管小生态环境”中的所有脑细胞、细胞外基质和机体免疫系统。基于此,美国国家神经疾病和中风学会提出了“脑神经血管单元(neurovascular unit,NVU)”的概念[4],为临床治疗IS提供了新的策略——NVU稳态的治疗,强调从整体研究脑神经血管系统的损伤及其机制,对IS的治疗从单一环节扩展为对 NVU 各细胞成分的全面保护,以维持脑微环境的整体稳定,促进神经元存活和神经功能的恢复,以期达到降低IS致残率和病死率的目标[5-7]。
NVU由神经元、星形胶质细胞(Ast)、小胶质细胞、血脑屏障(BBB)等成分组成[8-10];当脑缺血再灌注后,部分神经元变性坏死、Ast足突水肿、小胶质细胞被大量激活,使得NVU的完整性被破坏,从而导致脑组织内环境的稳态失调[11-12]。
原儿茶醛为天麻的酚类成分(结构式见图1),具有保护BBB、抗血小板聚集和抗神经炎症等作用;且经本课题组前期研究发现,其对IS后的CIRI具有保护作用[13-14]。但是,原儿茶醛是否可通过作用于NVU发挥其保护CIRI的作用尚不明确。基于此,本研究建立大鼠脑缺血再损伤模型,采用透射电镜观察NVU各组成成分(BBB、神经元、胶质细胞)的结构变化,采用Western blot法和免疫荧光染色法,研究原儿茶醛干预后对NVU相关蛋白[微管相关蛋白2(MAP-2)、胶质纤维酸性蛋白(GFAP)、水通道蛋白(AQP-4)][15-17]表达水平的影响,以期为探讨原儿茶醛对CIRI后NVU稳态破坏的保护作用提供参考。
Fig 1 Chemical structure of PAL
1 材料
1.1 主要仪器
本研究所用主要仪器有:Secura2250型分析天平(瑞士Precisa公司)、CF16RXⅡ型低温高速离心机(日本Hitachi Koki公司)、UVP型显色系统(美国Spectrum公司)、Cryo Star 型冰冻切片机(德国Leica公司)、JEM- 1400Flash型透射电镜(日本电子株式会社)。
1.2 主要药品与试剂
本研究所用主要药品与试剂有:原儿茶醛(北京百灵威科技有限公司,批号P13N,纯度98%),TTC试剂(上海惠世生化试剂有限公司,批号120808),多聚甲醛(天津化学试剂研究所,批号20100525),水合氯醛(广东光华化学厂有限公司,批号20100926),兔抗MAP-2多克隆抗体(美国Abcam公司,批号GR288637-1),鼠抗AQP-4多克隆抗体、兔抗GFAP多克隆抗体、兔抗β-actin单克隆抗体、异硫氰酸荧光素(FITC)标记的免疫球蛋白G(IgG)二抗、化学发光显影剂(美国Proteintech公司,批号分别为C520BA0013、00023078、10004157、20000003、B2202003),二喹啉甲酸(BCA)蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,批号090119191205);其余试剂为实验室常用规格,水为纯净水。
1.3 动物
本研究所用动物为SPF级SD大鼠,雄性,體质量240~270 g,购自成都达硕实验动物有限公司,动物生产许可证号为SCXK(川)2020-020。大鼠每天定时供应食水,并定期更换垫料,饲养环境温度为18~24 ℃、相对湿度为40%~60%,适应性喂养7 d后进行后续实验。
2 方法
2.1 造模、分组与给药
将48只大鼠随机分为假手术组、模型组和原儿茶醛低、高剂量组(10、20 mg/kg,剂量根据前期研究结果和参考文献[13]设置),每组11只。给药组大鼠灌胃相应药物(临用时以水进行溶解),假手术组和模型组大鼠灌胃等体积水,灌胃体积均为10 mL/kg,每天1次,连续5 d。末次给药后,对大鼠腹腔注射10%水合氯醛(3 mL/kg)进行麻醉,并以仰卧位固定于37 ℃恒温加热鼠板上;参考文献[18-20]中的线栓法,取大鼠颈正中偏右切口,暴露右侧颈总动脉(CCA)和迷走神经并进行钝性分离。将CCA远心端打一活结,近心端结扎,并在结扎上部剪一“V”型小口,将栓线沿“V”型小口插入,直至尼龙线前端到达大鼠大脑中动脉(MCA)起始处(线栓插入长度大约为18~20 mm);栓塞2 h后,缓慢轻拉尼龙栓线,以复制CIRI模型大鼠。假手术组大鼠同法分离血管后,不插入拴线。造模后,参考文献[21-22]方法,对大鼠进行神经学评分:0分为无神经功能缺损症状,1分为轻度局灶性神经功能缺损(即提尾悬空不能伸展左侧前爪),2分为中度局灶性神经功能缺损(即行走时向左侧转圈),3分为中度局灶性神经功能缺损(即行走困难,并向左侧倾倒),4分为重度局灶性神经功能缺损(即不能自发行走、意识水平下降);并以激光多普勒检测大鼠脑血流量。当大鼠神经学评分为1~3分且脑血流量降至其基础值的20%左右,并在再灌注2 h后脑血流量恢复至其基础值的50%以上,则表明造模成功。
2.2 大鼠脑组织中NVU超微结构的观察
造模成功后,各组取2只大鼠,腹腔注射10%水合氯醛进行麻醉,并以生理盐水和4%多聚甲醛进行心脏灌流;灌流后,断头取大鼠额顶区脑组织,将其切成5片厚度为1 mm的切片,以双醛固定液浸泡3次,每次10 min;以2.5%戊二醛和2%四氧化锇固定,梯度乙醇脱水,环氧树脂包埋;再以醋酸铀、枸椽酸铅双重染色,然后采用透射电镜观察大鼠脑组织中NVU超微结构的变化。
2.3 大鼠脑组织中NVU相关蛋白表达的检测
采用Western blot法进行检测。各组取6只大鼠,腹腔注射10%水合氯醛进行麻醉,以生理盐水进行心脏灌流后,迅速取出脑组织,置于冰上分离出缺血侧(右侧)大脑皮层和海马组织,加入蛋白裂解液提取蛋白;以14 000 r/min离心10 min,分离上层蛋白液,采用BCA法检测蛋白浓度。蛋白经变性后进行十二烷基硫酸钠-聚丙烯酰胺电泳(SDS-PAGE),转膜,以5%脱脂奶粉封闭1.5 h;以TBST缓冲液清洗5 min×3次,加入MAP-2、GFAP、AQP-4、β-actin一抗(稀释度均为1 ∶ 1 000),于4 ℃条件下孵育过夜;以TBST缓冲液清洗5 min×3次,加入二抗(稀释度为1 ∶ 1 000),室温下孵育2 h;以TBST缓冲液清洗5 min×3次,加入化学发光显影剂,采用显色系统成像。采用Image J v1.8.0软件进行分析,以目的蛋白与内参蛋白(β-actin)的灰度值比值表示目的蛋白的表达水平。
2.4 大鼠大脑皮层中NVU相关蛋白阳性表达的检测
采用免疫荧光染色法进行检测。取对照组、模型组和原儿茶醛高剂量组大鼠各3只(因本课题组实验经费有限,故仅选择了原儿茶醛高剂量组大鼠进行免疫荧光染色实验),以生理盐水和4%多聚甲醛进行心脏灌流后,断头取大鼠脑组织,将脑组织于20%蔗糖溶液和30%蔗糖溶液中脱水过夜;取出脑组织,进行包埋、冰冻切片。切片晾干后,以0.01 mol/L PBST緩冲液冲洗3次×5 min,然后滴加MAP-2、GFAP、AQP-4一抗(稀释度分别为1 ∶ 100、1 ∶ 50、1 ∶ 500),于4 ℃条件下孵育过夜;以0.01 mol/L PBST缓冲液冲洗5 min×3次,加入二抗(稀释度为1 ∶ 1 000),室温下孵育40 min;以0.01 mol/L PBST缓冲液冲洗5 min×3次,封片。采用显微镜观察切片中大鼠缺血侧(右侧)大脑皮层中MAP-2、GFAP和AQP-4的阳性表达情况。采用Image J v1.8.0软件计算各目的蛋白阳性染色面积百分比,其值越大,则表示目的蛋白阳性表达水平越高。
2.5 统计学方法
采用SPSS 26.0软件进行统计分析。若数据符合正态分布且方差齐,则以x±s表示,多组间比较时采用单因素方差分析,组间两两比较时采用LSD检验;若不符合正态分布则以中位数表示,采用非参数检验。检验水准α=0.05。
3 结果
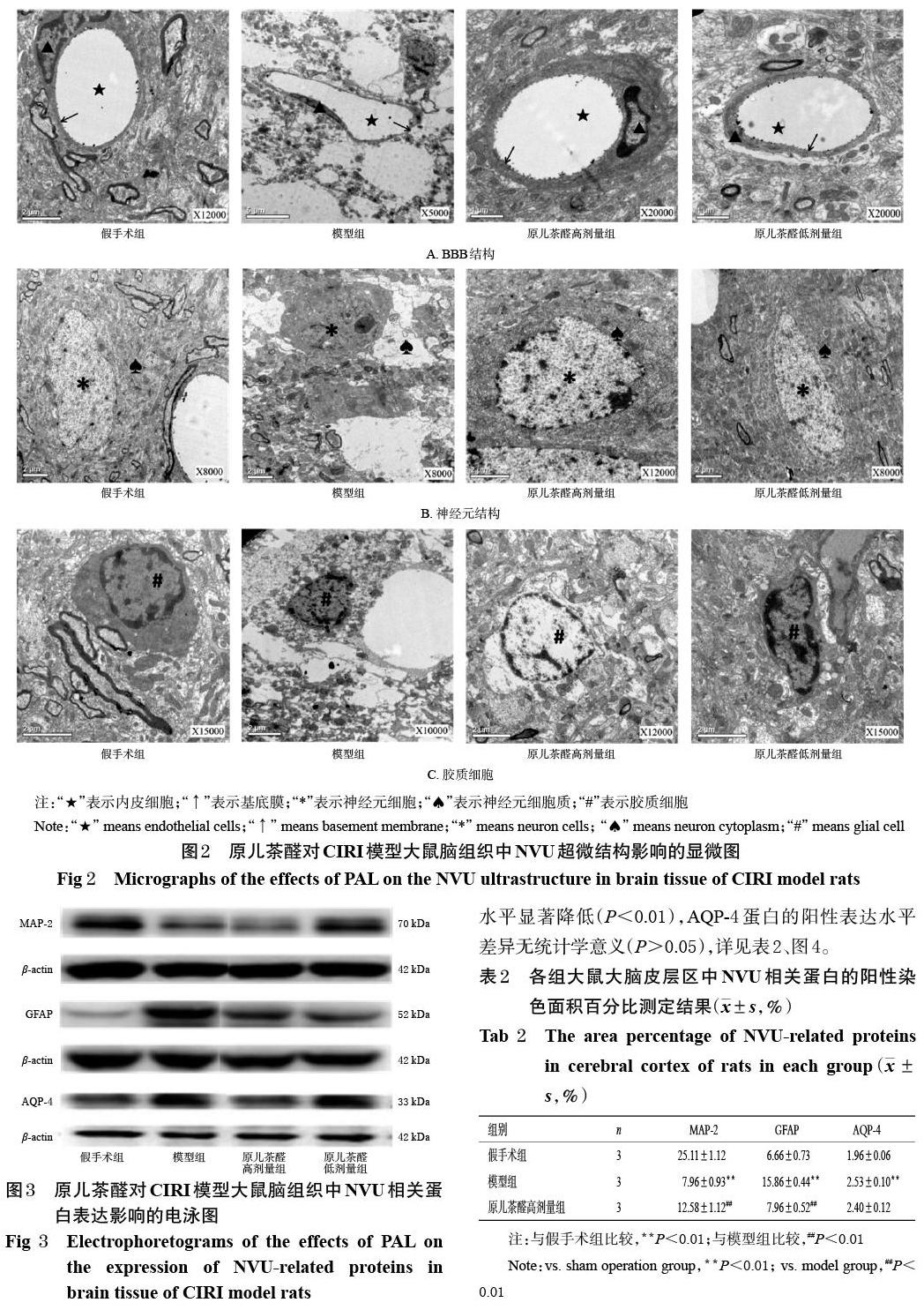
3.1 原儿茶醛对大鼠脑组织中NVU超微结构的影响
假手术组大鼠BBB结构完整,血管内皮细胞正常,基底膜厚薄均一;神经元结构正常、无明显变化,染色质分布均匀;胶质细胞结构完好,细胞核、细胞器完整,周围组织无水肿。模型组大鼠BBB结构被严重破坏,血管腔变窄,内皮细胞外侧严重水肿,基底膜厚薄不一;神经元核固缩,周围组织存在大面积严重水肿;胶质细胞结构严重破坏,胞体皱缩、细胞器损失。原儿茶醛各剂量组大鼠与模型组比较,其BBB损伤减轻,血管腔和基底膜形态未完全被破坏;神经元损伤减轻,神经元核固缩减少,染色质均匀、异染色质减少;胶质细胞结构破坏减轻,详见图2。
3.2 原儿茶醛对CIRI模型大鼠脑组织中NVU相关蛋白表达的影响
与假手术组比较,模型组大鼠脑组织中MAP-2蛋白表达水平显著降低(P<0.05),GFAP、AQP-4蛋白表达水平均显著升高(P<0.01);与模型组比较,原儿茶醛各剂量组大鼠脑组织中MAP-2蛋白表达水平有所升高,但差异无统计学意义(P>0.05),而GFAP、AQP-4(原儿茶醛低剂量组除外)蛋白表达水平均显著降低(P<0.05),详见表1、图3。
注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05
Note:vs. sham operation group,*P<0.05,**P<0.01; vs. model group,#P<0.05
3.3 原儿茶醛对CIRI模型大鼠大脑皮层中NVU相关蛋白阳性表达的影响
与假手术组比较,模型组大鼠大脑皮层中MAP-2蛋白的阳性表达水平显著降低(P<0.01),GFAP、AQP-4蛋白的阳性表达水平均显著升高(P<0.01);与模型组比较,原儿茶醛高剂量组大鼠大脑皮层中MAP-2蛋白的阳性表达水平显著升高(P<0.01),GFAP蛋白的阳性表达水平显著降低(P<0.01),AQP-4蛋白的阳性表达水平差异无统计学意义(P>0.05),详见表2、图4。
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01
Note:vs. sham operation group,**P<0.01; vs. model group,##P<0.01
4 讨论
CIRI是一个复杂的病理生理过程,涉及能量代谢障碍、兴奋性氨基酸过度释放、炎症反应、自由基堆积、细胞凋亡等多个病理环节[23]。NVU是由BBB、神经元、Ast、小胶质细胞等支持细胞组成的功能性结构,各细胞之间相互协调、共同维持脑组织内环境的整体稳态;其对脑缺血早期的炎症反应以及后期的血管新生进程具有重要的作用[11-12]。当发生局灶性脑缺血时,NVU中BBB、神经元、胶质细胞均受到不同程度的损害,从而使得NVU的完整性被破坏[24]。本研究发现,大鼠CIRI后其BBB结构被严重破坏;神经元核固缩,周围组织存在大面积严重水肿;胶质细胞结构严重破坏。经原儿茶醛干预后,大鼠BBB、神经元损伤减轻,胶质细胞结构破坏减轻。这表明原儿茶醛能保护大鼠CIRI后NVU超微结构的完整性。
MAP-2是神经元细胞骨架的重要组成部分,其表达水平能反映神经元树突的破坏情况[6];GFAP是Ast的骨架蛋白,其表达水平能反映Ast的活化情况[25]; AQP-4是脑内主要的水通道蛋白,在BBB和脑-脑脊液屏障的Ast中高度表达,其表达水平可反映脑内水平衡和组成BBB完整性结构的紧密连接蛋白的损伤情况[26]。本研究的Western blot法检测结果显示,经低、高剂量原儿茶醛干预后,CIRI模型大鼠脑组织中GFAP、AQP-4(低剂量组除外)蛋白表达水平均显著降低,而MAP-2蛋白表达水平的变化无统计学意义(P>0.05);免疫荧光染色法结果显示,经高剂量原儿茶醛干预后,CIRI模型大鼠大脑皮层中MAP-2蛋白的阳性表达水平显著升高,GFAP的阳性表达水平显著降低,而AQP-4蛋白的阳性表达水平的变化无统计学意义(P>0.05)。这提示原儿茶醛对MAP-2、GFAP蛋白的影响主要在大鼠大脑皮层区,对AQP-4蛋白的影响可能不在大脑皮层区。
综上所述,原儿茶醛可保护CIRI模型大鼠的NVU稳态免受破坏;其作用机制可能与上调大鼠大脑皮层中MAP-2蛋白表达,下调脑组织中GFAP、AQP-4蛋白表达有关。
参考文献
[ 1 ] 王陇德,刘建民,杨弋,等. 我国脑卒中防治仍面临巨大挑战:《中国脑卒中防治报告2018》概要[J]. 中国循环杂志,2019,34(2):105-119.
[ 2 ] ZHANG L,ZHANG Z G,CHOPP M. The neurovascular unit and combination treatment strategies for stroke[J]. Trends Pharmacol Sci,2012,33(8):415-422.
[ 3 ] SUAREZ J I,ZAIDAT O O,SUNSHINE J L,et al. Endovascular administration after intravenous infusion of thrombolytic agents for the treatment of patients with acute ischemic strokes[J]. Neurosurgery,2002,50(2):251-260.
[ 4 ] LECRUX C,HAMEL E. The neurovascular unit in brain function and disease[J]. Acta Physiol (Oxf),2011,203(1):47-59.
[ 5 ] GAO M,ZHU S Y,TAN C B,et al. Pinocembrin protects the neurovascular unit by reducing inflammation and extracellular proteolysis in MCAO rats[J]. J Asian Nat Prod Res,2010,12(5):407-418.
[ 6 ] ZHANG R,TANG S,HUANG W,et al. Protection of the brain following cerebral ischemia through the attenuation of PARP-1-induced neurovascular unit damage in rats[J]. Brain Res,2015,1624:9-18.
[ 7 ] MOHAMED I N,ISHRAT T,FAGAN S C,et al. Role of inflammasome activation in the pathophysiology of vascular diseases of the neurovascular unit[J]. Antioxid Redox Signal,2015,22(13):1188-1206.
[ 8 ] LI Y,CHOPP M,JIANG N,et al. Temporal profile of in situ DNA fragmentation after transient middle cerebral artery occlusion in the rat[J]. J Cereb Blood Flow Metab,1995,15(3):389-397.
[ 9 ] 徐芳琴,郭超,卞濤,等.丹红注射液对大鼠脑缺血/再灌注损伤治疗时间窗的影响[J].中成药,2016,38(9):1887-1892.
[10] 肖晗.丹参酮ⅡA在不同时间点给药对大鼠脑缺血模型再灌注损伤的神经保护作用研究[D].合肥:安徽医科大学,2014.
[11] ZONTA M,ANGULO M C,GOBBO S,et al. Neuron-to- astrocyte signaling is central to the dynamic control of brain microcirculation[J]. Nat Neurosci,2003,6(1):43- 50.
[12] SAVCHENKO E S,PEVZNER I B,ZOROVA L D,et al. Changes in the number of neurons,astrocytes and micro- glia in the brain after ischemic stroke assessed by immunohistochemistry and immunoblotting[J]. Tsitologiia,2016,58(7):534-542.
[13] LI X,XIANG B,SHEN T,et al. Anti-neuroinflammatory effect of 3,4-dihydroxybenzaldehyde in ischemic stroke
[J]. Int Immunopharmacol,2020,82:106353.
[14] DUAN X,WANG W,LIU X,et al. Neuroprotective effect of ethyl acetate extract from gastrodia elata against transient focal cerebral ischemia in rats induced by middle cerebral artery occlusion[J]. J Tradit Chin Med,2015,35(6):671-678.
[15] 王慧钢,于思淼,邱瑾,等. SUMO-2/3活化介导丹参对缺血神经元的保护机制[J].天津中医药,2015,32(7):420- 423.
[16] HUANG W,LV B,ZENG H,et al. Paracrine factors secreted by MSCs promote astrocyte survival associated with GFAP downregulation after ischemic stroke via p38 MAPK and JNK[J]. J Cell Physiol,2015,230(10):2461- 2475.
[17] XIANG J,LAN R,TANG Y P,et al. Apocynum venetum leaf extract attenuates disruption of the blood-brain barrier and upregulation of matrix metalloproteinase-9/-2 in a rat model of cerebral ischemia-reperfusion injury[J]. Neurochem Res,2012,37(8):1820-1828.
[18] SHI Y,JIANG X,ZHANG L,et al. Endothelium-targeted overexpression of heat shock protein 27 ameliorates blood-brain barrier disruption after ischemic brain injury[J]. Proc Natl Acad Sci U S A,2017,114(7):E1243- E1252.
[19] HA P J,YOO K Y,HYE K I,et al. Hydroquinone strongly alleviates focal ischemic brain injury via blockage of blood-brain barrier disruption in rats[J]. Toxicol Sci,2016,154(2):430-441.
[20] HAGHNEJAD A A,ORYAN S,BOHLOOLI S,et al. Alpha-tocopherol reduces brain edema and protects blood- brain barrier integrity following focal cerebral ischemia in rats[J]. Med Princ Pract,2017,26(1):17-22.
[21] ENRIQUE Z L,PHILIP R W,SARA C,et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[22] 饒梦琳,唐蜜,何锦悦,等.芍药苷对大鼠局灶性脑缺血再灌注脑血流量及PGI2/TXA2平衡的影响[J].药学学报,2014,49(1):55-60.
[23] 李娜.红花黄色素对控制性低血压诱导的缺血缺氧性脑损伤的影响及机制研究[D].广州:南方医科大学,2016.
[24] DIRNAGL U. Pathobiology of injury after stroke:the neurovascular unit and beyond[J]. Ann N Y Acad Sci,2012,1268:21-25.
[25] YULONG M,HANG G,LIXIA Z,et al. Estrogen replacement therapy-induced neuroprotection against brain is- chemia-reperfusion injury involves the activation of astrocytes via estrogen receptor β[J]. Sci Rep,2016,6:21467.
[26] WU C,CHEN J,CHEN C,et al. Wnt/beta-catenin coupled with HIF-1alpha/VEGF signaling pathways involved in galangin neurovascular unit protection from focal cerebral ischemia[J]. Sci Rep,2015,5:16151.
(收稿日期:2021-02-18 修回日期:2021-05-06)
(编辑:唐晓莲)

