艾司氯胺酮的药理学及其在产后抑郁防治的研究进展
宋丛中, 孙建良
(浙江大学医学院附属杭州市第一人民医院麻醉科, 浙江 杭州310000)
抑郁症(major depressive disorder, MDD)是一种常见的精神障碍, 长期中度或重度MDD可能会对患者学习、工作和生活造成极大影响, 严重者有自杀倾向, 现已成为重要的公共卫生问题。 产后抑郁(postpartum depression, PPD或postnatal depression, PND)是特发于女性产后这一特殊时期的MDD, 与妊娠期间抑郁一起共同组成围生期抑郁。 以往定义的PPD目前更倾向于称为围生期抑郁, 但现阶段仍以PPD研究为主。
作为对MDD耐药患者具有强大的抗抑郁和抗自杀作用的氯胺酮[N-甲基-D-天冬氨酸(NMDA)受体拮抗剂], 其S-对映异构体与NMDA 受体具有更大的亲和力, 随即研发出新型抗抑郁药和麻醉药艾司氯胺酮, 在2019年3月美国食品和药物管理局(FDA)首次批准新的鼻喷剂型抗抑郁药艾司氯胺酮用于治疗难治性抑郁症(treatment-resistant depression, TRD)[1]。 本文结合国内外文献就PPD和艾司氯胺酮的药理学及其在PPD防治领域的应用进行综述。
1 产后抑郁症的诊治概况
产妇围生期抑郁是围生期最常见的精神疾病之一。 Gavin等[2]荟萃分析表明, 妊娠期间MDD发生率为18.4%, 严重MDD发生率为12.7%, 产后3个月内MDD发生率为19.2%, 其中重度MDD发生率为7.1%。 Norhayati等[3]综述显示2005~2014年来自42个国家的191项研究在通过自我问卷调查发现发展中国家PPD患病率为1.9%~82.1%, 发达国家为5.2%~74.0%。 美国一项大型研究[4]结果表明, PPD发作的有40.1%, 怀孕期间抑郁发作的有33.4%, 因此称“围生期”可能比“产后”更确切。 美国精神病学会《精神疾病诊断和统计手册》第5版[5]将PPD定义为“围生期发作”的MDD, 并明确表示“如果在怀孕期间或分娩后4周内出现情绪症状”, 与第4版相比, 把“产后发病”这个起病时间更改为“围生期发病”, 即妊娠期间和产后发作的抑郁, 称为“围生期抑郁”。 但在临床实践和临床研究中, PPD时间定义变化更大, 包括分娩后4周到12个月内[6]。 围生期MDD和非围生期MDD有相同的诊断标准: 情绪低落、兴趣丧失、快感缺乏、睡眠和食欲障碍、注意力不集中、精神运动障碍、疲劳、罪恶感或无价值感以及自杀想法, 以上症状至少持续2周并在功能上造成严重损害[5]。 围生期MDD症状还包括焦虑、易怒、不知所措以及经常对婴儿的健康、喂养和洗澡安全产生强迫性的担忧或专注[6-7]。 自杀倾向极为普遍, 有研究报道约有20%的围生期MDD患者受到有自杀意念的影响[4]。
2 产后MDD的评估
发现和识别产后MDD的基本方法是在产后随访期间对由产科医生或初级保健者对分娩后妇女的情绪进行敏感的临床询问。 在不同的指导方针中, 调查的最佳时间从分娩后不久到6~12个月后不等。 英国国家健康和保健卓越研究所[8]建议使用敏感的两问题筛查工具(即对产后妇女询问在过去的一个月里, 是否经常感到心情低落、沮丧或绝望?是否经常因为对做事没有兴趣或乐趣而烦恼?)对MDD进行两阶段筛查。 如有阳性结果或临床担忧, 应进行进一步、更明确的评估, 如患者健康问卷(patient health questionnaire-9, PHQ-9)或10项爱丁堡产后抑郁量表(10-item edinburgh postnatal depression scale, EPDS), 对其中任何一项的阳性结果应进行全面的临床评估, 以确定诊断。 美国妇产科学院[9], 美国儿科学会[10]和美国预防服务工作队[11]建议使用EPDS对产后妇女进行常规的产后情绪检测和评估。 临床评估是确定诊断的金标准。 同时要排除产妇常见的甲状腺功能障碍和贫血[12]等原因导致的抑郁和焦虑症状。
3 产后抑郁症的治疗
PPD的有效管理通常需要综合多学科的方法。 首先进行心理干预或心理治疗, 当PPD严重或单凭心理治疗不够完善时, 可能需要单独或在非药物治疗的基础上联用抗抑郁药物, 治疗PPD的一线抗抑郁药物是选择性5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitor, SSRI)。 治疗失眠和并发症的辅助精神药物(如催眠药、苯二氮类药物)或增强抗抑郁药物(如抗精神病药物或其他类似作用的药物)也可用于PPD。
4 氯胺酮与艾司氯胺酮的抗抑郁作用
2000年Berman等[13]报道了氯胺酮对严重MDD患者的快速抗抑郁作用, 这是首个双盲、安慰剂对照试验, 表明氯胺酮对重度MDD患者具有快速强大的抗抑郁作用, 该试验对7名MDD患者进行了为期2 d的药物洗脱治疗, 被随机分为2组的患者予静脉输注生理盐水或0.5 mg/kg盐酸氯胺酮溶液40 min, 结果发现氯胺酮产生了快速而稳定的抗抑郁反应。 此后, 许多研究陆续证实氯胺酮对耐药性MDD、双相情感障碍和自杀意念的患者具有抗抑郁作用。 Daly等[14]和Canuso等[15]对鼻喷艾司氯胺酮治疗MDD的研究中发现, 给药后2 h及4 h时症状改善最明显, 且其呈明确的量效关系。 与氯胺酮单次注射抗抑郁的维持时间(约1周)比氯胺酮本身半衰期(约 3 h)要长[16]的这一特点相似, 艾司氯胺酮在减少给药频率或剂量或未给药期间, 其抗抑郁作用仍持续存在。
也有研究关注围术期使用氯胺酮对PPD发生率的影响。 一项对654名接受剖宫产手术的中国妇女进行随机对照研究, 在婴儿出生后10 min, 氯胺酮组给予0.5 mg/kg氯胺酮, 而对照组不给药, 术后氯胺酮组使用在100 mL生理盐水中加入舒芬太尼(100 μg)、氯胺酮(160 mg)和盐酸帕洛诺司琼(0.25 mg)的患者自控静脉镇痛装置, 而对照组则使用在100 mL生理盐水中加入舒芬太尼(100 μg)和盐酸帕洛诺司琼(0.25 mg)的患者自控静脉镇痛装置, 发现氯胺酮组的PPD发病率明显低于对照组[17]。 而另一项对325名产妇的随机对照双盲试验, 研究者将产妇分为2组, 试验组为氯胺酮0.25 mg/kg 用生理盐水稀释到10 mL缓慢静脉注射, 对照组为生理盐水10 mL缓慢静脉注射, 2组EPDS评分和PPD的发生率在术后第3天和术后6周差异均无统计学意义[18]。
5 艾司氯胺酮的结构与功能
5.1 化学结构
艾司氯胺酮(S-氯胺酮或esketamine)是氯胺酮(包含等份的R-氯胺酮和S-氯胺酮的外消旋混合物, 电离常数Ki=0.53 mmol/L)的S对映异构体(Ki=0.30 mmol/L)。 在人体中作为麻醉药的艾司氯胺酮的效力比氯胺酮的效力高2倍, 并且比R-氯胺酮的效力约高3倍[19], 因此, 艾司氯胺酮已在某些国家被广泛用作麻醉药。
5.2 药理学
艾司氯胺酮是比对映体R-氯胺酮更有效的NMDA受体拮抗剂, 艾司氯胺酮(Ki = 0.30 μmol/L)对NMDAR的亲和力是R-氯胺酮(Ki = 1.40 μmol/L)的3~4倍。 关于艾司氯胺酮的副作用及其严重程度, 如分离性症状、精神病类症状和认知功能的影响等, 文献中存在很大分歧[20-22], 可能有些研究是在艾司氯胺酮作为麻醉剂下进行的。
5.3 药效学
氯胺酮和艾司氯胺酮抗抑郁作用机制迄今尚无统一定论。 目前普遍认可的是氯胺酮(或艾司氯胺酮)通过抑制突触或选择性结合GluN2B突触前的NMDA受体, 抑制位于γ氨基丁酸能中间神经元的NMDA受体及抑制NMDA受体依赖的侧扣带神经元的突发放电, 以及激活AMPA(α-氨基-3-羟基-5-甲基-4-异恶唑-丙酸)受体而发挥抗抑郁作用[23]。 同时氯胺酮阻断NMDA受体和激活AMPA受体, 进而促进神经营养效应, 如释放脑源性神经营养因子(Brain-derived neurotrophic factor, BDNF)、真核延伸因子2(Eukaryotic elongation factor 2, eEF2)等激活下游营养信号级联导致大脑皮质区树突生长和突触形成, 这可能也是氯胺酮发挥抗抑郁作用的部分机制或原因[24-25]。
5.4 药动学
氯胺酮和艾司氯胺酮的生物利用度因给药方式不同而不同, 包括静脉、鼻内、口服、肌注和直肠给药, 其中静脉途径的生物利用度可达到100%。 Zhang等[26]比较了氯胺酮在人体不同的给药途径后的药代动力学特性(表1)。 艾司氯胺酮通过肝酶CYP450、CYP2B6和CYP3A4系统快速全面地N-去甲基化为活性代谢物(S)-去甲氯胺酮, (S)-去甲氯胺酮通过CYP依赖性途径进一步代谢为S-5-羟基去甲氯胺酮(hydroxynorketamine, HNK)和S-5, 6-脱氢去甲氯胺酮(dehydronorketamine, DHNK)等代谢产物, 这些代谢产物进一步通过葡萄糖醛酸化代谢[27], 大多数代谢产物(≥78%)通过尿液排出, 小部分(≤2%)通过粪便排出[28]。 与氯胺酮相比, 单独服用艾司氯胺酮的全身清除速度更快[29], 用药后2~4 h内血浆浓度迅速下降。
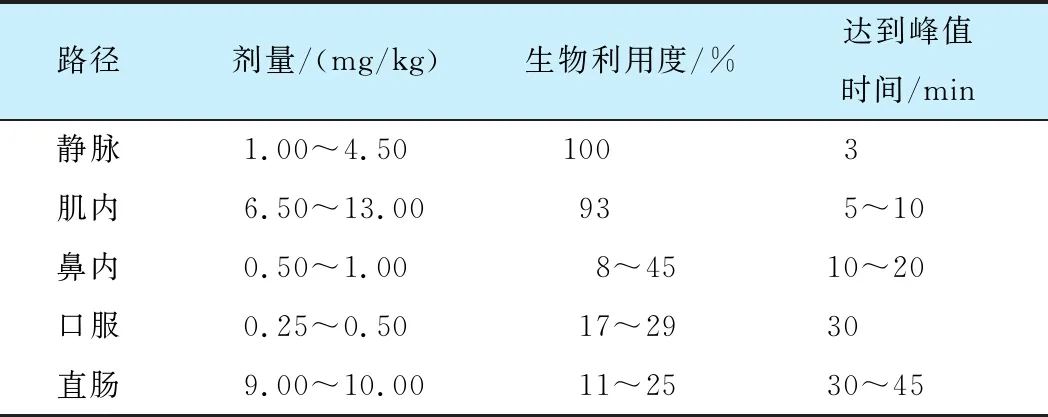
表1 氯胺酮(R, S-氯胺酮)在人体中的药代动力学
6 氯胺酮用于治疗围生期MDD的安全性评估
与氯胺酮相比, 艾司氯胺酮滥用的确切结果尚不清楚, 但艾司氯胺酮被FDA批准在TRD中使用这一事实和艾司氯胺酮的长期安全性数据都表明其安全性优于氯胺酮[30]。
已有6项研究报道了鼻内使用艾司氯胺酮的安全性[14, 31-35]。 表2总结了艾司氯胺酮常见的不良反应。 研究表明, 这些不良反应一般为轻至中度, 通常在治疗期间和治疗后立即出现, 也会在同1 d消退。 最长的副作用和耐受性研究(SUSTAIN 2)是对802名接受艾司氯胺酮治疗的患者进行了1年的随访[35], 结果发现, 90.1%的患者在研究过程中经历了至少一次不良反应。 这篇研究发现患者的急性副作用类似于既往外消旋氯胺酮的报道, 但由于文献中关于氯胺酮副作用的报道没有系统地收集, 因此很难比较其发生的频率[36]。 一项系统回顾[37]研究了氯胺酮治疗MDD的副作用, 艾司氯胺酮与其类似, 大多为短暂的急性副作用, 最常见的副作用包括头痛、头晕、精神症状、视力模糊、短暂性高血压和焦虑, 研究最后指出, 根据目前文献资料, 尚没有足够的数据来评价氯胺酮重复给药或长期治疗后的副作用。

表2 鼻喷艾司氯胺酮治疗的常见副作用(综合六项[14, 31-35]研究结果)
在所有接受鼻内艾司氯胺酮治疗的患者中, 只有不到5%的患者出现了严重的不良反应[31-35]。 患者在接受艾司氯胺酮治疗期间报告的不良事件包括髋部骨折、血压明显升高、室性早搏、低体温、腔隙性脑梗塞、短暂癫痫发作、晕厥、焦虑、躁动、攻击性、镇静、定向障碍和自杀意念, 但这些不良事件究竟是否与艾司氯胺酮均直接相关, 目前仍不清楚。 在维持艾司氯胺酮治疗的1年中[35], 5名患者(占样本量的0.6%)出现了与艾司氯胺酮有关的严重不良反应, 包括焦虑、妄想症、谵妄、自杀意念和自杀未遂。 因此, 艾司氯胺酮副作用的短暂性可能比通常用作辅助治疗的非典型抗精神病药物在代谢和锥体外系等方面的副作用更有优势。 尽管如此, 艾司氯胺酮的安全性和有效性尚未在特殊人群如妊娠期、母乳喂养期或18岁以下患者中进行研究和评价。
7 氯胺酮对哺乳和母乳喂养的影响
Suppa等[38]对接受蛛网膜下腔麻醉(0.5%高渗布比卡因8~10 mg和舒芬太尼5 μg)行择期剖宫产的产妇进行一项随机双盲对照研究, 艾司氯胺酮组(n=28)在胎儿娩出后10 min静脉推注咪达唑仑0.02 mg/kg后肌肉注射艾司氯胺酮0.5 mg/kg, 然后以 2 μg/(kg·min)持续输注艾司氯胺酮12 h。 对照组(n=28)接受安慰剂。 术后给予乙酰氨基酚和患者自控静脉注射吗啡镇痛。 结果随访3年后发现, 接受安慰剂的患者平均母乳喂养时间为10.5个月, 而接受艾司氯胺酮的患者平均母乳喂养时间为8个月, 2组间差异无统计学意义。 另外一项随机双盲临床试验中比较了静脉注射氯胺酮(0.25 mg/kg), 丙泊酚(0.25 mg/kg), 氯胺酮+丙泊酚(25 mg氯胺酮+25 mg 丙泊酚)和安慰剂(生理盐水)对择期剖宫产术后产妇疼痛控制的效果, 4组均在脐带夹闭后立即给予一次剂量, 结果发现术后到第1次母乳喂养的时间安慰剂组为58 min, 丙泊酚组为42.6 min, 氯胺酮组为31.9 min, 氯胺酮+丙泊酚组为25.8 min, 氯胺酮+丙泊酚组和氯胺酮组明显早于其他 2组[39], 差异有统计学意义, 进一步表明氯胺酮对母乳喂养无不良影响。
8 展望
综上所述, 已获FDA批准的新型制剂艾司氯胺酮, 消除了在某些临床环境中使用氯胺酮相关的不确定性, 特别是在精神药物不良反应方面具有全新的意义, 因而艾司氯胺酮在PPD防治方面可能是一种有前途的药物, 未来具有更大的应用前景。 尽管氯胺酮与艾司氯胺酮在MDD防治领域具有诸多优势, 但目前国内外对于氯胺酮与艾司氯胺酮在PPD方面的应用研究不多, 建议下一步应继续开展前瞻性、大样本、多中心的随机对照研究, 利用氯胺酮与艾司氯胺酮的药理学特点在PDD防治领域的应用积累更多临床经验。

