成人可逆性胼胝体压部病变综合征临床分析
涂琪 吴成斯
可逆性胼胝体压部病变综合征(RESLES)是一种由多种病因引起的仅累及胼胝体压部的临床影像 综 合 征 ,由 Garcia⁃Monco 等[1]于 2011 年 首 次 提出。可逆性胼胝体压部病变综合征最常发生于抗癫药物(AEDs)戒断后,脑炎、癫发作也为其致病原因,还有部分由代谢性疾病引起,如低血糖、低钠血症、高钠血症等,通常预后良好。胼胝体压部病变在MRI上表现为扩散加权成像(DWI)高信号、表观扩散系数(ADC)低信号,系细胞毒性水肿形成所致[2⁃3],但细胞毒性水肿形成机制目前尚不十分清楚,髓鞘兴奋毒性水肿、水电解质失衡、短暂性炎症反应等均可导致细胞毒性水肿。本研究回顾总结南昌大学第一附属医院诊断与治疗的23例可逆性胼胝体压部病变综合征患者的临床特点、实验室和影像学表现、治疗及预后,并探讨可逆性细胞毒性水肿形成的作用机制。
临床资料
一、病例选择
1.纳入与排除标准 (1)符合由Garcia⁃Monco等[1]提出的可逆性胼胝体压部病变综合征诊断标准:病灶位于胼胝体压部,且有局限性、可逆性特点。(2)年龄>14岁。(3)排除急性播散性脑脊髓炎,常见的累及胼胝体压部的脱髓鞘病变,严重心脏、肺、肾脏等疾病,以及相关实验室或影像学检查不全的患者。
2.一般资料 选择2017年1月至2019年5月在南昌大学第一附属医院神经内科住院治疗的可逆性胼胝体压部病变综合征患者共23例,男性11例,女性12例;发病年龄14~ 64岁,平均为32岁;临床主要表现为发热占56.52%(13/23)、头痛占34.78%(8/23)、抽搐占 30.43%(7/23)、乏力占 26.09%(6/23)、头晕占 21.74%(5/23)、意识障碍占 13.04%(3/23)、视物模糊占 8.69%(2/23),以及幻听、幻视、呃逆、呕吐、晕厥、咳嗽各占4.35%(1/23);既往合并高血压3例(13.04%),糖尿病1例(4.35%),癫1例(4.35%),头痛 1例(4.35%),类风湿关节炎 1例(4.35%),脑肿瘤切除术后 1例(4.35%),余 15例(65.22%)既往史无特殊;神经系统体格检查脑膜刺激征均呈阴性。23例可逆性胼胝体压部病变综合征患者的临床资料参见表1。
二、实验室检查
1.血清学检查 本研究23例患者均进行血清学检查,主要包括血常规、肝肾功能、电解质、血脂、血糖、心肌酶谱等。结果显示,仅1例(例11)电解质检测提示低钠血症,血清钠离子为129.20 mmol/L(137~ 147 mmol/L);23例肝功能试验均存在不同程度的白蛋白水平降低或正常参考值下限(正常参考值40~ 55 g/L),为28.50~ 40.00 g/L。11例患者行血清抗核抗体(ANA)谱检测,其中1例(例17)PM⁃SCL抗体阳性。有10例患者行ANA核颗粒型和核着丝点型检测,均呈阴性(表1)。
2.脑脊液检查 本组有18例患者行腰椎穿刺脑脊液检查,2例脑脊液白细胞计数增加(正常参考值0~ 10/µl),分别为50/µ(l例15)、60/µ(l例8),2例蛋白定量升高(正常参考值150~ 450 mg/L),分别为2207 mg/L(例 3)、1109 mg/L(例 4,表 1);脑脊液Pandy试验、墨汁染色隐球菌检测、葡萄糖、氯化物均未见明显异常。有6例患者行脑脊液自身免疫性脑炎抗体检测,2例患者行脑脊液病原微生物高通量基因检测,均为阴性。
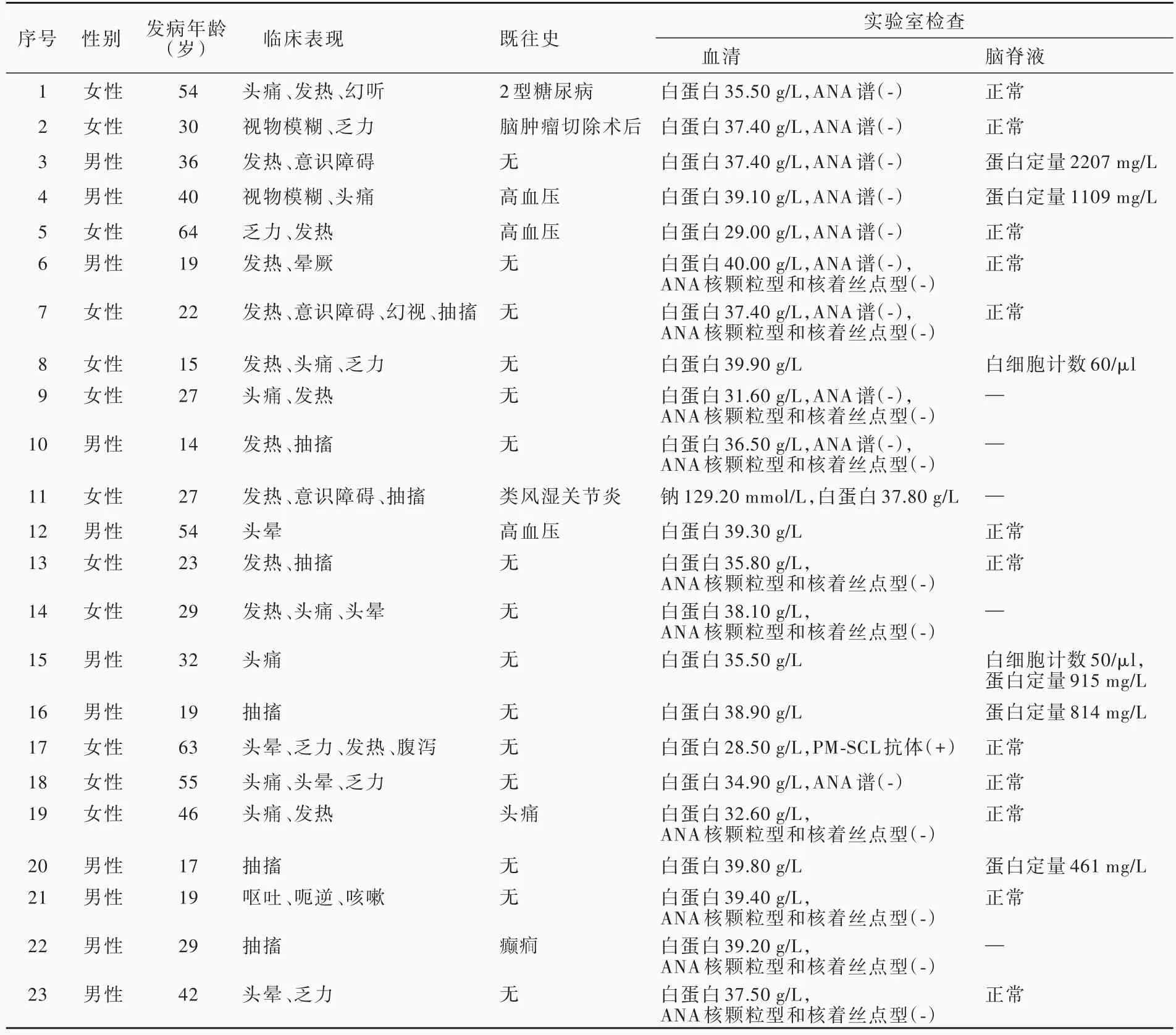
表1 23例可逆性胼胝体压部病变综合征患者的临床特点及实验室检查结果Table 1. Clinical characteristics and laboratory examination results of 23 patients with RESLES
三、影像学检查
本研究23例患者均进行MRI检查,胼胝体压部T1WI呈低或稍低信号、T2WI呈高或稍高信号、DWI高信号、ADC低信号,增强扫描无强化征象(图1a~ 1d)。胼胝体压部异常信号持续时间不等,平均于发病第14天病灶逐渐或完全消失,表现为胼胝体压部T1WI呈稍低或等信号、T2WI呈稍高或等信号、DWI等信号、ADC等信号,或病灶范围较首次MRI检查时缩小(图1e~ 1h)。
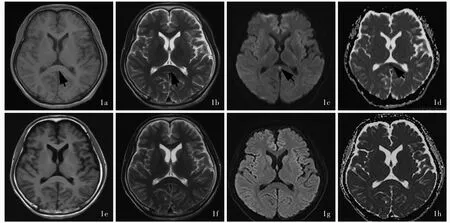
图1 例21患者头部影像学观察所见 1a 横断面T1WI显示胼胝体压部稍低信号影(箭头所示) 1b 横断面T2WI显示胼胝体压部高信号影(箭头所示) 1c 横断面DWI显示胼胝体压部病变呈小片状高信号(箭头所示) 1d 横断面ADC图显示胼胝体压部低信号影(箭头所示) 1e~ 1h 治疗后10 d,横断面T1WI、T2WI、DWI和ADC显示,原胼胝体压部异常信号消失Figure 1 Head MRI findings of Case 21 Axial T1WI showed slight low signal in the corpus callosum(arrow indicates,Panel 1a).Axial T2WI showed high signal in the corpus callosum(arrow indicates,Panel 1b).Axial DWI showed a small pieces of high signal in the corpus callosum(arrow indicates,Panel 1c).Axial ADC showed low signal in the corpus callosum(arrow indicates,Panel 1d).After 10 d of treatment,T1WI,T2WI,DWI,ADC showed that the original lesions of corpus callosum disappeared(Panel 1e-1h).
四、治疗与预后
本研究23例患者均予以静脉滴注阿昔洛韦(0.50 g/次、3次/d)抗病毒治疗以及对症支持治疗,其中13例不能排除合并中枢神经系统感染者联合头孢曲松(1 g/次、2次/d)静脉滴注抗感染治疗,7例癫发作患者联合抗癫药物(丙戊酸钠、卡马西平等)治疗,1例(例22)以呕吐、呃逆起病的患者联合血浆置换疗法(2 d/次×3次),1例(例11)意识障碍患者联合静脉注射免疫球蛋白(20 g/d×5 d)。本组有2例(例3、例4)腰椎穿刺脑脊液检查提示蛋白定量明显升高,考虑合并细菌性脑炎可能,予阿昔洛韦(0.50 g/次、3 次/d)联合头孢曲松(1 g/次、2 次/d)静脉滴注后治愈。1例(例11)意识障碍患者复查头部MRI提示胼胝体压部病灶消失,但仍存在意识障碍,家属放弃治疗自动出院,出院后30 d随访仍无好转。2例(例10、例23)癫发作患者出院后仍间断癫发作,其余患者出院时临床症状均完全缓解,出院后随访30 d无复发。
讨 论
可逆性胼胝体压部病变综合征的临床表现无特异性,其特征性改变为影像学检查可见胼胝体压部病变,故头部MRI检查是诊断的“金标准”。Garcia⁃Monco 等[1]认为,可逆性胼胝体压部病变综合征病因包括发作性疾病、感染、代谢性疾病、药物性及其他不明原因。发作性疾病原因主要包括癫发作和抗癫药物戒断,相比癫发作,可逆性胼胝体压部病变综合征的发生与突然抗癫药物戒断更具相关性。研究表明,几乎所有抗癫药物开始使用或停药时都可能导致胼胝体病变,尤其是卡马西平突然停药[1]。感染原因以流行性感冒病毒感染最为常见,其他还包括轮状病毒、麻疹、EB病毒(EBV)、腺病毒等。代谢性疾病原因主要包括低血糖、低钠血症、高钠血症等。药物性原因常见于一些肿瘤化疗药物的应用,如5⁃氟尿嘧啶、顺铂等,其中顺铂已被证实存在神经系统毒性[4]。可逆性胼胝体压部病变综合征最为常见的神经系统症状为癫发作和意识障碍,多以脑炎、脑病形式起病[1]。本研究23例患者表现形式与之基本相符,本研究有8例患者出现头痛症状,这可能与发热应激性改变,脑炎或脑病导致脑实质水肿、颅内压增高相关,该8例患者头痛症状随治疗而逐渐好转,但头痛并非为可逆性胼胝体压部病变综合征的特异性表现。
MRI是诊断可逆性胼胝体压部病变综合征的重要手段。头部MRI主要表现为胼胝体压部T1WI低或稍低信号、T2WI高或稍高信号、FLAIR成像高或稍高信号、DWI高信号、ADC低信号,增强扫描无强化征象[5]。其病灶形态多为椭圆形或类圆形斑片状,多位于胼胝体压部中间部位,部分可表现为“回旋镖征(boomerang sign)”。影像学异常信号的形成与发病时间间隔为3~ 27天,大多数患者病灶约于1个月内转变为信号降低或消失[6],本组23例患者发病后首次MRI表现与之相一致。
患者头部MRI显示DWI呈高信号和ADC呈低信号,提示细胞外水分子扩散受限,表明胼胝体压部存在细胞毒性水肿[2⁃3],但病变局限于胼胝体压部及其可逆性的原因尚不明确,可能原因为:(1)胼胝体压部是双侧大脑半球最重要的横形联系纤维,主要由白质纤维板构成,此种解剖结构缺乏肾上腺素能受体,故发病时受缺血、缺氧的影响易导致血管舒张障碍和自身调节障碍[7],极易发生细胞毒性水肿;且与周围髓鞘组织相比,胼胝体压部髓鞘含水量多,可能导致水电解质平衡以及离子转运调节机制障碍[8],使水分子扩散受限,细胞外水分子内移减少[9],从而导致髓鞘内水肿。上述原因可能导致病灶局限于胼胝体压部。(2)谷氨酸、天冬氨酸是大脑半数以上突触传递信息的神经递质,也是主要的兴奋性氨基酸。在病理情况下,谷氨酸可以通过激活N⁃甲基⁃D⁃天冬氨酸(NMDA)受体介导神经细胞损伤或死亡。Anneken等[10]对可逆性胼胝体压部病变综合征患者进行DTI检查。结果显示,胼胝体压部细胞毒性水肿属于神经胶质细胞水肿,水肿局限于神经胶质细胞和髓鞘内,不破坏神经纤维。因此,胼胝体压部的损伤导致周围纤维释放谷氨酸,细胞外谷氨酸被髓鞘和神经胶质细胞摄取,导致髓鞘水肿,不至于造成神经细胞能量衰竭,从而避免神经细胞死亡,这可能是水肿具有可逆性的原因。
本组23例患者均存在不同程度血清白蛋白降低,提示血清白蛋白水平变化可能是导致可逆性胼胝体压部病变综合征患者水肿发展的潜在危险因素。可能原因为,血清白蛋白是胶体渗透压(COP)的主要成分,血清白蛋白下降可降低灌注压,引起血管内液体潴留[11]。在正常脑组织中单独胶体渗透压降低不能引起水肿[12],但在炎症过程血管内皮细胞损伤的条件下,胶体渗透压下降有利于液体外渗和水肿形成[13]。而细胞毒性水肿的产生与血管痉挛、血管内皮细胞激活和损伤导致的炎症反应相关[11],故当细胞毒性水肿患者血清白蛋白水平降低时,胶体渗透压下降,在炎症反应的作用下可使液体外渗,从而促进水肿形成。低血清白蛋白可能是反应疾病严重程度的标志物,是可逆性胼胝体压部病变综合征患者胼胝体压部细胞毒性水肿加重的危险因素,但并非主要致病因素。
综上所述,成人可逆性胼胝体压部病变综合征主要由发作性疾病、颅内病毒感染、代谢性相关疾病引起,以癫发作、意识障碍等为主要临床表现,前驱症状可表现为发热、头痛等,发病人群以青年人(≤40岁)为主,预后较好。早期诊断主要依靠头部MRI检查:胼胝体压部T1WI低或稍低信号、T2WI高或稍高信号、DWI高信号、ADC低信号。低血清白蛋白与胼胝体压部可逆性细胞毒性水肿相关,可能为其危险因素。以癫发作或脑病形式起病的成年患者,头部MRI提示胼胝体压部局限性细胞毒性水肿时,均应考虑此病,同时需注意与急性播散性脑脊髓炎、原发性胼胝体变性、可逆性后部脑病综合征(RPES)、胼胝体压部梗死等疾病相鉴别。治疗上以对因治疗为主,血浆置换疗法的效果更佳。建议可逆性胼胝体压部病变综合征患者尽早行血清学检查,如有低蛋白血症应尽早纠正诱因并及时进行补充,可能有助于缩短疾病病程。
利益冲突 无

