槲皮素通过ACE2-Ang-(1-7)-Mas轴对AngⅡ诱导下大鼠心肌收缩蛋白表达的影响
贾梦楠 朱明军 王永霞 李彬 郝轩轩 王新陆 于瑞 常鑫迪 李洁薇






中圖分类号 R96;R541 文献标志码 A 文章编号 1001-0408(2021)23-2839-07
DOI 10.6039/j.issn.1001-0408.2021.23.05
摘 要 目的:探讨槲皮素(Que)通过血管紧张素转换酶2-血管紧张素-(1-7)-Mas轴[ACE2-Ang-(1-7)-Mas轴]对血管紧张素Ⅱ(AngⅡ)诱导下原代大鼠心肌收缩蛋白表达的影响。方法:取1~2 d 日龄大鼠的心肌组织,分离、培养原代心肌细胞,并构建心肌细胞ACE2基因沉默模型。实验分为12组,其中AngⅡ组、AngⅡ+小干扰RNA(siRNA)组、AngⅡ+A779组为模型组,AngⅡ+氯沙坦组为阳性对照组,AngⅡ+Que40组、AngⅡ+Que80组、AngⅡ+siRNA+Que40组、AngⅡ+siRNA+Que80组、AngⅡ+A779+Que40组、AngⅡ+A779+Que80组为实验组,另设空白组、siRNA组。其中AngⅡ终浓度为1×10-6 mol/L,siRNA终浓度为50 nmol/L,Que终浓度分别为40、80 μmol/L,A779(Mas受体拮抗剂)终浓度为1 μmol/L,氯沙坦终浓度为1×10-4 mol/L。分别检测各组心肌细胞中ACE2、Ang-(1-7)、Mas的mRNA和蛋白表达水平,以及Na+/Ca2+交换通道(NCX)、钙泵(SERCA2a)、磷蛋白(PLB)等3种心肌收缩蛋白的表达水平。结果:与AngⅡ组比较,AngⅡ+Que80组细胞中的Mas mRNA表达水平升高(P<0.05);AngⅡ+氯沙坦组细胞中的ACE2、Mas mRNA表达水平升高(P<0.05)。与AngⅡ组比较,AngⅡ+Que40组细胞中的ACE2、Ang-(1-7)蛋白表达水平升高(P<0.05);与AngⅡ+siRNA组比较,仅AngⅡ+siRNA+Que40组Ang-(1-7)蛋白表达水平升高(P<0.05);与AngⅡ+A779组比较,仅AngⅡ+A779+Que40组Ang-(1-7)蛋白表达水平升高(P<0.05)。与AngⅡ组比较,AngⅡ+Que40组NCX蛋白表达水平降低(P<0.05),AngⅡ+氯沙坦组NCX蛋白表达水平降低(P<0.05);与AngⅡ+A779组比较,AngⅡ+A779+ Que80组NCX蛋白表达水平降低(P<0.05)。结论:Que一定程度上提高了AngⅡ诱导大鼠心肌细胞模型中ACE2-Ang-(1-7)-Mas轴的表达,从而调节心肌收缩蛋白。
关键词 槲皮素;血管紧张素转换酶2-血管紧张素(1-7)-Mas轴;心肌细胞;血管紧张素Ⅱ;心肌收缩蛋白
Effects of Quercetin on the Expression of Ang Ⅱ-induced Myocardial Contractile Protein of Rats through ACE2-Ang-(1-7)-Mas Axis
JIA Mengnan1,ZHU Mingjun2,WANG Yongxia2,LI Bin2,HAO Xuanxuan1,WANG Xinlu2,YU Rui2,CHANG Xindi1,LI Jiewei1(1. Henan University of Chinese Medicine, Zhengzhou 450046, China; 2. Heart Center, the First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450099, China)
ABSTRACT OBJECTIVE: To investigate the effects of quercetin (Que) on the expression of angiotensin Ⅱ (AngⅡ)-induced myocardial contractile proteins of primary rats through angiotensin-converting enzyme 2-angiotensin-(1-7)-Mas (ACE2-Ang-(1-7)-Mas) axis. METHODS: Cardiac tissue of rats aged 1-2 d were collected, and primary cardiomyocytes were isolated and cultured. The gene silencing model of cardiomyocytes ACE2 was constructed. Experiments were divided into 12 groups. Among them, AngⅡ group, AngⅡ+ small interference RNA (siRNA) group, and AngⅡ+ A779 group were the model groups; AngⅡ+losartan group was positive control group; AngⅡ+Que40 group, AngⅡ+Que80 group, AngⅡ+siRNA+Que40 group, AngⅡ+siRNA+Que80 group, AngⅡ+A779+Que40 group and AngⅡ+A779+Que80 group were the experimental groups; blank group and siRNA group were set up. AngⅡ concentration was 1×10-6 mol/L; siRNA final concentration was 50 nmol/L; Que concentration was 40 and 80 μmol/L; A779 (Mas receptor inhibitor) concentration was 1 μmol/L; losartan concentration was 1×10-4 mol/L. mRNA and protein expression of ACE2, Ang-(1-7) and Mas in primary cardiomyocytes were detected; the expressions of myocardial contractile proteins were also determined, such as Na+/Ca2+ exchange channel (NCX), calcium pump (SERCA2a), phosphoprotein (PLB). RESULTS: Compared with AngⅡ group, mRNA expression of Mas was increased significantly in AngⅡ+Que80 group (P<0.05); mRNA expression of ACE2 and Mas were increased significantly in AngⅡ+ losartan group (P<0.05). Compared with AngⅡ group, the protein expression of ACE2 and Ang-(1-7) were increased significantly in AngⅡ+Que40 group (P<0.05); compared with AngⅡ+siRNA group, the protein expression of Ang-(1-7) were increased significantly in AngⅡ+ siRNA+Que40 group (P<0.05); compared with AngⅡ+A779 group, the protein expression of Ang-(1-7) were increased significantly in AngⅡ+A779+ Que40 group (P<0.05). Compared with AngⅡ group, the protein expression of NCX was decreased in AngⅡ+Que40 group (P<0.05), protein expression of NCX was reduced in AngⅡ+losartan group (P<0.05); compared with AngⅡ+A779 group, the protein expression of NCX was decreased in AngⅡ+A779+ Que80 group (P<0.05). CONCLUSIONS: Que improves the expression of AngⅡ-induced ACE2-Ang-(1-7)-Mas axis in cardiomyocyte model to some extent, so as to regulate myocardial contractile protein.
KEYWORDS Quercetin; ACE2-Ang-(1-7)-Mas axis; Cardiomyocytes; Angiotensin Ⅱ; Myocardial contractile protein
心力衰竭是多种心脏疾病的终末期阶段,其主要的病理特征是心肌收缩力下降和心功能降低[1]。肾素-血管紧张素(RAS)系统是广泛存在于心血管循环的体液调节系统,其过度激活是导致心力衰竭进展的关键环节。血管紧张素转换酶-血管紧张素Ⅱ-血管紧张素Ⅱ1型受体轴(ACE-AngⅡ-AT1R轴)是RAS系统的重要组成部分;其中AngⅡ是关键因子,可引起心肌收缩力下降等多种心血管系统不良反应[2]。近年来有研究发现,RAS系统中的血管紧张素转换酶2-血管紧张素-(1-7)- Mas轴[ACE2-Ang-(1-7)-Mas轴]可拮抗ACE-AngⅡ- AT1R轴;其中ACE2是关键因子,它可有效地将AngⅡ降解为Ang-(1-7),后者与其特异性受体Mas结合从而抑制ACE-AngⅡ-AT1R轴造成的不良反应,增加心肌收缩力[3]。
心肌收缩力与Ca2+循环有着密切联系,Na+/Ca2+交换通道(NCX)、钙泵(SERCA2a)、磷蛋白(PLB)是心肌细胞中调节心肌收缩力的主要蛋白:NCX能够交换细胞内外的Na+和Ca2+从而维持细胞内的Ca2+稳态[4];SERCA2a是介导心肌细胞Ca2+重新进入肌浆网的关键蛋白,可将细胞质中的Ca2+重新摄取到肌浆网中,使心肌细胞松弛,从而维持细胞内Ca2+稳态[5];PLB可影响SERCA2a与Ca2+的亲和力进而调节Ca2+的摄取,主要通过SERCA2a发挥作用[6]。上述心肌收缩蛋白通过调控心肌细胞内Ca2+稳态来保持心肌收缩力,其异常表达是心功能降低和心室重构的重要原因[7]。
槲皮素(quercetin,Que)是天然黄酮类物质,具有抗炎、抗增殖、抗动脉粥样硬化等多种生物学活性[8-9]。有研究发现,Que可调节心肌收缩蛋白、维持细胞内Ca2+稳态、改善心肌收缩力[10],但其是否可通过作用于ACE2-Ang-(1-7)-Mas轴来影响心肌收缩蛋白的表达,尚不明确。本研究采用RNA干扰的方法沉默ACE2基因来阻断ACE2-Ang-(1-7)-Mas轴上游,以探讨Que是否通过该信号轴调控心肌收缩蛋白;并使用Mas受体的特异性拮抗剂A779同Ang-(1-7)竞争性地与Mas结合来阻断该信号轴下游[11],以进一步验证Que是否通过该信号轴调控心肌收缩蛋白。
1 材料
1.1 主要仪器
本研究使用的主要仪器包括SpectraMax M3型酶标仪(美国Molecular Devices公司),ROC-3000TVBB型CO2培养箱(美国Revco公司),LDZ5-2型低速自动平衡离心机(北京雷勃尔医疗器械有限公司),DMI3006型倒置荧光显微镜(德国Leica公司),CK40型倒置相差显微镜(日本Olympus公司),Alpha 1106分光光度计(上海谱元仪器有限公司),164-5050电泳仪、Mini-Protean垂直电泳槽、Mini Trans-Blot转印电泳仪(美国Bio-Rad公司),Biofuge Stratos型臺式高速冷冻离心机(美国Thermo Fisher Scientific公司),FC-96G 聚合酶链式反应(PCR)仪(杭州比格飞序生物科技有限公司),ABI 7500 Fast型荧光定量PCR仪(美国Applied Biosystems公司)。
1.2 主要药品与试剂
本研究使用的主要药品包括:Que(上海麦克林生化科技有限公司,批号Q817161),A779(南京肽业生物科技有限公司,批号NJP90025-181225),氯沙坦对照品(美国Sigma-Aldrich公司,批号124750-99-8),AngⅡ(美国Sigma公司,批号4474-91-3)。本研究使用的主要试剂包括:胎牛血清(以色列Bioland公司,批号04-001-1A),DMEM培养基、胶原酶Ⅱ、4%组织细胞固定液、二甲基亚砜、CCK-8试剂盒、胰蛋白酶-乙二胺四乙酸消化液、蛋白酶抑制剂、BCA蛋白浓度检测试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶制备试剂盒、溴脱氧尿嘧啶核苷(BrdU)(北京索莱宝科技有限公司,批号分别为12100、C8150、P1110、D8371、CA1210、20190606、P0100、PC0020、P1200、IB0260),RIPA细胞裂解液(美国Thermo Fisher Scientific公司,批号OC183166),Trizol试剂(美国Ambion Life公司,批号103105), INTERFERin®转染试剂(法国Polyplus Transfection公司,批号PT-409-10),Opti-MEMTM培养基(美国Gibco公司,批号31985062),甘油醛-3-磷酸脱氢酶(GAPDH)兔多克隆抗体(武汉三鹰生物技术有限公司,批号10494-1-AP),ACE2兔多克隆抗体、NCX小鼠单克隆抗体、SERCA2a兔多克隆抗体、PLB兔多克隆抗体(美国GeneTex公司,批号分别为GTX101395、GTX22869、GTX22861、TX109254),Ang-(1-7)兔多克隆抗体(武汉优尔生商贸有限公司,批号PAS085Ra01),Mas兔多克隆抗体、反转录试剂盒(美国Invitrogen公司,批号分别为PA5-43668、4368814),PVDF膜(美国Millipore公司,批号ISEQ00010)。
1.3 实验动物
本研究所用实验动物为健康SPF级SD大鼠,日龄1~2 d,体质量约5 g。大鼠购自河南省实验动物中心,生产许可证号为SCXK(豫)2017-0001。所有实验过程按照河南中医药大学实验动物伦理委员会指导规定进行(伦理号YFYDW2018004)。
2 实验方法
2.1 原代心肌细胞的分离
取日龄1~2 d的大鼠置于超净台下,以乙醇消毒后开胸取心室部分组织,以预冷灭菌的磷酸盐缓冲液反复冲洗后,剪成1~2 mm3大小组织块;加入15 mL心肌细胞消化液,将组织转移至灭菌过的50 mL玻璃瓶中搅拌10 min;静置,弃上清液,加入10 mL 0.1% 胶原酶Ⅱ继续消化10 min;静置,抽取上清液,加入10%胎牛血清的含双抗DMEM培养基(以下简称“全培养基”)制成细胞悬液,暂置于37 ℃培养箱。共消化4~5次,直至组织块消失。收集合并细胞悬液于15 mL 离心管中,以1 200 r/min离心10 min,弃上清液,收集细胞沉淀并轻轻吹打,过200目细胞筛网。将所得细胞接种于培养瓶中,置于37 ℃细胞培养箱中差速贴壁培养1.5 h,所得悬浮细胞为心肌细胞,贴壁细胞为成纤维细胞[12]。
2.2 原代心肌细胞的培养
收集“2.1”项下分离的心肌细胞于15 mL离心管中,以1 200 r/min离心10 min,弃上清液,加入完全培养基,按1×105 mL-1密度接种于6孔板或96孔板,加入BrdU抑制成纤维细胞的生长;24 h后观察,心肌细胞已贴壁生长;更换完全培养基,加入BrdU抑制成纤维细胞的生长;继续培养24 h后,观察可见细胞已成细胞簇,且搏动明显、节律一致,可用于后续基因沉默、加药等实验[12]。
2.3 原代心肌细胞ACE2基因沉默模型的构建
取“2.2”项下心肌细胞,更换含10%胎牛血清不含双抗的DMEM培养基,继续培养2 h后进行细胞转染以沉默ACE2基因。将第2代心肌细胞以1×105 mL-1的密度接种于6孔板中,以完全培养基于37 ℃下培养24 h后,观察可见心肌细胞融合至60%~70%;更換为含10%胎牛血清不含双抗的DMEM培养基,继续培养2 h后进行细胞转染。具体转染步骤为:①将11 μL小干扰RNA(siRNA)加入到200 μL Opti-MEMTM培养基(siRNA终浓度为50 nmol/L),于室温涡旋5 s,瞬时离心;加入10 μL INTERFERin® 转染试剂,于室温混匀10 s,瞬时离心,再于37 ℃下孵育10 min。②加入完全培养基,每孔2 mL。③将“①”项下配制好的液体加入到6孔板中,轻晃摇匀,置于37 ℃培养箱中培养24 h后,于荧光显微镜下观察转染情况。成功转染的细胞由绿光激发出红色荧光(发射光波长为480 nm,激发光波长为525 nm)。计数荧光阳性细胞数作为心肌成纤维细胞数(n),镜下细胞总数为N,按公式计算转染率:转染率(%)=n/N×100%。若转染率>60%即为转染成功[13],表示成功构建原代心肌细胞ACE2基因沉默模型。
2.4 实验分组及干预方法
实验分为12组,其中AngⅡ组、AngⅡ+siRNA组、AngⅡ+A779组为模型组,AngⅡ+氯沙坦组为阳性对照组,AngⅡ+Que40组、AngⅡ+Que80组、AngⅡ+siRNA+Que40组、AngⅡ+siRNA+Que80组、AngⅡ+A779+ Que40组、AngⅡ+A779+Que80组为实验组,另设空白组、siRNA组。空白组:心肌细胞常规培养。AngⅡ组:心肌细胞常规培养,加入AngⅡ。siRNA组:心肌细胞常规培养,按“2.3”项下方法沉默ACE2基因。AngⅡ+siRNA组:心肌细胞常规培养,按“2.3”项下方法沉默ACE2基因后,加入AngⅡ。AngⅡ+Que40组:心肌细胞常规培养,加入AngⅡ、Que(40 μmol/L)。AngⅡ+Que80组:心肌细胞常规培养,加入AngⅡ、Que(80 μmol/L)。AngⅡ+siRNA+Que40组:心肌细胞常规培养,按“2.3”项下方法沉默ACE2基因后,加入AngⅡ、Que(40 μmol/L)。AngⅡ+siRNA+Que80组:心肌细胞常规培养,按“2.3”项下方法沉默ACE2基因后,加入AngⅡ、 Que(80 μmol/L)。AngⅡ+A779组:心肌细胞常规培养,加入AngⅡ、A779。AngⅡ+A779+Que40组:心肌细胞常规培养,加入AngⅡ、 A779、 Que(40 μmol/L)。AngⅡ+ A779 + Que80组:心肌细胞常规培养,加入AngⅡ、 A779、Que(80 μmol/L)。AngⅡ+氯沙坦组:心肌细胞常规培养,加入AngⅡ、氯沙坦(1×10-4 mol/L)。基于文献研究及前期预实验,通过CCK-8试剂盒梯度检测心肌细胞活性的方法筛选AngⅡ、siRNA、A779、Que的适宜浓度,最终确定以AngⅡ终浓度为1×10-6 mol/L、siRNA终浓度为50 nmol/L、A779终浓度为1 μmol/L、Que终浓度为40 μmol/L及其2倍浓度80 μmol/L进行本实验。实验组心肌细胞在常规培养及沉默ACE2基因后无血清同步化24 h,加入干预药物后继续培养24 h。
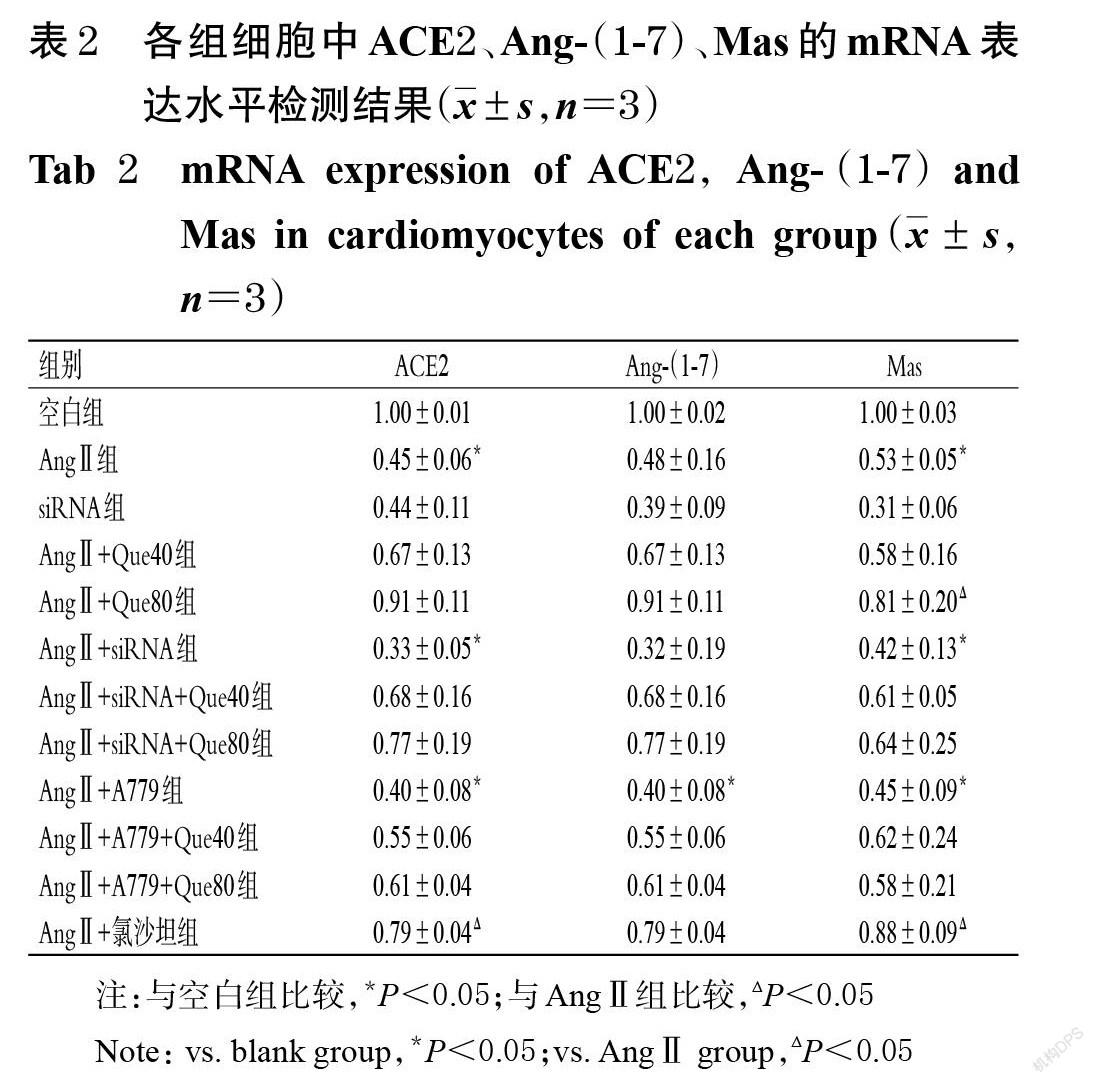
2.5 各组细胞中ACE2、Ang-(1-7)、Mas mRNA表达水平的检测
采用PCR法进行检测。取心肌细胞,按“2.4”项下方法分组干预后,以TRIzol法提取总RNA,按照反转录试剂盒说明书反转录成cDNA,再以GAPDH作为参照,在ABI 7500 Fast型PCR仪上进行实时荧光定量 PCR反应(PCR引物序列和产物长度见表1),重复3次。
2.6 各组细胞中ACE2、Ang-(1-7)、Mas及心肌收缩蛋表达水平的检测
采用Western blot进行检测。取心肌细胞,按照“2.4”项下方法分组干预后,用磷酸盐缓冲液清洗,加入RIPA裂解液适量于冰上孵育5 min;将裂解后的样品以12 000 r/min离心5 min,取适量上清液通过考马斯亮蓝法测定蛋白浓度,余上清液加入适量SDS-PAGE上样缓冲液,于100 ℃变性5 min。取变性后的蛋白样品适量,行15% SDS-PAGE;电泳后转膜,以脱脂奶粉封闭2 h,加入内参蛋白和各目的蛋白的一抗进行杂交(各一抗稀释度:GAPDH为1 ∶ 5 000,ACE2为1 ∶ 1 000,Ang-(1-7)为1 ∶ 500,Mas为1 ∶ 800,NCX为1 ∶ 1 000,SERCA2a为1 ∶ 1 000,PLB为1 ∶ 5 000),于4 ℃下孵育过夜;依次用 TBST溶液、TBS溶液在室温下洗涤10 min×2次、10 min×1次后,加入HRP标记羊抗鼠IgG 或HRP标记的山羊抗兔IgG作为二抗(稀释度均为1 ∶ 1 000),于室温孵育1 h;依次用TBST溶液、TBS溶液在室温下洗涤5 min×2次、5 min×1次后,以AP-NBT/BICT显色液显色,然后置于凝胶成像系统上成像。使用 Image J软件分析,以ACE2、Ang-(1-7)、Mas、 NCX、SERCA2a、PLB与内参蛋白GAPDH 的灰度值比值表示上述目的蛋白的表达水平。
2.7 统计学方法
采用SPSS 23.0统计软件进行数据分析。实验数据以x±s表示,多组间比较采用单因素方差分析,进一步组间比较采用Dunnett-t检验。检验水准α=0.05。
3 结果
3.1 原代心肌细胞ACE2基因沉默情况
荧光显微镜观察结果显示,转染的原代心肌细胞发出红色荧光,转染率>60%,表明实验成功构建了原代心肌细胞ACE2基因沉默模型,可用于后续实验。ACE2基因沉默模型原代心肌细胞转染的荧光显微图见图1。
3.2 各组细胞中ACE2、Ang-(1-7)、Mas的mRNA表達水平比较
与空白组比较,AngⅡ组和AngⅡ+ siRNA组细胞中ACE2、Mas以及AngⅡ+A779组细胞中ACE2、Ang-(1-7)、Mas的mRNA表达水平均显著降低(P<0.05)。与AngⅡ组比较,AngⅡ+Que80组细胞中的Mas mRNA表达水平显著升高(P<0.05);AngⅡ+氯沙坦组细胞中的ACE2、Mas mRNA表达水平均显著升高(P<0.05)。各组细胞ACE2、Ang-(1-7)、Mas的mRNA表达水平检测结果见表2。
3.3 各组细胞中ACE2、Ang-(1-7)、Mas的蛋白表达水平比较
与空白组比较,AngⅡ组、AngⅡ+ siRNA组和AngⅡ+A779组细胞中ACE2、Ang-(1-7)蛋白表达水平均显著降低(P<0.05)。与AngⅡ组比较,AngⅡ+Que40组细胞中ACE2、Ang-(1-7)蛋白表达水平均显著升高(P<0.05)。与AngⅡ+siRNA组比较,仅AngⅡ+siRNA+ Que40组细胞中Ang-(1-7)蛋白表达水平显著升高(P<0.05)。与AngⅡ+A779组比较,仅AngⅡ+A779+ Que40组细胞中Ang-(1-7)蛋白表达水平显著升高(P<0.05)。各组细胞ACE2、Ang-(1-7)、Mas蛋白表达水平检测结果及电泳图见表3、图2。
3.4 各组细胞中心肌收缩蛋白表达水平比较
与空白组比较,AngⅡ组细胞中NCX蛋白表达水平显著升高(P<0.05);AngⅡ+ siRNA组细胞中PLB、SERCA2a蛋白表达水平均显著降低,NCX蛋白表达水平显著升高(P<0.05);AngⅡ+A779组细胞中SERCA2a蛋白表达水平显著降低,NCX蛋白表达水平显著升高(P<0.05)。与AngⅡ组比较,AngⅡ+Que40组细胞中NCX蛋白表达水平显著降低(P<0.05);AngⅡ+氯沙坦组细胞中NCX蛋白表达水平显著降低(P<0.05)。与AngⅡ+A779组比较,AngⅡ+A779+Que80组细胞中NCX蛋白表达水平显著降低(P<0.05)。各组细胞中NCX、SERCA2a、PLB的蛋白表达水平检测结果及电泳图见表4、图3。
4 讨论
正常情况下,RAS系统中ACE-AngⅡ-AT1R轴和ACE2-Ang-(1-7)-Mas轴处于动态平衡中;当发生心力衰竭时,AngⅡ活性的增加使心肌细胞肥大、凋亡,最终导致心脏重构。研究表明,心力衰竭模型大鼠心肌细胞基础收缩力、舒张力及Ca2+浓度均降低,AngⅡ刺激的心肌细胞功能和Ca2+浓度反应明显减弱[14]。心脏中的正性肌力是通过细胞内Ca2+的变化调节的,即Ca2+浓度变化介导了心肌的兴奋-收缩偶联机制,而Ca2+的浓度变化与PLB、SERCA2a、NCX蛋白密切相关[15]。发生心力衰竭以后,AT1R数量的改变、AngⅡ-AT1R介导的Ca2+浓度变化及信号转导的改变等因素导致心脏对AngⅡ刺激的收缩反应发生改变。AngⅡ通过AT1R与几种酪氨酸激酶相互作用,AT1R介导的AT1通路因细胞类型不同而不同,加剧Ca2+稳态失调,这可能是心力衰竭发生后心肌收缩力和舒张力效应改变的原因[16]。ACE2-Ang-(1-7)-Mas轴在心力衰竭过程中可改变心肌收缩力。有研究表明,ACE2基因缺失的小鼠心肌收缩力受损[17]。Ang-(1-7)的积聚与左心室舒张末压升高直接相关,能增加细胞内钙电流参与Ca2+稳态和心肌收缩力的调节[18-19]。敲除Mas基因的小鼠心功能下降,钙电流峰值时间延长[20-21]。
Que的生物学活性可能与RAS系统有关。有研究表明,Que可通过降低ACE的mRNA表达水平,抑制ACE活性,从而阻断RAS系统的信号传导[22]。给予Que处理的大鼠,其ACE的作用明显被抑制;给予一定浓度的Que可以降低AngⅠ引起的高血压反应[23]。Que还可改善AngⅡ诱导的原代大鼠心肌细胞及H9C2心肌细胞株的细胞肥大[24-25],抑制氧化应激,改善线粒体功能,保护阿霉素诱导的心脏损伤[26]。Que亦可抑制心肌细胞缺氧损伤从而减少心肌细胞凋亡,维持存活的心肌细胞数量[27-28]。研究表明,Que在低浓度时抑制PLB的活性,在较高浓度时竞争性地抑制SERCA2a的活性,从而刺激离体心肌细胞肌浆网的SERCA2a活性[10]。另有研究表明,Que的变力作用与洋地黄类似,通过抑制肌膜上的Na+/K+-ATP酶而增强钙瞬变,进而通过减少质膜上的Na+/Ca2+交换而抑制细胞质Ca2+的排出,增强心肌细胞肌节缩短的幅度和心肌肌丝的收缩性,从而对心肌细胞产生正性肌力作用[29-30]。
本研究结果显示,在AngⅡ诱导后的心肌细胞中加入Que后,细胞中ACE2-Ang-(1-7)-Mas轴上各mRNA及蛋白表达增加,心肌收缩蛋白表达水平也相应发生变化,提示Que可以提高AngⅡ诱导ACE2-Ang-(1-7)-Mas轴的表达并调节心肌收缩蛋白。ACE2基因被沉默后,ACE2-Ang-(1-7)-Mas轴在上游被阻断,轴上各mRNA及蛋白表达水平降低;Que加入后,其提高ACE2-Ang-(1-7)-Mas轴上各mRNA及蛋白表达的能力降低,多数指标差异无统计学意义(P>0.05),从该信号轴上游验证了Que可通过此轴调节心肌收缩蛋白。A779竞争性地与Mas受体结合从而阻断ACE2-Ang-(1-7)-Mas轴下游,轴上各mRNA及蛋白表达降低;Que加入后,其提高ACE2-Ang-(1-7)-Mas轴上各mRNA及蛋白的表达能力降低,多数指标差异无统计学意义(P>0.05),从轴下游验证了Que可通过该信号轴调节心肌收缩蛋白。本研究在沉默ACE2基因及Mas受体阻断后加入Que,ACE2-Ang-(1-7)-Mas轴上各mRNA及蛋白表达仍有所增加。分析原因,一是由于细胞未全部转染成功仅为部分阻断;二是Que可能通过其他途径发挥作用,但此推测仍需进一步研究证实。
本研究通过阻断ACE2-Ang-(1-7)-Mas轴的不同部位,验证了Que能够改善ACE2-Ang-(1-7)-Mas轴上各mRNA及蛋白的表达,进而调控心肌收缩蛋白。但本研究仍存在一定局限性:(1)由于样本量较小,标准差较大,导致具有统计学差异的结果较少;(2)本研究为离体实验,重在研究Que通过ACE2-Ang-(1-7)-Mas轴调控心肌收缩蛋白,未检测与心肌收缩力相关的Ca2+浓度;(3)基因沉默及药物阻断仅为部分阻断,导致结果有所偏差。以上问题仍需进一步实验研究完善。
参考文献
[ 1 ] 中华医学会心血管病学分会心力衰竭学组,中国医师协会心力衰竭专业委员会,中华心血管病杂志编辑委员会.中国心力衰竭诊断和治疗指南2018[J].中华心血管病杂志,2018,46(10):760-789.
[ 2 ] 史建平,陈宝华,王旭,等.真武汤合葶苈大枣泻肺汤对肺心病急性发作期血NT-proBNP影响的临床研究[J].江苏中医药,2015,47(6):38-39.
[ 3 ] ZHANG X,CHENG H J,ZHOU P,et al. Cellular basis of angiotensin-(1-7)-induced augmentation of left ventricular functional performance in heart failure[J]. Int J Cardiol,2017,236:405-412.
[ 4 ] LU Z,CUI Y,WEI X,et al. Deficiency of PKD2L1 (TRPP3) exacerbates pathological cardiac hypertrophy by augmenting NCX1-mediated mitochondrial calcium overload[J]. Cell Rep,2018,24(6):1639-1652.
[ 5 ] SAMUEL T J,ROSENBERRY R P,LEE S,et al. Correc- ting calcium dysregulation in chronic heart failure using SERCA2a gene therapy[J]. Int J Mol Sci,2018,19(4):1086.
[ 6 ] TANAKA Y,HONDA T,MATSUURA K,et al. In vitro selection and characterization of DNA aptamers specific for phospholamban[J]. J Pharmacol Exp Ther,2009,329(1):57-63.
[ 7 ] NIE J,DUAN Q,HE M,et al. Ranolazine prevents pressure overload-induced cardiac hypertrophy and heart failure by restoring aberrant Na+ and Ca2+ handling[J]. J Cell Physiol,2019,234(7):11587-11601.
[ 8 ] KLEEMANN R,VERSCHUREN L,MORRISON M,et al. Anti-inflammatory,anti-proliferative and anti-atherosclerotic effects of quercetin in human in vitro and in vivo models[J]. Atherosclerosis,2011,218(1):44-52.
[ 9 ] CHEN J Y,HU R Y,CHOU H C. Quercetin-induced cardio- protection against doxorubicin cytotoxicity[J]. J Biomed Sci,2013,20(1):95-101.
[10] MCKENNA E,SMITH J S,COLL K E,et al. Dissociation of phospholamban regulation of cardiac sarcoplasmic reticulum Ca2+ ATPase by quercetin[J]. J Biol Chem,1996,271(40):24517-24525.
[11] SANTOS R A,CAMPAGNOLE-SANTOS M J,BARACHO N C,et al. Characterization of a new angiotensin antagonist selective for angiotensin-(1-7):evidence that the actions of angiotensin-(1-7) are mediated by specific angiotensin receptors[J]. Brain Res Bull,1994,35(4):293-298.
[12] 李彬,王新陸,谢世阳,等.参附益心方对缺氧原代心肌细胞活性氧和能量代谢的影响[J].中国药房,2019,30(8):1018-1024.
[13] 杨勇,周勇,佟新竹,等. RNA干扰沉默血管紧张素转化酶调节血管紧张素2-血管紧张素1-7肽-胞外信号调节激酶轴改善人脐静脉内皮细胞功能[J].华南国防医学杂志,2015,29(7):507-511.
[14] LI T K,ZHANG X W,CHENG H J,et al. Critical role of the chymase/angiotensin-(1-12) axis in modulating cardiomyocyte contractility[J]. Int J Cardiol,2018,264:137-144.
[15] DE MELLO W C. Intracellular angiotensin Ⅱ disrupts chemical communication and impairs metabolic cooperation between cardiac myocytes[J]. Peptides,2015,72:57- 60.
[16] ZHOU P,CHENG C P,LI T,et al. Modulation of cardiac L-type Ca2+ current by angiotensin-(1-7):normal versus heart failure[J]. Ther Adv Cardiovasc Dis,2015,9(6):342-353.
[17] CRACKOWER M A,SARAO R,OUDIT G Y,et al. Angiotensin-converting enzyme 2 is an essential regulator of heart function[J]. Nature,2002,417:822-828.
[18] DE MELLO W C. Intracellular angiotensin (1-7) increases the inward calcium current in cardiomyocytes. On the role of PKA activation[J]. Mol Cell Biochem,2015,407(1/2):9-16.
[19] DIAS-PEIXOTO M F,SANTOS R A,GOMES E R,et al. Molecular mechanisms involved in the angiotensin-(1-7)/Mas signaling pathway in cardiomyocytes[J]. Hypertension,2008,52(3):542-548.
[20] WANG Y,SHOEMAKER R,POWELL D,et al. Differential effects of Mas receptor deficiency on cardiac function and blood pressure in obese male and female mice[J]. Am J Physiol Heart Circ Physiol,2017,312(3):H459-H468.
[21] SANTOS R A,CASTRO C H,GAVA E,et al. Impairment of in vitro and in vivo heart function in angiotensin-(1-7) receptor Mas knockout mice[J]. Hypertension,2006,47(5):996-1002.
[22] PARICHATIKANOND W,PINTHONG D,MANGMOOL S,et al. Blockade of the renin-angiotensin system with delphinidin,cyanin,and quercetin[J]. Planta Med,2012,78(15):1626-1632.
[23] GRIENDLING K K,LASSÈGUE B,ALEXANDER R W. Angiotensin receptors and their therapeutic implications[J]. Annu Rev Pharmacol Toxicol,1996,36:28l-306.
[24] YAN L,ZHANG J D,WANG B,et al. Quercetin inhibits left ventricular hypertrophy in spontaneously hypertensive rats and inhibits angiotensin Ⅱ-induced H9C2 cells hypertrophy by enhancing PPAR-gamma expression and suppressing AP-1 activity[J]. PLoS One,2013,8(9):e72548.
[25] CHEN K X,REKEP M,WEI W,et al. Quercetin prevents in vivo and in vitro myocardial hypertrophy through the proteasome GSK-3 pathway[J]. Cardiovasc Drugs Ther,2018,32(1):5-21.
[26] CHEN X,PENG X,LUO Y,et al. Quercetin protects cardiomyocytes against doxorubicin-induced toxicity by suppressing oxidative stress and improving mitochondrial function via 14-3-3γ[J]. Toxicol Mech Methods,2019,29(5):344-354.
[27] JING Z H,WANG Z R,LI X J,et al. Protective effect of quercetin on posttraumatic cardiac injury[J]. Sci Rep,2016,6:30812.
[28] GUO G,GONG L,SUN L,et al. Quercetin supports cell viability and inhibits apoptosis in cardiocytes by down- regulating miR-199a[J]. Artif Cells Nanomed Biotechnol,2019,47(1):2909-2916.
[29] HAYAMIZU K,MORIMOTO S,NONAKA M,et al. Cardiotonic actions of quercetin and its metabolite tamarixetin through a digitalis-like enhancement of Ca2+ transients
[J]. Arch Biochem Biophys,2018,637:40-47.
[30] SANTOS M S,OLIVEIRA E D,SANTOS-MIRANDA A,et al. Dissection of the effects of quercetin on mouse myocardium[J]. Basic Clin Pharmacol Toxicol,2017,120(6):550-559.
(收稿日期:2021-05-15 修回日期:2021-11-08)
(編辑:舒安琴)

