乳化法制备毕赤酵母微胶囊的条件优化
周紫薇,项郑昊,周化岚,张建国
上海理工大学 医疗器械与食品学院 食品科学与工程研究所,上海 200093
毕赤酵母是一种典型的甲基营养型酵母,已成为较成功的外源蛋白表达系统之一[1]。至今已有5 000多种外源蛋白利用毕赤酵母成功表达[2]。目前毕赤酵母表达外源蛋白的过程优化仍呈现多样化的态势,而且过程优化的效果不够明显,其主要原因为采用液体培养的方式研究群体重组毕赤酵母的性能掩盖了菌株之间的差异。而且,不同时间表征的指标来自于不同菌株。为了开展针对同一菌株的外源蛋白表达性能直接、有效地表征外源蛋白表达过程,研制一种无需分离纯化产物、低成本的生化微反应器作为毕赤酵母的外源蛋白表达系统的组成部分具有实际应用意义。
微胶囊(Microcapsules)是应用天然或人工合成的高分子成膜壁材,将固态、液态或气态的物质作为芯材,包裹成具有半通透性或密封的球形微粒,粒径尺寸一般为1 μm ~1000 μm。微胶囊可以隔绝外界不良环境(过高的pH、温度、酶)保护芯材,也可以改善芯材性质(屏蔽气味、毒性、颜色),控制芯材的释放时间等作用。目前,微胶囊已广泛应用于生物医药、化工、食品、农业等领域。微胶囊制备方法分为物理法、化学法和物理化学法三类。物理法通过物理、机械作用将壁材包覆在小分子芯材上,具体有空气悬浮法[3]、溶剂挥发法[4]、喷雾干燥法[5]等。化学法指化合物单体通过聚合反应形成聚合物外壳,再将芯材包覆,例如挤压法、界面缩聚法[6]、原位聚合法等[7]。物理化学法通过添加溶剂(无机盐、非电解质)或调节pH、改变温度等措施调节聚合物溶解度,使聚合物从溶液中析出并沉积在芯材表面,形成微胶囊,例如相分离法[8,9]、层层组装法[10]等。目前制备微胶囊的常用方法有喷雾干燥法、挤压法、乳化法、层层组装法等。其中乳化法通过海藻酸钠与交联剂进行凝胶化得到微胶囊,设备简单,成本低。内源乳化法制备微胶囊的过程中,难溶性钙盐的种类及浓度、乳化过程中水相和油相的体积比、表面活性剂的类型及浓度和油溶性酸的种类及浓度等因素都会影响海藻酸钠微胶囊的包埋效果。对于毕赤酵母微胶囊化而言,碳酸钙、柠檬酸钙、草酸钙、磷酸钙和酒石酸钙都是适用的钙离子载体。其中,碳酸钙是最常用的钙离子载体,其形成的微胶囊成球性好、粒径分布较窄、性质稳定[11]。例如,SONG等通过乳化法制备了酵母微胶囊,粒径为35 μm~863 μm[12]。其中,海藻酸钠微胶囊的粒径是影响芯材性质、微胶囊降解性、芯材与外界进行物质交换,及释放动力学的重要参数。微胶囊的最佳尺寸也根据不同芯材和应用场景的不同而变化。微胶囊粒度分布影响微胶囊体积、密度、流动性、复水性、溶解性和分散性等性质,对芯材的负载、聚集和组织滞留有重要的影响。本研究选用分泌表达绿色荧光蛋白(GFP)的重组毕赤酵母菌株GS115-gfp进行微胶囊的制备的条件优化,为高效表达外源蛋白的重组毕赤酵母筛选奠定基础。
1 材料与方法
1.1 材料
毕赤酵母(Komagataellaphaffii,原名Pichiapastoris)GS115-gfp来自本实验室。
YPD(Yeast Extract Peptone Dextrose Medium)培养基:称取1.0 g酵母粉、2.0 g蛋白胨、2.0 g葡萄糖(如配置固体培养基则再称取2.0 g琼脂粉),加入100 mL去离子水混匀,在115℃条件下高压灭菌15 min,室温保存。
柠檬酸钠溶液(0.06 mol/L):称取1.55 g柠檬酸钠,加入70.0 mL去离子水,混合均匀,定容至100 mL,保存于室温,备用。
G418遗传霉素(100 mg/mL):称取1.0 g G418,加入7.0 mL去离子水,混合均匀,再定容至10 mL,过滤除菌,分装保存于-20 ℃,备用。
碳酸钙溶液:依据使用浓度称取碳酸钙,加入70.0 mL水混合均匀,再定容至100 mL,室温保存。
1.2 方法
1.2.1菌悬液的制备
将冷冻保藏的毕赤酵母GS115-gfp在YPD固体培养基上划线培养,经48 h培养后,挑取单菌落于5 mL 的YPD液体培养基中,在30 ℃、200 r/min下培养24 h,然后按4.0%的接种量转接到5 mL YPD液体培养基中,连续传代2~3次,使菌种完全活化。
将活化好的毕赤酵母GS115-gfp按4.0%的接种量转接到YPD液体培养基中进行增殖培养,20 h后,将处于对数期末期的菌悬液在4 ℃,6 000 r/min的条件下离心10 min,去上清液,菌体沉淀用无菌水洗涤两次后,分散于10 mL无菌水中得到浓缩菌液。
1.2.2海藻酸钠与毕赤酵母生物相容性的测定
配制海藻酸钠质量浓度分别为0%、1%和2%的YPD固体培养基,然后将毕赤酵母GS115-gfp菌液经梯度稀释后,点样于YPD固体培养基中,在30 ℃下培养48 h,统计菌落总数后计算活菌数。
1.2.3单因素优化
将10 mL菌液与20 mL 0.375%海藻酸钠、0.015%碳酸钙混合均匀后,加入70 mL含有1% Span 80 的液体石蜡后搅拌20 min,最后加入 0.5 mL乙酸,搅拌30 min;加水洗涤后得到微胶囊。以液体石蜡为油相,分别考察了水油比为1∶9、2∶8、3∶7、4∶6和1∶1时对形成微胶囊的影响。乙酸添加量的优化考察了钙离子与乙酸的摩尔质量比为1∶1、1∶2、1∶3和1∶4时对形成微胶囊的影响。转速优化实验考察了转速为300 r/min、400 r/min、500 r/min、600 r/min和700 r/min时对形成微胶囊的影响。碳酸钙与海藻酸钠质量比分别考察碳酸钙与海藻酸钠质量比为1∶5、1∶4、1∶3、1∶2、1∶1、2∶1、3∶1和4∶1时对形成微胶囊的影响。表面活性剂(Span 80)添加量的优化考察了Span 80占油相体积0%、1.0%、1.5%和2.0%时对形成微胶囊的影响。
1.2.4响应面优化
基于单因素实验结果,以转速(A)、Span80添加量(B)、水油比(C)为自变量,以微胶囊的粒径和包埋率为响应值,采用Box-Behnken设计响应面分析对乳化法制备毕赤酵母海藻酸钠微胶囊的制备条件进行优化,通过响应面数据的处理分析确定其最佳的制备条件。响应面分析因素与水平设计见表1。
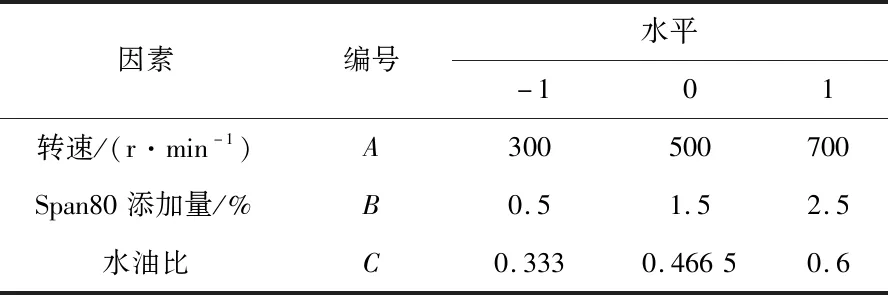
表1 响应面设计因素与水平表
1.3 分析方法
1.3.1毕赤酵母微胶囊粒径分布的测定
将微胶囊置于载玻片上,用生物显微镜进行观察并拍照,使用Image Pro Plus软件测定微胶囊尺寸,并进行粒径分布统计。
1.3.2包埋率的测定
称取1.0 g微胶囊置于10 mL的0.06 mol/L柠檬酸钠溶液中,30 ℃震荡1 h,使海藻酸钠微胶囊溶解并释放包埋的毕赤酵母,采用稀释平板法进行活菌计数。微胶囊的包埋率计算公式如下:

1.3.3毕赤酵母微胶囊的GFP诱导表达
分别设置了甲醇的添加量为0.5%、1.0%和1.5%,在BMMY培养基中培养毕赤酵母微胶囊。
2 结果与分析
2.1 海藻酸钠与毕赤酵母的生物相容性
海藻酸钠与酵母菌的生物相容性决定着酵母菌在微胶囊内的活性。图1为不同海藻酸钠添加量的YPD固体培养基上毕赤酵母GS115-gfp的生长情况。添加了1%和2%的海藻酸钠的培养基中,活菌数分别达到了7.3 lg CFU/mL和7.6 lg CFU/mL,分别为对照组的97.3%和101.3%,说明海藻酸钠与毕赤酵母GS115-gfp生物相容性好(P>0.05)。
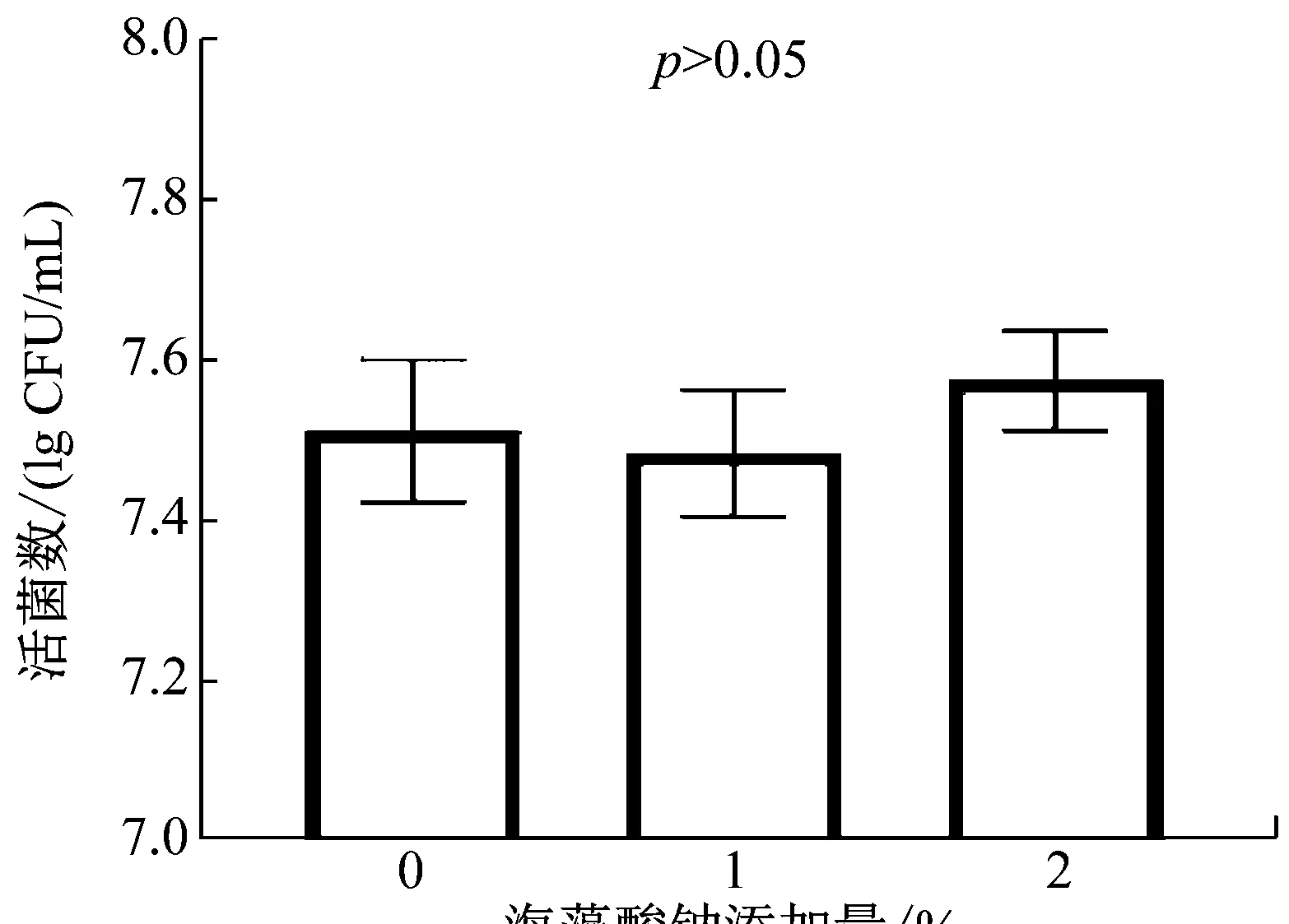
图1 海藻酸钠添加量对毕赤酵母GS115-gfp活细胞数的影响
2.2 乳化法制备毕赤酵母海藻酸钠微胶囊的单因素优化
2.2.1水相和油相体积比(水油比)对微胶囊性质的影响
当水油比小时,单位体积内液体石蜡中分散的海藻酸钠较少,在磁力搅拌的作用下,介质中会产生较小的分散液滴,从而得到粒径较小的海藻酸钠微胶囊。由表2可以看出,随着水油比的增大,微胶囊的平均粒径逐渐增大,在水油比为1∶9时达到最大值,为(417±33)μm。水油比的改变对微胶囊的包埋率没有显著性的影响(P>0.05)。
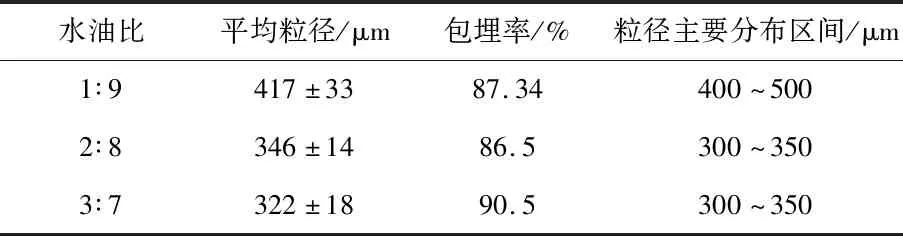
表2 水油比对微胶囊性质的影响
2.2.2乙酸添加量对微胶囊性质的影响
乙酸在乳化法制备微胶囊中起到至关重要的作用,当乙酸的添加量多时,碳酸钙能够释放更多的钙离子,使海藻酸钠形成高强度的海藻酸钠微胶囊,可以提高微胶囊的包埋率,降低微胶囊的粒径,但是在体系中添加过量的乙酸会降低体系的pH,可能会造成体系内酵母菌存活率的下降;当乙酸的添加量少时,碳酸钙释放的钙离子减少,其通过油/水界面的扩散速率降低,碳酸钙释放的钙离子减少,导致无法形成结构致密的海藻酸钠微胶囊。因此,本研究分别考察了钙离子与乙酸的摩尔质量比为1∶1、1∶2、1∶3和1∶4时对微胶囊性质的影响。
由表3可以看出,当钙离子和乙酸的摩尔质量比在的1∶2~1∶4的范围内时,微胶囊的粒径在1∶3时达到最小值,为(359±65)μm,包埋率也达到最高值,为87.6%。
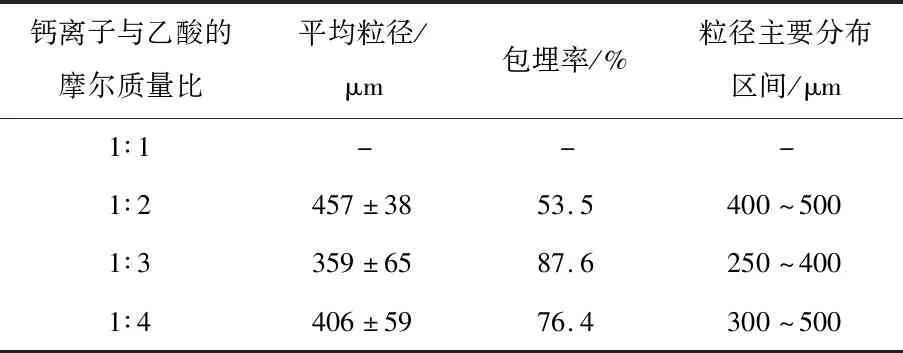
表3 乙酸添加量对微胶囊性质的影响
2.2.3转速对微胶囊性质的影响
转速过小(实验表现为小于300 r/min)时,形成的微胶囊聚集严重,成球性交叉,包埋率低,提高转速,乳状液中受到剪切应力增大,形成的微胶囊粒径变小,但转速过大(实验表现为大于600 r/min)时,乳状液中受到的剪切应力不均匀,形成的微胶囊较大。由表4可以看出,随着磁力搅拌转速的提高,微胶囊的粒径逐渐减小。粒径在转速为600 r/min时达到最小,为(308±23)μm。在转速为300 r/min~500 r/min的区间内,包埋率在转速为500 r/min时达到最大,为74.5%,在转速为500 r/min~700 r/min的区间内,包埋率随着转速的提高而下降。
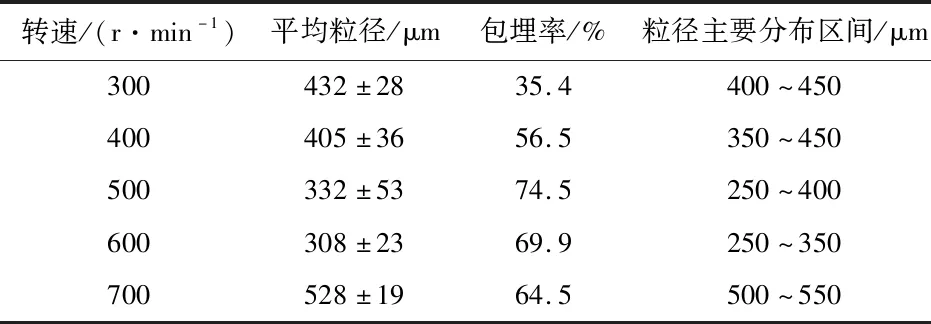
表4 转速对微胶囊性质的影响
2.2.4钙离子与海藻酸钠的摩尔质量比(钙胶比)对微胶囊性质的影响
碳酸钙含量的增加使得混合液中钙离子的浓度增大,促使海藻酸钠和钙离子之间进行凝胶化反应,形成的微胶囊结构更加致密,导致粒径和减小,但钙胶比超过一定程度,混合液中的海藻酸钠浓度过低,使得形成的结构变得松散,包裹的毕赤酵母容易流失,导致包埋率下降。由表5可知,随着钙胶比的增加,微胶囊的粒径有下降的趋势,当钙胶比为3∶1时微胶囊的粒径平均粒径最小为(309±49)μm;微胶囊的包埋率在1∶3时最高,为90.5%。

表5 钙胶比对微胶囊性质的影响
2.2.5表面活性剂添加量对微胶囊性质的影响
在表面活性剂的添加量较低时,不能很好的覆盖分散相表面,微胶囊的稳定性低,聚集生成较大的微胶囊,而在表面活性剂的添加量足够高时,表面活性剂降低了水相和油相之间的表面张力,同时高浓度的Span 80使油/水界面上Span 80分子排列更加紧密,降低了通过油/水界面扩散到海藻酸钠溶液中乙酸的量和速度,从而得到粒径较小的微胶囊。但当表面活性剂的添加量过多(Span 80的浓度大于临界胶束浓度(CMC),实验表现为Span 80浓度超过1.5%)时,混合液中Span 80的亲水基团与海藻酸钠分子相互吸引,使得原本自由伸展的海藻酸钠长链分子向胶束中心弯曲,溶液收缩应力增大,表面张力增大,微胶囊的粒径也随之增大。由表6可以看出,随着Span 80添加量的增加,微胶囊的粒径逐渐减小,当Span 80添加量为1.5%时粒径最小,为168±18 μm。微胶囊的包埋率在0.5%~1.0%的区间内随着Span 80添加量的增多而提高,随后包埋率随Span 80添加量的提高而降低,当Span 80添加量为1.0%时包埋率最高,为86.5%。
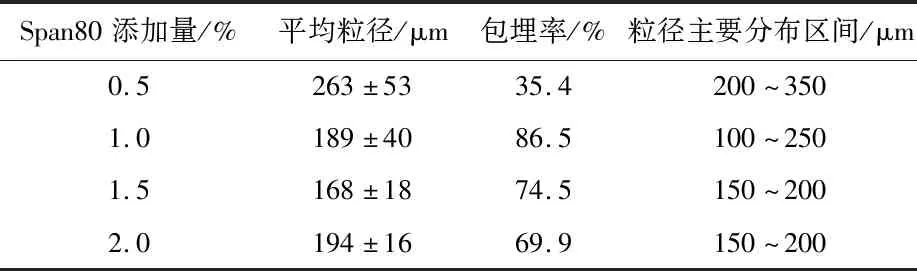
表6 Span 80的添加量对微胶囊性质的影响
2.3 乳化法制备毕赤酵母海藻酸钠微胶囊的响应面优化
以乳化过程中磁力搅拌器的转速(A)、表面活性剂Span 80添加量(B)、水油比(C)为自变量,微胶囊的粒径和包埋率为响应值,进行三因素三水平实验优化,共17组试验方案。响应面设计及结果见表7。
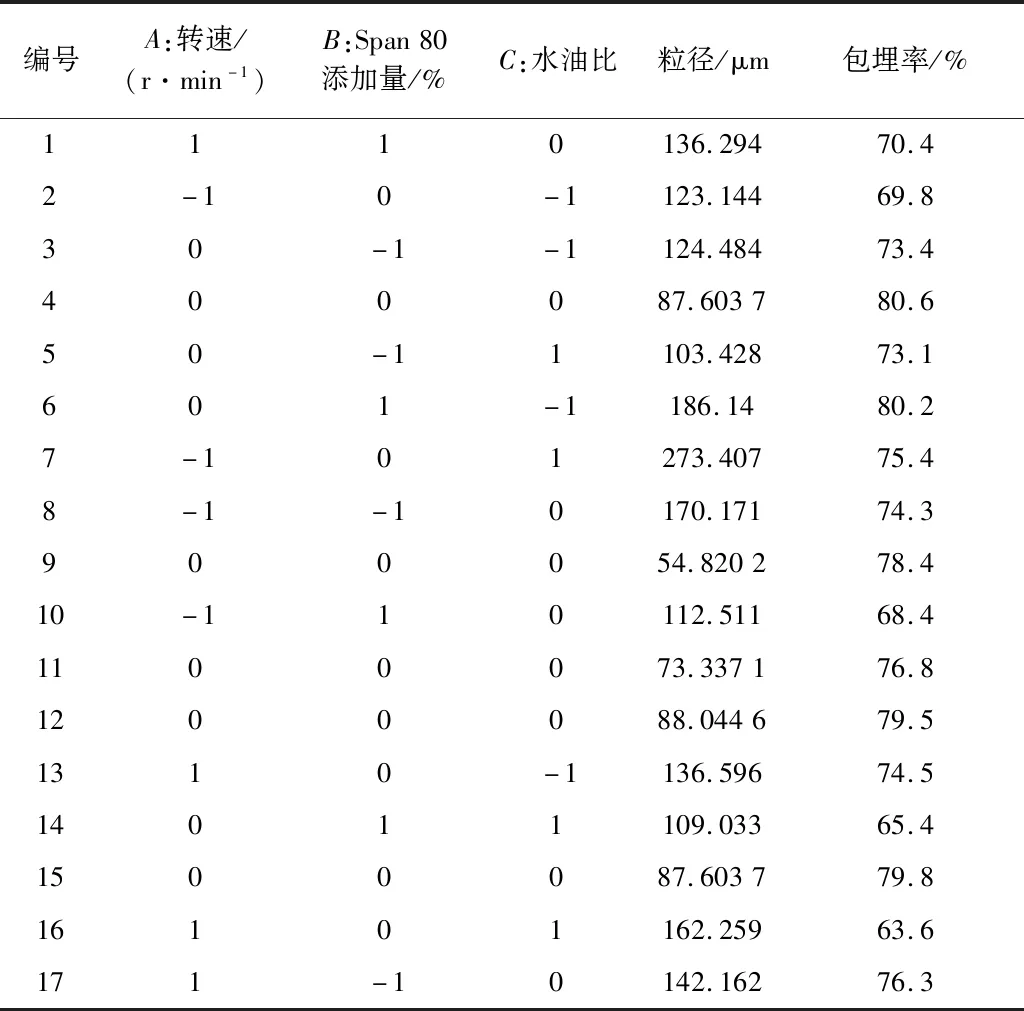
表7 乳化法制备毕赤酵母海藻酸钠微胶囊的响应面方案及结果
利用Design-Expert软件对表7的数据进行响应面分析,拟合得到微胶囊的粒径和包埋率关于A、B、C的三元二次多项回归方程:
Y=82.28+3.51A+0.783 4B+0.279 6C+5.45AB+3.85AC+0.987 2BC+39.28A2+6.21B2+27.28C2
(1)
Y=79.02-0.387 5A-1.15B-2.55C+0AB-4.13AC-3.62BC-4.44A2-2.24B2-3.76C2
(2)
式(1)和式(2)分别为粒径和包埋率的回归方程。
对回归模型进行方差分析与显著性检验。模型的P值均小于0.05,表明模型差异显著;失拟项均大于0.05,说明模型具有较好的拟合度,表面模型能较准确的反映了转速、Span 80添加量、水油比对微胶囊粒径和包埋率的影响。因此可以用回归模型对实际的实验结果进行分析和预测。
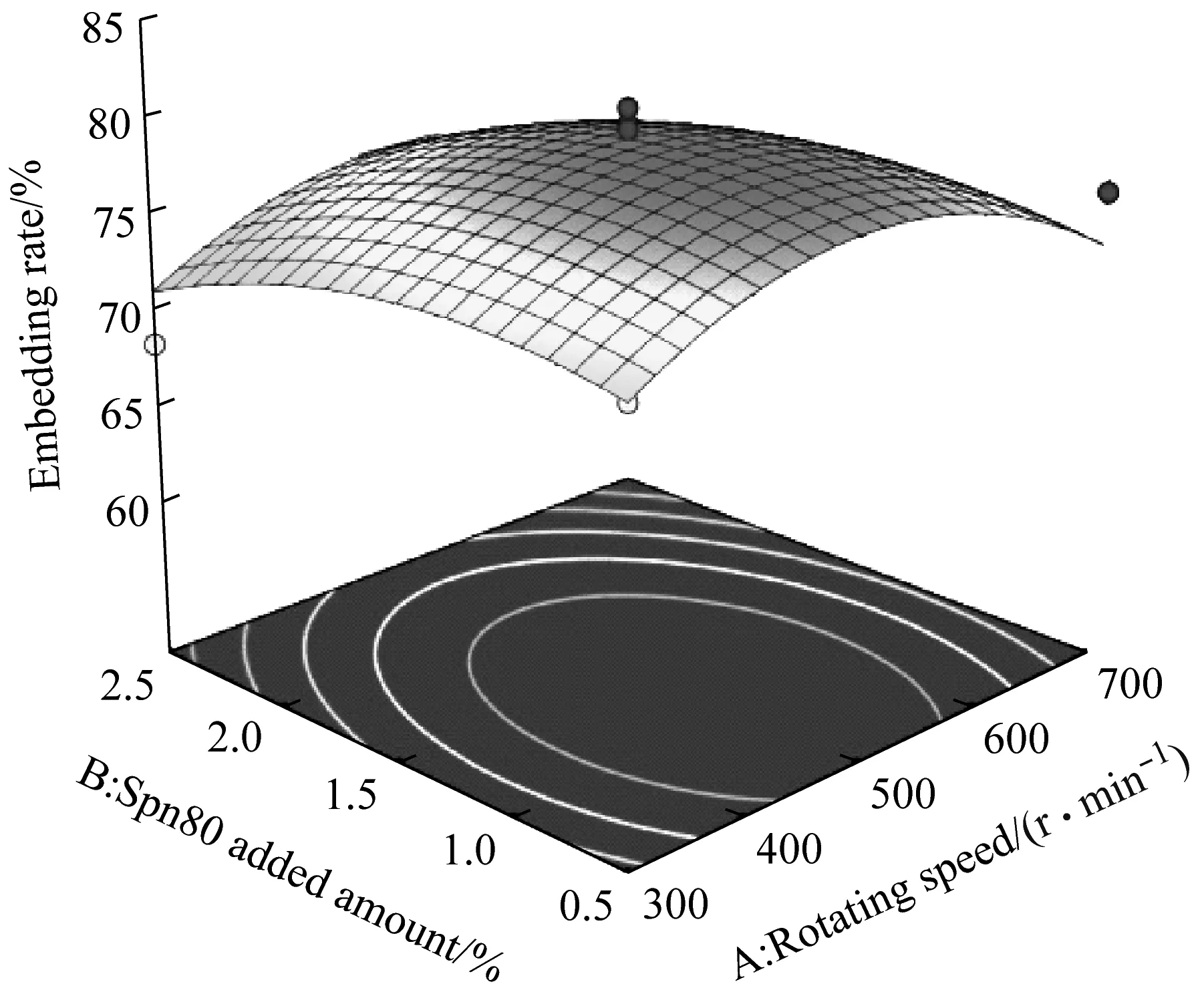
回归方程中各项系数绝对值的大小能直接反映各因素对响应值的影响程度,其正负表示影响的方向。由式(1)和式(2)的各项系数可知,各因素影响微胶囊粒径的显著性大小为:水油比>Span 80添加量>转速;各因素影响微胶囊包埋率的显著性大小为:转速>Span 80添加量>水油比。采用Design-Expert软件优化回归方程模型,最佳制备条件为:转速为529.09 r/min、Span 80添加量为1.48%和水油比为0.41。得到的微胶囊最小粒径为88.02 μm,包埋率为79.53%。
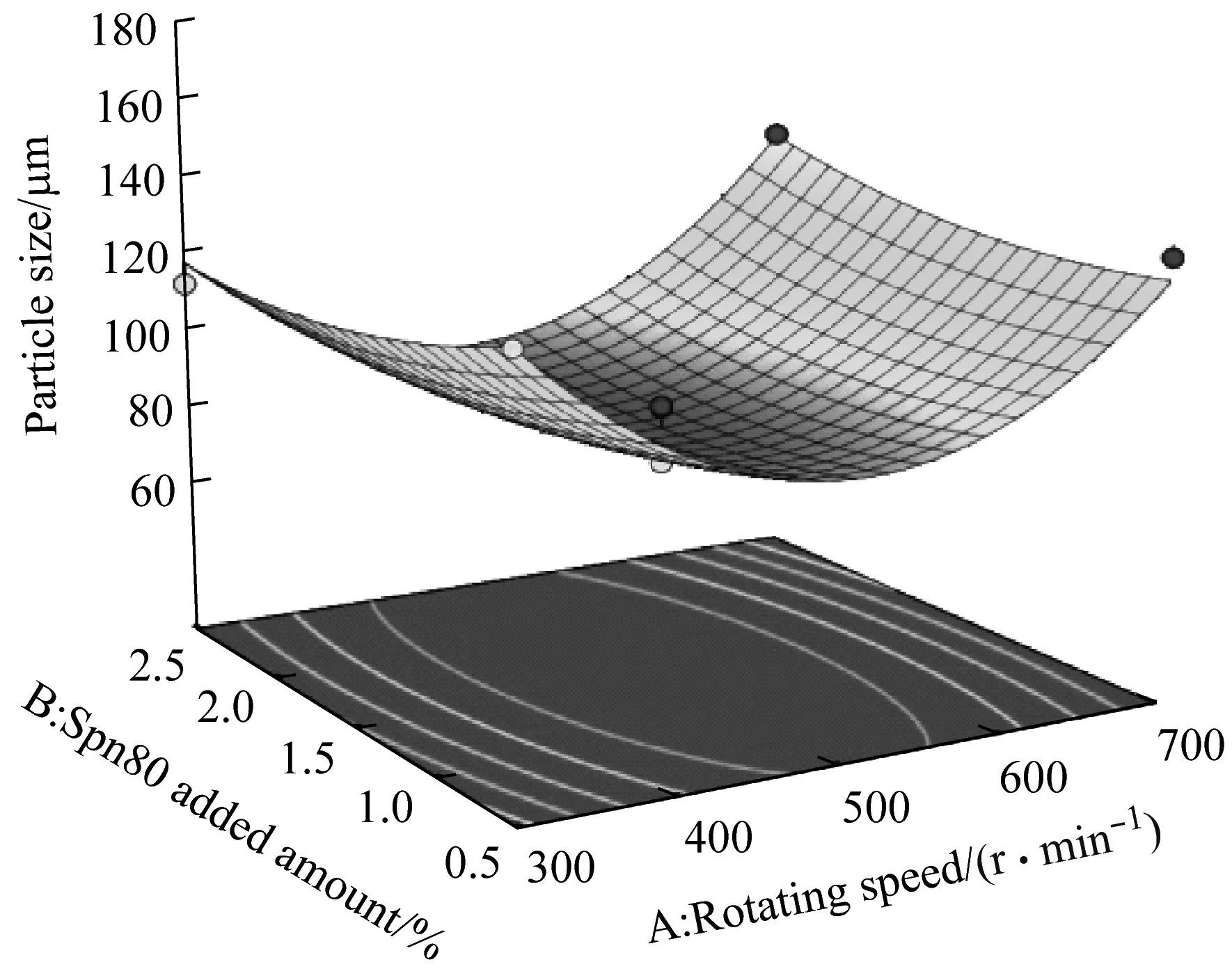
图2为乳化法制备微胶囊中转速、Span 80添加量和水油比三者之间交互作用对微胶囊粒径的响应面图。由图2(a、b)可知,水油比为0.466 5,转速固定,微胶囊的粒径随着Span 80添加量的增大呈缓慢下降趋势;固定Span 80添加量时,微胶囊的粒径随着转速的增大呈先下降后上升趋势,微胶囊粒径的最小值在转速为500 r/min ~600 r/min和Span 80添加量为1.0%~1.5%的范围内,且存在最低点,即为图2(b)等高线中的点5。由图2(c、d)可知,Span 80添加量为1.5%,转速固定,微胶囊的粒径随着水油比的增大呈先下降后上升趋势;水油比固定,微胶囊的粒径随着转速的增大呈先下降后上升趋势,微胶囊粒径的最小值在转速为500 r/min ~600 r/min和水油比为0.439 8~0.493 2的范围内,且存在最低点,即为图2(d)等高线中的点5。由图2(e、f)可知,转速为500 r/min,Span 80添加量固定时,微胶囊的粒径随着水油比的增大呈先下降后上升趋势;水油比固定时,微胶囊的粒径随着Span 80添加量的增大呈缓慢下降后缓慢上升趋势,微胶囊粒径的最小值在Span 80添加量为1%~2%和水油比为0.439 8~0.493 2的范围内,且存在最低点,即为图2(f)等高线中的点5。
图3为乳化法制备微胶囊中转速、Span 80添加量、水油比三者之间交互作用对微胶囊包埋率的响应面图。由图3(a、b)可知,水油比为0.466 5,转速固定,微胶囊的包埋率随着Span 80添加量的增大呈先上升后下降趋势;固定Span 80添加量时,微胶囊的包埋率随着转速的增大呈先上升后下降趋势,微胶囊包埋率的最大值在Span 80添加量为1%~2%和转速为400 r/min ~600 r/min的范围内,且存在最高点,即为图3(b)等高线中的点5。由图3(c、d)可知,Span 80添加量为1.5%,转速固定,微胶囊的包埋率随着水油比的增大呈下降趋势;水油比固定,微胶囊的包埋率随着转速的增大呈先上升后下降趋势,微胶囊包埋率的最大值在水油比为0.439 8~0.493 2和转速为400 r/min ~600 r/min的范围内,且存在最高点,即为图3(d)等高线中的点5。由图3(e、f)可知,转速为500 r/min,Span 80添加量固定时,微胶囊的包埋率随着水油比的增大呈下降趋势;水油比固定时,微胶囊的包埋率随着Span 80添加量的增大呈上升趋势,微胶囊包埋率的最大值在Span 80添加量为1%~2%和水油比为0.439 8~0.493 2的范围内,且存在最高点,即为图3(f)等高线中的点5。
结合实际条件,将最佳制备参数调整为转速500 r/min、水油比0.466 5和Span 80添加量为1.5%,制备所得微胶囊的粒径为93.032 μm,包埋率为80.1%,实际值与理论值接近。因此,证实该模型能较好地模拟并预测微胶囊的粒径和包埋率。
(a)
(a)
2.4 毕赤酵母海藻酸钠微胶囊的形态观察及其GFP诱导表达
乳化法制备所得的海藻酸钠毕赤酵母微胶囊,呈规整的球形结构,微胶囊之间存在相互粘连的现象,在内部清晰可见毕赤酵母的聚集存在(图4a)。经过0.5%、1.0%和1.5%甲醇添加量的24 h诱导后,微胶囊内的毕赤酵母GS115-gfp均在微胶囊内表达了绿色荧光蛋白。其中,在甲醇添加量为1.0%时的微胶囊绿色荧光最为显著,此时诱导作用最好(图4b、c、d)。
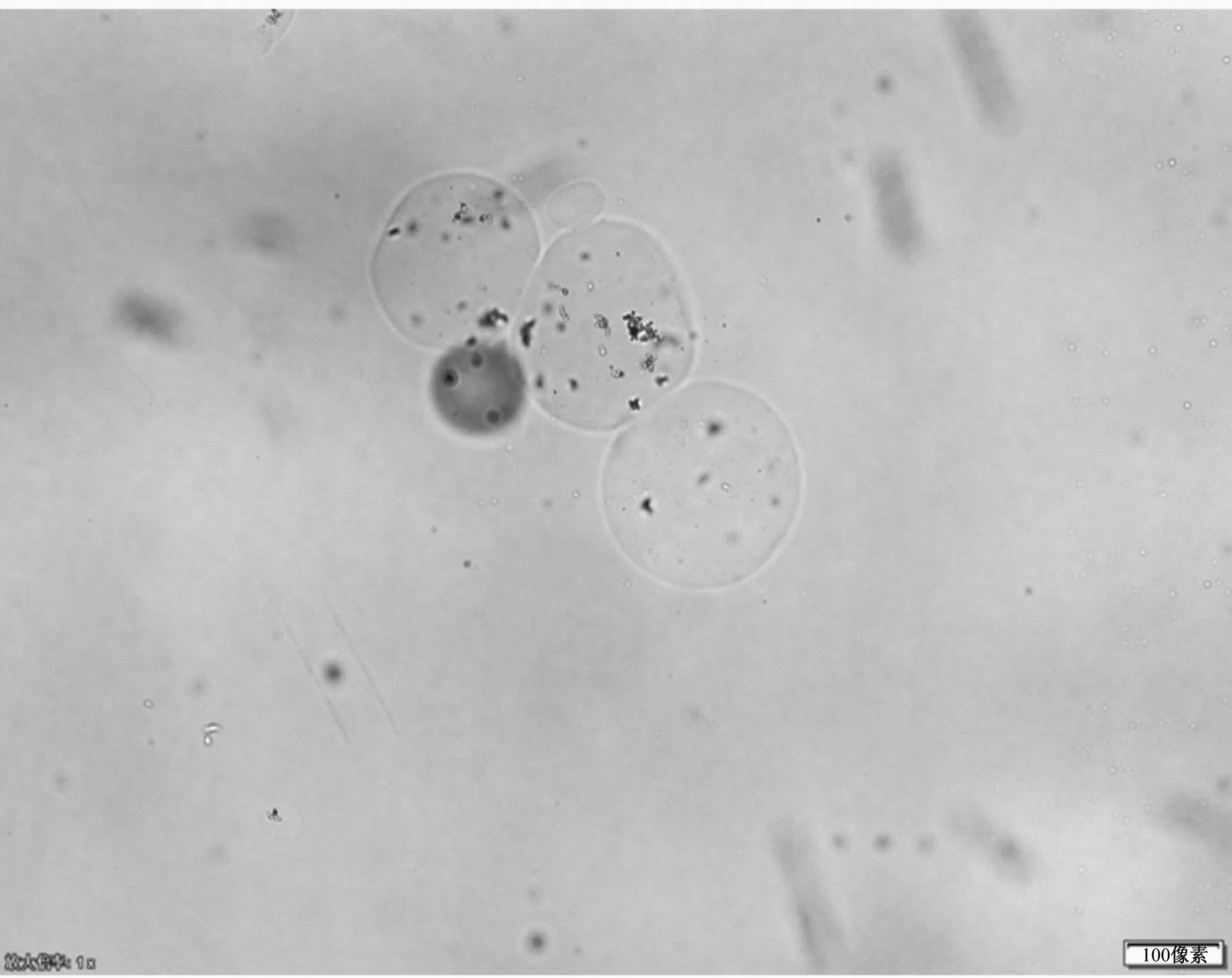
(a)毕赤酵母微胶囊
3 结果
本研究对毕赤酵母GS115-gfp以海藻酸钠为壁材,通过乳化法制备了微胶囊并对其进行了优化,降低了微胶囊的粒径,提高了微胶囊的包埋率,同时以甲醇为诱导剂,对GFP进行了诱导表达。海藻酸钠与毕赤酵母的生物相容性良好,可以作为毕赤酵母微胶囊的壁材。使用乳化法制备毕赤酵母海藻酸钠微胶囊并对其制备条件进行单因素及响应面优化的实验结果表明,最佳制备参数为转速500 r/min、水油比0.466 5、Span 80添加量为1.5%,钙离子与乙酸的摩尔质量比为1∶3,钙离子与海藻酸钠的摩尔质量比为1∶3,制备所得微胶囊的粒径为(93.032±11)μm,粒径分布区间为85 μm ~105 μm,包埋率为80.1%。乳化法制备毕赤酵母微胶囊的GFP诱导表达结果表明,在不同浓度甲醇的诱导下,毕赤酵母海藻酸钠微胶囊均表达了绿色荧光蛋白GFP,这表示该微胶囊具有比较好的物质通透性,可以将甲醇输送给内部的毕赤酵母对其进行诱导表达,这为单细胞蛋白的测量提供了一种可行的方法,对后续研究单细胞的个体差异,了解细胞个体对于样品异质性的精确贡献,促进对细胞表达过程的理解有重要意义。

