超微血管显像联合增强CT诊断直径<3 cm肾脏肿瘤的价值
许 莹 周 瑜 李丽娜 樊 星
直径<3 cm 的肾脏肿瘤(以下简称小肾肿瘤)早期无特异性症状,通常是在出现腹部包块、血尿后发现,临床准确诊断有一定困难,故应尽早行影像学检查[1]。目前临床常用的影像学检查方法包括超微血管显像(superb microvascular imaging,SMI)、增强CT、超声造影,其中超声造影能够强化肿瘤和肾脏血流灌注,准确判断良恶性病变,但存在造影剂过敏风险[2];增强CT可反映肾脏小肿瘤的血流灌注和形态学特征,获得肾盂期、实质期、肾动脉期等多期扫描图像,提高小肾肿瘤的检出率,但小肾肿瘤的肾脏组织呈纤维化状态,动脉期扫描漏诊率较高[3];SMI空间分辨率高,可显示清晰血流图像,在判定良恶性病变中具有重要作用[4]。本研究旨在探讨SMI 联合增强CT 对小肾肿瘤的诊断价值。
资料与方法
一、临床资料
选取2017 年1 月至2020 年8 月我院经病理证实的小肾肿瘤患者 118 例,男 69 例,女 49 例,年龄 37~68 岁,平均(51.79±10.18)岁;体质量 53~76 kg,平均(62.43±7.41)kg;病灶大小1.2~2.7 cm,平均(1.86±0.75)cm。其中恶性46 例,包括肾透明细胞癌29 例,乳头状肾细胞癌10 例,嫌色细胞癌5 例,浸润性尿路上皮癌2 例;良性72 例,肾血管平滑肌脂肪瘤67 例,后肾腺瘤5 例。排除标准:①既往有脓毒血症、全身性感染、上消化道出血病史者;②存在破裂出血、食管贲门静脉重度曲张、门静脉高压者;③凝血功能严重障碍、合并黄疸及高度腹水者;④入组前3个月内行射频消融和化疗者。本研究经我院医学伦理委员会批准,所有患者均知情同意。
二、仪器与方法
1.SMI 检查:使用佳能Aplio i800 彩色多普勒超声诊断仪,探头频率1~6 MHz;配备SMI软件。患者取仰卧位,常规扫查横突下横切面和纵切面、右肋间切面、右肋下切面,清晰显示肾脏病灶内部血流,调节仪器参数确保无伪彩影。训练患者屏气,然后开启SMI 模式,观察肾脏病变血流形态、周边环状血流和内部病变情况,保存图像资料。
2.增强CT 检查:使用西门子 SOMATOM Definition 64 排CT机,扫描前30 min口服泛影葡胺(西安汉丰药业有限责任公司),保证胃肠道充盈。患者取仰卧位,平扫双肾,重建曲面、矢状面、冠状面图像。经肘静脉高压注射碘佛醇80 ml,速度3.0 mg/s,观察病灶形态、大小、有无出血、钙化、强化特点等,30 s 后行肾脏皮质期扫描,60 s后行肾脏实质期扫描,3 min后行肾盂期扫描。
3.诊断标准:①SMI 血流分布模式[5]。模式 0,未见血流信号;模式1,肿瘤内部可见线状血流信号或局限性点状信号;模式2,血流信号自病灶外行向肿瘤中心;模式3,信号来自病灶外肿瘤边缘;模式4,肿瘤内部及边缘可见血流信号。②SMI 血流分级[6]。0 级,病灶未见血流;Ⅰ级,病灶内可见细棒状血管或1~2 个点状血管;Ⅱ级,可见1 条重要血管或3~4 个点状血管,长度大于或等于病灶半径;Ⅲ级,可见2 条较长血管或≥5 个点状血管。③CT 诊断标准[1]。良性病变表现为实性部分延迟强化,囊性无强化;恶性病变表现为动脉期不均匀强化,以富血供病变居多,呈不典型低强化。④联合诊断使用并联试验原则,即一项检查结果为恶性即为恶性,两项检查结果均为良性判为良性。
三、统计学处理
应用SPSS 20.0 统计软件,计数资料以例或率表示,行χ2检验。SMI 特征与良恶性肿瘤的相关性分析采用Kendall’s tau-b相关分析法。绘制受试者工作特征(ROC)曲线分析SMI、增强CT 及其联合应用对小肾肿瘤的诊断效能,曲线下面积比较行Z检验。P<0.05为差异有统计学意义。
结 果
一、SMI检查情况
SMI检查显示良恶性病变血流分级、血流形态、血流分布模式、周边环形血流情况比较差异均有统计学意义(均P<0.05)。见表1和图1。
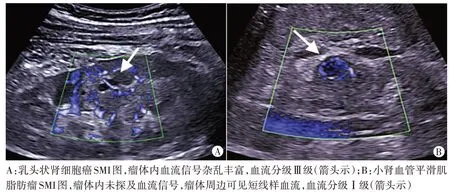
图1 良恶性小肾肿瘤SMI图
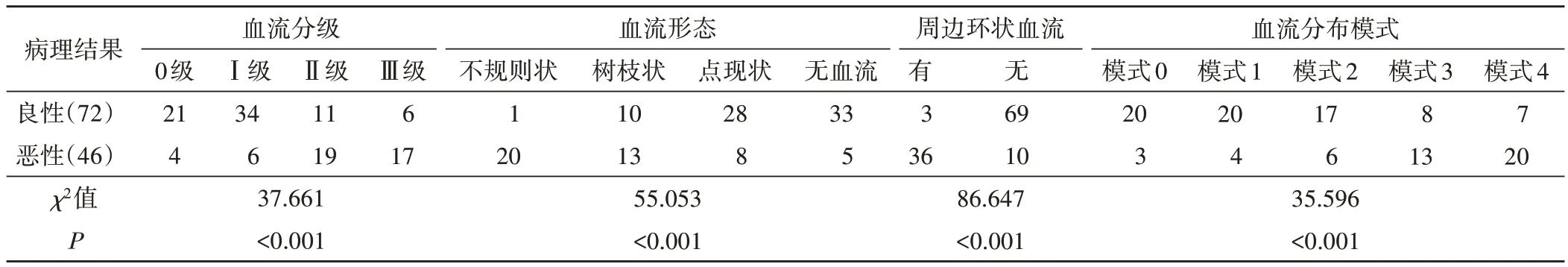
表1 良恶性小肾肿瘤SMI特征比较 例
二、增强CT检查情况
良性病变患者中,65 例病灶表现为皮质期环状强化,渐进性向心性逐渐强化,呈“慢退慢进”;7 例表现为非均匀性强化,缓慢退出,呈“慢退快进”。恶性病变患者中,35 例病灶表现为髓质期快速消退,皮质期非均匀性强化或均匀性强化,呈“快进快退”;11例表现为髓质期持续强化,皮质期均匀性强化,呈“快进慢退”。良恶性病变增强CT 表现比较差异均有统计学意义(均P<0.05)。
三、相关性分析
相关性分析显示,SMI 血流分级、分布模式均与良恶性病变呈正相关(r=0.454、0.442,均P=0.000),血流形态、周边环状血流均与良恶性病变呈负相关(r=-0.530、-0.768,均P=0.000)。
四、ROC曲线分析
ROC 曲线分析显示,SMI 诊断小肾肿瘤的曲线下面积为0.746,敏感性80.51%,特异性68.75%;增强CT 诊断小肾肿瘤的曲线下面积为0.677,敏感性72.88%,特异性62.50%;SMI 联合增强CT 诊断小肾肿瘤的曲线下面积为0.956,敏感性97.46%,特异性93.75%;两者联合应用的曲线下面积与其单独应用比较差异均有统计学意义(Z=2.638、3.390,P=0.008、0.001)。见表2和图2。
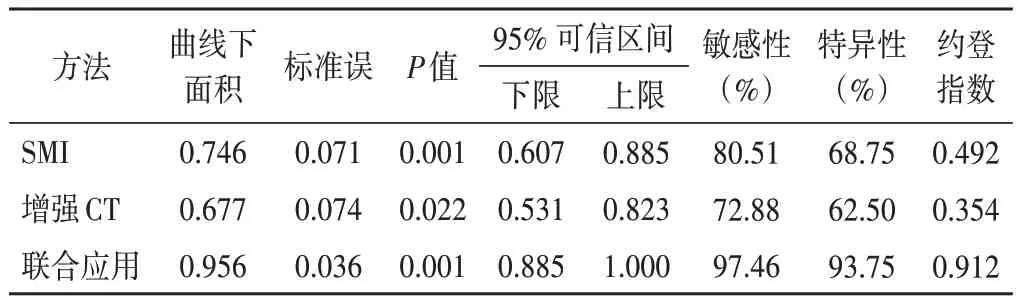
表2 SMI、增强CT单独及联合应用对小肾肿瘤的诊断效能
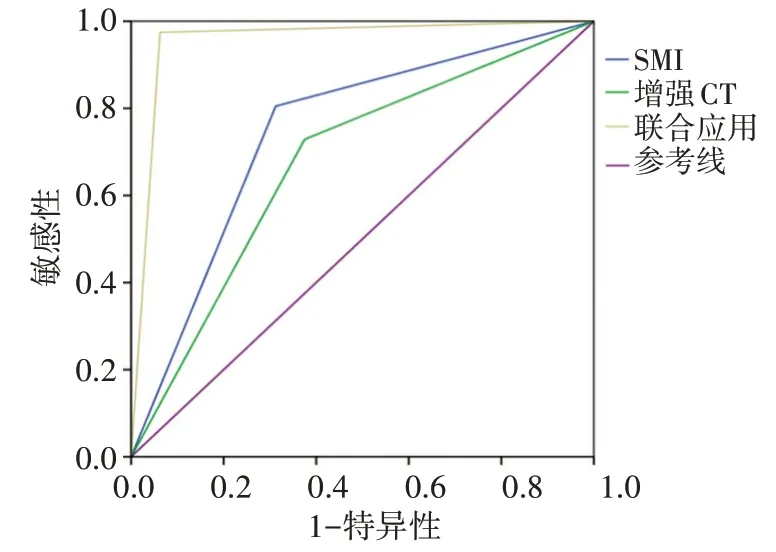
图2 SMI、增强CT单独及联合应用诊断小肾肿瘤的ROC曲线图
讨 论
小肾肿瘤是起源于肾实质泌尿小管上皮系统的肿瘤,早期症状缺乏特征性,故需依靠影像学检查方法进行早期判断。目前常用的影像学检查方法包括SMI、CDFI、增强CT、超声造影等。CDFI 能够辨别滋养血管数目、形态、结构,显示其分布情况,但对于呼吸功能差者显像不清;超声造影能够显示病灶内部新生血管,但无法显示原发性肾脏癌病灶;增强CT 能清楚显示肿瘤坏死与碘化油沉积类型的关系,有效评估病灶周边血流情况,为疾病判定提供参考依据,但对直径过小的病变诊断特异性较低。SMI 是基于彩色多普勒原理发展而来一种新技术,不仅能够准确区分低速血流与组织运动形成的多普勒信号,还可显示低速血流信息,更好地显示肾脏病变情况。本研究旨在探讨SMI、增强CT及其联合应用对小肾肿瘤的诊断价值。
本研究SMI 检查显示良恶性病变血流分级、血流形态、血流分布模式、周边环形血流情况比较差异均有统计学意义(均P<0.05);相关性分析结果显示SMI 血流分级、分布模式与良恶性病变均呈正相关(r=0.454、0.442,均P=0.000),血流形态、周边环形血流与良恶性病变均呈负相关(r=-0.530、-0.768,均P=0.000),表明良恶性小肾肿瘤的SMI表现具有一定特征性,其中恶性病变表现为血流形态不规则、血流分布混合型,且血管数量多、血流分级高[7],主要原因为恶性肿瘤可分泌大量血管物质,促使新生血管增多,而一旦发生血管物质病变,可导致血管管径不规则粗大,走行变形、扭曲,进而形成动静脉瘘,SMI可显示周边向内部发出的网状或树枝状新生血管[8]。本研究结果与毛怡然等[6]研究结论相似,说明SMI 在判定小肾肿瘤血流分布模式、血流分级、形态中均有显著作用。
增强CT 具有多层面成像、定性定位准确、分辨率高等优势,可通过多切面、多方位、多角度实时观察病灶动态变化。本研究结果中,良性组主要以“慢退慢进型”为主,恶性组主要以“快进快退型”为主,两者增强CT 表现差异有统计学意义(均P<0.05),说明CT 增强影像特征在鉴别良恶性病变中具有一定价值。分析出现差异的原因可能与肿瘤内血管结构、形态有关;若病变内部存在动静脉瘘或内部血管径粗大,则表现出“快退”,若静脉管细,且存在血管栓塞或走行迂曲,则表现“慢退”。恶性病变多表现为“快进”,但也存在“慢退”,说明乏血供的恶性肿瘤和血供相对丰富的良性肿瘤的影像征象存在重叠,故仅凭借CT增强模式进行鉴别有一定局限。
为了进一步探讨各检查方式对小肾肿瘤的诊断效能,本研究ROC 曲线分析显示SMI和增强CT 诊断小肾肿瘤的曲线下面积分别为0.746 和0.677,两者联合应用的曲线下面积为0.956,与单独应用比较差异均有统计学意义(Z=2.638、3.390,P=0.008、0.001),提示SMI联合增强CT 能提高临床对小肾肿瘤的诊断准确率。张岱等[9]研究也进一步佐证SMI 联合增强CT 的诊断效能更高。分析原因为增强CT 具有强大的后处理功能,可准确显示病灶内形态结构和血供情况,提高病变显示能力,但检测直径较小病变时特异性较低,故存在一定误诊率;而SMI 可弥补增强CT 特定预设扫查时间、预设层面而导致信息遗漏的不足,能够显示肾肿瘤的细小、低速血流,结合血管形态和二维图像分析,更好地显示肿瘤周边血流情况,明确周围脏器和血管与病灶的关系。
综上所述,SMI 和增强CT 对小肾肿瘤均有一定诊断价值,两者联合应用能提高诊断准确率,临床应用价值更高。

