干旱胁迫和低氮对花生根际土壤细菌群落结构和多样性的影响
丁 红孙运霞戴良香徐 扬张冠初秦斐斐张智猛*
(1.山东省花生研究所,山东 青岛 266100;2.中国农业大学土地科学与技术学院,北京 100083)
花生是我国重要的经济和油料作物,具有抗旱耐瘠、适应性强的特点,在我国干旱半干旱地区有较大种植面积。 作为豆科作物,花生具有根瘤固氮作用,是干旱丘陵地区的重要经济作物。 干旱胁迫和土壤氮素缺乏影响花生生长发育,导致花生养分利用率降低,造成花生产量和品质下降。 植物根际土壤受根系活动影响,其理化性质及生物学活性不同于其他土体的微域环境,是土壤、植物、微生物三者相互作用的场所。 植物的新陈代谢和微生物活动共同影响根际土壤的特性、营养物质和微生物群落等[1-2]。 植物种类、栽培方式、种植年限、土壤类型及理化性质及病虫害等都能影响根际微生物群落[3-6]。 干旱条件下玉米根际土壤中细菌和古菌数量显著低于水分充足条件下[7]。 干旱和盐胁迫下花生根际微生物群落结构和组成受到较大影响,其优势菌群、功能菌群等比例发生变化,影响其根际微生物群落结构的平衡[8]。 另外,有研究表明,植物根际细菌群落结构和多样性受施肥条件的影响较大,施用肥料降低了花生根际土壤的菌群多样性但提高了其菌群物种丰度[9]。
目前,盐碱胁迫对花生根际微生物菌群结构的影响研究较多,干旱胁迫与氮素缺乏对花生根际细菌群落的影响鲜见报告,且越来越多的研究发现根际微生物在适应逆境胁迫和土壤元素循环中发挥重要作用。 因此,研究干旱胁迫和低氮对花生根际细菌群落的影响,有助于认识逆境下花生根际土壤细菌群落功能调节并发掘新的功能类群,对旱薄地花生高产优质栽培具重要意义。
1 材料与方法
1.1 试验设计
以花育25号为试验材料,在16 h 光照/8 h黑暗(28℃/22℃)的温室内进行盆栽试验,试验盆直径16.3 cm,高17.4 cm。 土壤风干过筛后装盆,土壤田间持水量23.23%,每盆装土3.0 kg,种植2株花生。 设正常供水(WWNA)、干旱胁迫(DSNA)和干旱低氮双重胁迫(DSNN)三个处理,其中正常供水处理为对照。 低氮水平下不施氮肥,正常施氮为每盆施0.16 g N(90 kg·hm-2)。为保证出苗和长势的一致性,开花前保持正常供水,土壤相对含水量为田间持水量的75%。 开花后进行干旱胁迫处理,采用称质量法控制水分含量,保持土壤相对含水量为田间持水量的45%,干旱胁迫时间5 d,每处理重复3次。
1.2 根际土壤采集
将花生整株挖出后,仔细抖落根系表层土壤,用灭菌后的刷子将根际约1~10 mm 的土壤拂刷后放入无菌袋中[10]。 同一处理的花生根际土壤样品混合成一个土壤样品,液氮速冻后置-80℃超低温冰箱保存。 正常供水处理的土壤样本3次重复分别表示为WWNA1、WWNA2 和WWNA3,干旱胁迫处理的分别表示为DSNA1、DSNA2、DSNA3,干旱低氮双重胁迫处理的分别表示为DSNN1、DSNN2和DSNN3。
1.3 土壤DNA 提取及高通量测序
采用OMEGA 土壤DNA 提取试剂盒提取花生根际土壤DNA。 上海美吉生物医药科技有限公司对根际土壤进行了相关测试。 以提取的土壤样本DNA 为模板,对土壤细菌16S r RNA 基因进行PCR 扩增后进行Miseq文库构建及测序。扩增引物为V3~V4 区的338F(5'-ACTCCTACGGGAGGCAGCAG-3') 以及806R: (5'-GACTAHVGGGTWTCTAAT-3')。 利用Miseq拼接软件将读取长度拼接成长序列,同时对序列品质进行质控和过滤,区分样本后,对多个序列聚类运算分类单元(operational taxonomic units,OTUs) 进行聚类分析和物种分类学分析。
1.4 生物信息学分析
采用Alpha多样性分析方法,分析了花生根际土壤细菌群落的多样性和丰富度。 同时,对样本间的Beta多样性进行分析,包括主成分分析(PCA)和聚类统计分析,以深入挖掘样本间物种组成的差异。 最后,利用美吉云平台的重建群落系统发育调查PICRUSt(Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)方法对样本中微生物群落的功能组成进行预测。
2 结果与分析
2.1 Alpha多样性指数分析
土壤细菌群落的多样性和丰富度可用Alpha多样性指数表征,其中辛普森和香农指数可反映土壤细菌群落多样性,菌种丰度由Ace和Chao指数计算,coverage指各样本文库的覆盖度。 表1 可见,各处理土壤样本覆盖度差异较小,平均值均在0.97以上,表明各处理花生根际土壤样本文库覆盖度高。 正常供水条件下花生根际土壤样本的Chao1和Ace值均较大,其物种总数较高。 各处理香农指数大小顺序为WWNA>DSNA>DSNN。干旱胁迫和干旱低氮双重胁迫条件下的辛普森指数平均值显著高于对照(表1),分别比正常供水高41.54%和79.58%,表明干旱胁迫和干旱低氮双重胁迫处理降低了根际土壤细菌群落多样性。
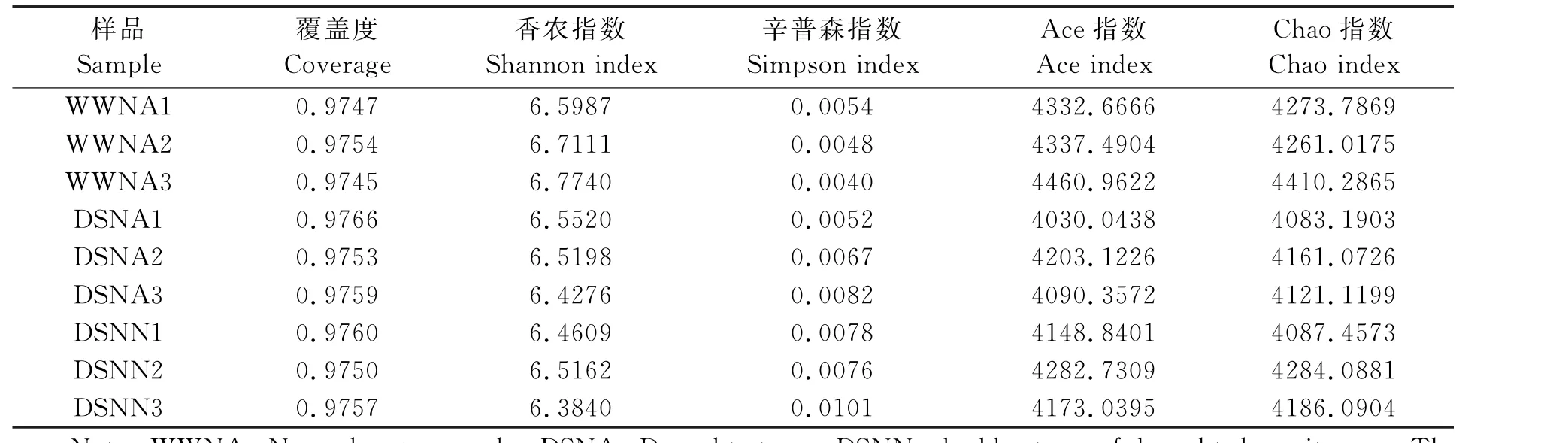
表1 各样本Alpha多样性指标Table 1 Alpha diversity index of different samples
2.2 细菌群落组成及样本间差异比较
2.2.1 门水平菌落结构分析
图1可见,在门分类水平上各处理根际土壤细菌群落的优势菌门为放线菌门(Actinobacteriota,27.20%~29.99%)、变形菌门(Proteobacteria,22.72%~24.74%)、绿弯菌门(Chloroflexi,10.57%~13.55%)、酸杆菌门(Acidobacteriota,9.63%~10.49%)及厚壁菌门(Firmicutes,4.72%~5.98%),这5类优势菌门的相对丰度为74.84%~84.75%。其中,干旱胁迫、干旱低氮胁迫处理下变形菌门的相对丰度低于正常供水处理,而各处理下放线菌门和酸杆菌门的相对丰度升高,分别较正常供水处理提高10.18%、10.07%和6.02%、8.93%。 与正常供水处理相比,干旱低氮双重胁迫处理下绿弯菌门的相对丰度增加10.43%,而干旱胁迫处理下相对丰度降低13.85%。
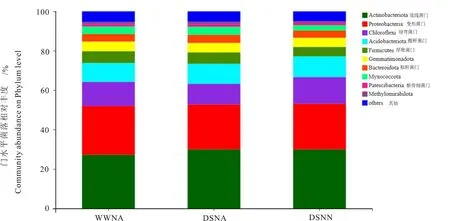
图1 门水平各样本菌落结构柱状图Fig.1 Bacterial community structure in peanut rhizosphere on Phylum level
2.2.2 纲水平菌落结构分析
纲水平分析表明,各处理下放线菌纲(Actinobacteria)、α-变形菌纲(Alphaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、维奇那米菌纲(Vicinamibacteria)和芽单胞菌纲(Gemmatimonadetes)5类菌纲均为优势菌纲,其丰度均在5%以上(图2)。 其中,干旱胁迫和干旱低氮双重胁迫处理下放线菌纲的相对丰度分别比正常供水处理高14.45%和20.83%。 干旱胁迫和干旱低氮双重胁迫增加Vicinamibacteria的相对表达丰度,尤以干旱低氮双重胁迫的诱导效果最为显著。 干旱胁迫处理下α-变形菌纲(Alphaproteobacteria)的相对表达丰度低于其他处理。 与正常供水处理相比,干旱胁迫及干旱低氮双重胁迫处理下γ-变形菌纲相对丰度均显著降低,分别降低6.23%和16.23%。
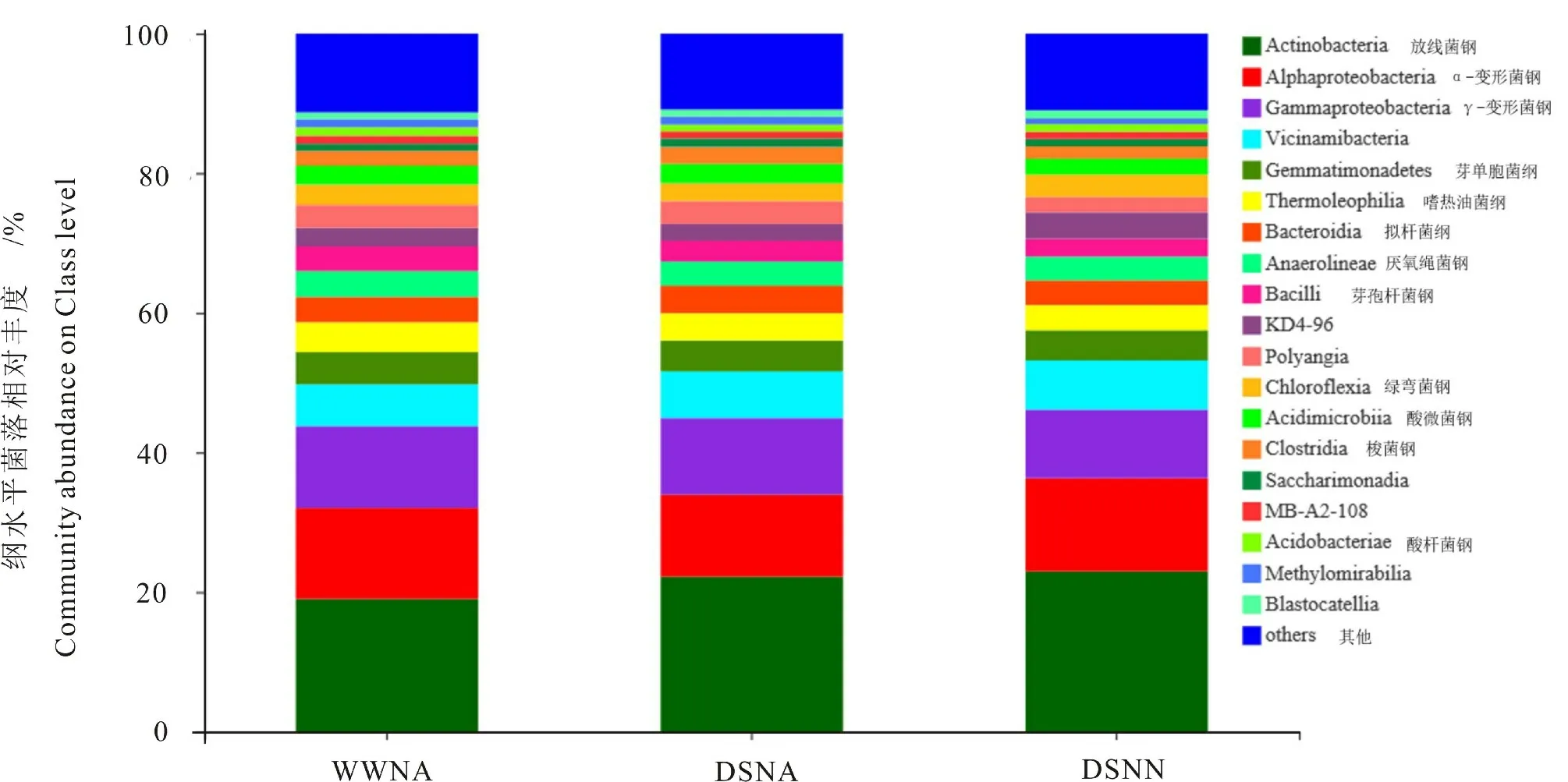
图2 纲水平各样本菌落结构柱状图Fig.2 Bacterial community structure in peanut rhizosphere on Class level
2.2.3 目水平菌落结构分析
图3可见,微球菌目(Micrococcales)、丙酸杆菌目(Propionibacteriales)、Vicinamibacterales、伯克氏菌目(Burkholderiales)、根瘤菌目(Rhizobiales)及 鞘脂单胞菌目(Sphingomonadales)为花生根际土壤优势菌目。 干旱胁迫和干旱低氮双重胁迫下微球菌目、丙酸杆菌目和Vicinamibacterales的相对表达丰度均显著高于正常供水处理,其中干旱低氮双重胁迫下微球菌目相对丰度增加幅度最高,为52.61%。 与对照相比,干旱胁迫降低鞘脂单胞菌目的表达丰度,降低幅度为11.84%;而干旱低氮双重胁迫提高其表达丰度,增加幅度为46.01%。 对照条件下伯克氏菌目和根瘤菌目的相对丰度较高,而干旱胁迫和干旱低氮双重胁迫条件下较低,根瘤菌目的降低幅度分别为13.03%和20.36%。 由此可知,干旱胁迫降低了根瘤菌目的表达丰度,而干旱低氮双重胁迫加剧了其表达量的降低。
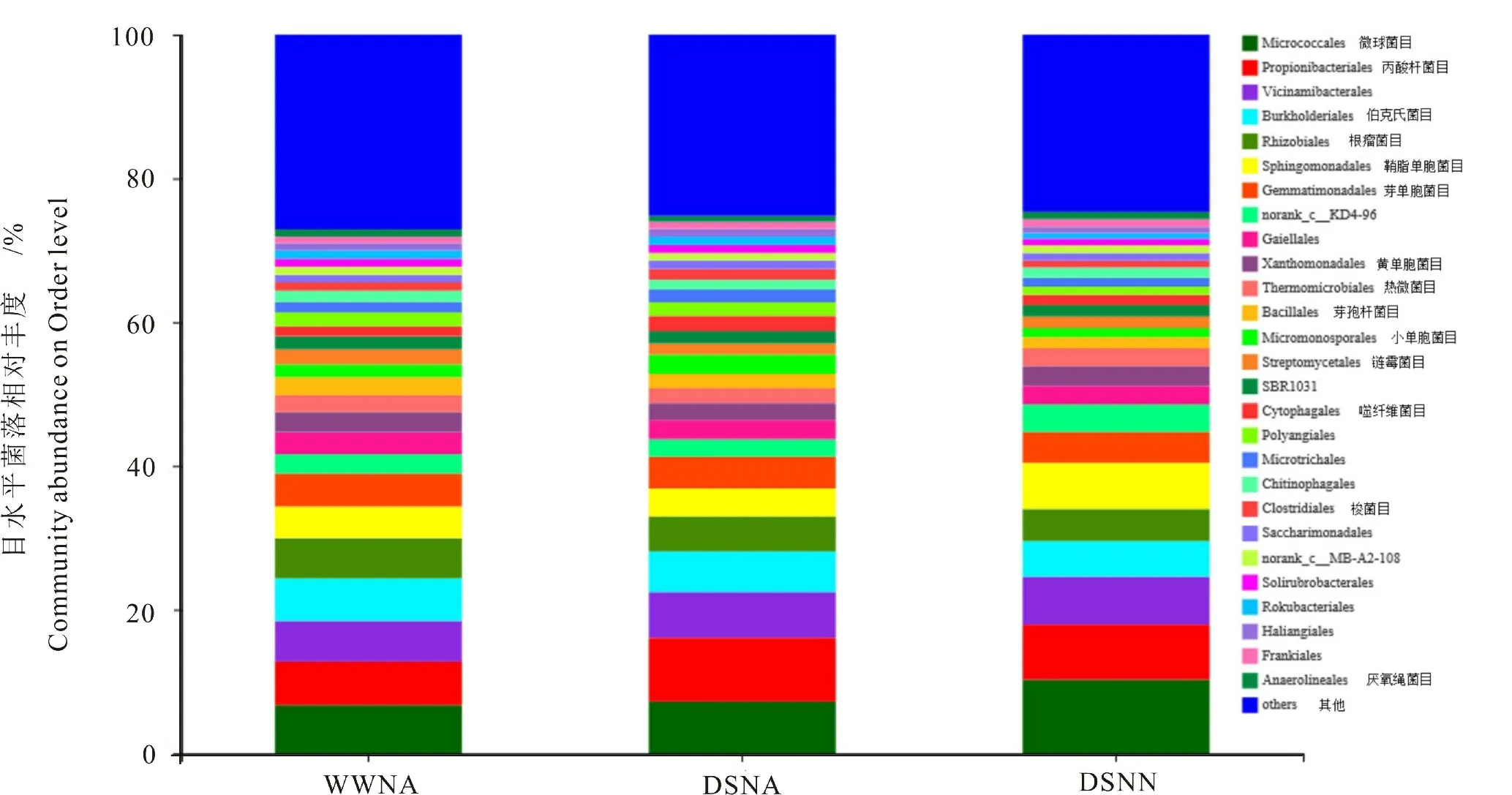
图3 目水平各样本菌落结构柱状图Fig.3 Bacterial community structure in peanut rhizosphere on Order level
2.2.4 科水平菌落结构分析
图4可见,与其他菌科相比,类诺卡氏菌科(Nocardioidaceae)、 鞘脂单胞菌科(Sphingomonadaceae)、 芽单胞菌科(Gemmatimonadaceae)、 间孢囊菌科(Intrasporangiaceae)、Norank_o_Vicinamibacterales、微球菌科(Micrococcaceae)为花生根际土壤优势菌科。 与对照相比,干旱胁迫和干旱低氮双重胁迫下类诺卡氏菌科和间孢囊菌科相对丰度显著增加,增幅分别为47.39%、26.21%和28.18%、68.79%,而Gemmatimonadaceae的表达相对丰度呈降低趋势。 干旱低氮双重胁迫下鞘脂单胞菌科相对表达丰度最高,分别比对照和干旱胁迫高31.51%和39.62%。
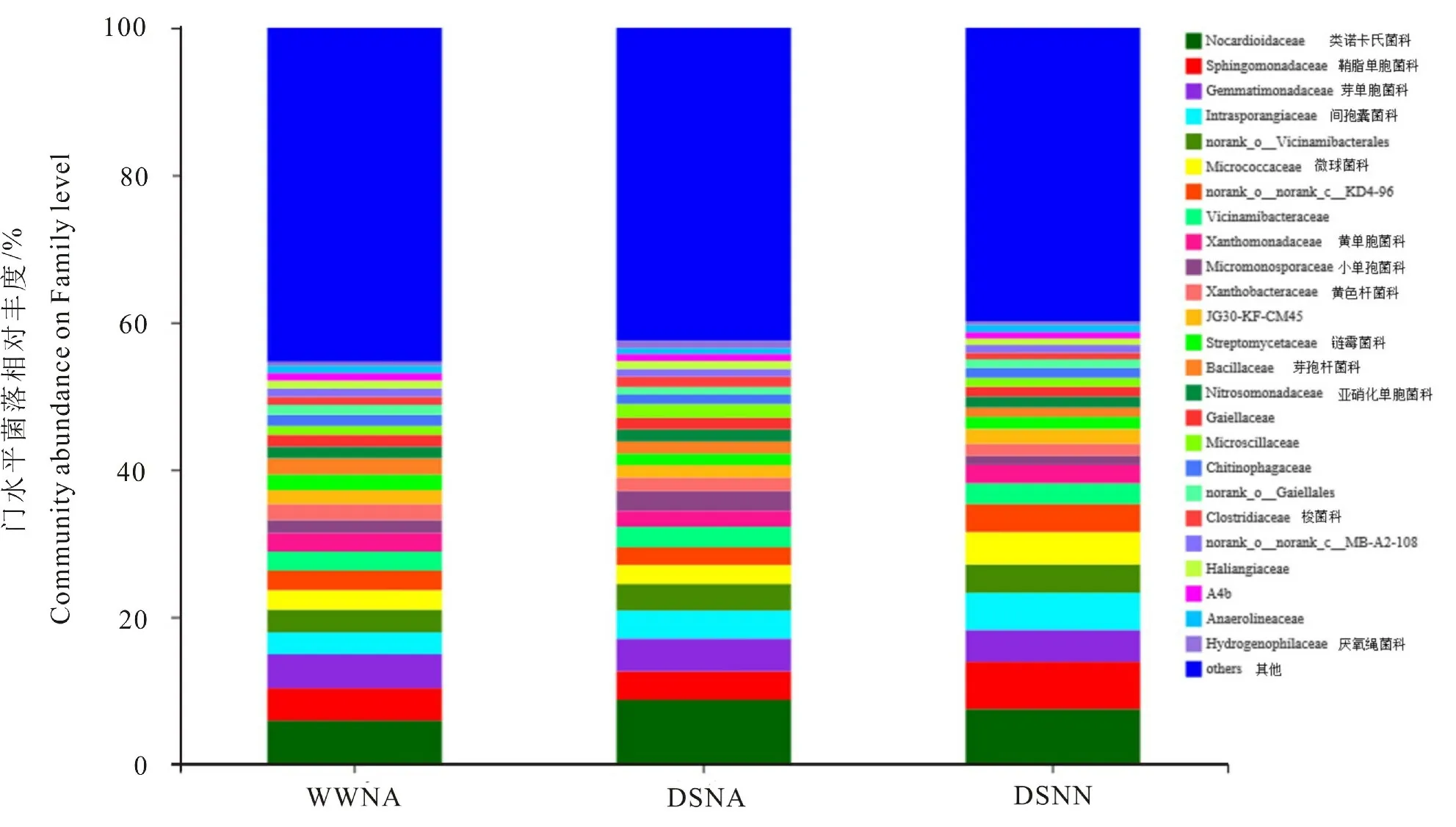
图4 科水平各样本菌落结构柱状图Fig.4 Bacterial community structure in peanut rhizosphere on Family level
2.3 Beta多样性分析
主成分分析(Principal Component Analysis,PCA 分析)是一种对数据进行简化分析的技术。通过分析不同样本群落组成可反映样本间的差异和距离。 如图5A 所示,各处理样本分布于不同象限各为一类,但同一处理3次平行重复性较好,说明各处理间根际土壤细菌群落结构存在差异。在PCA 图中,横坐标(PC1)能够解释54.42%的样品差异,纵坐标(PC2)能够解释21.22%的样品差异。 聚类分析表明,同一处理样本3次重复聚集到同一分支,不同处理样本间距离较远,差异较大,聚集于不同分支(图5B)。 由此可知,干旱胁迫和低氮胁迫等非生物逆境影响了花生根际土壤微域环境,使根际土壤细菌群落多样性产生较大差异。
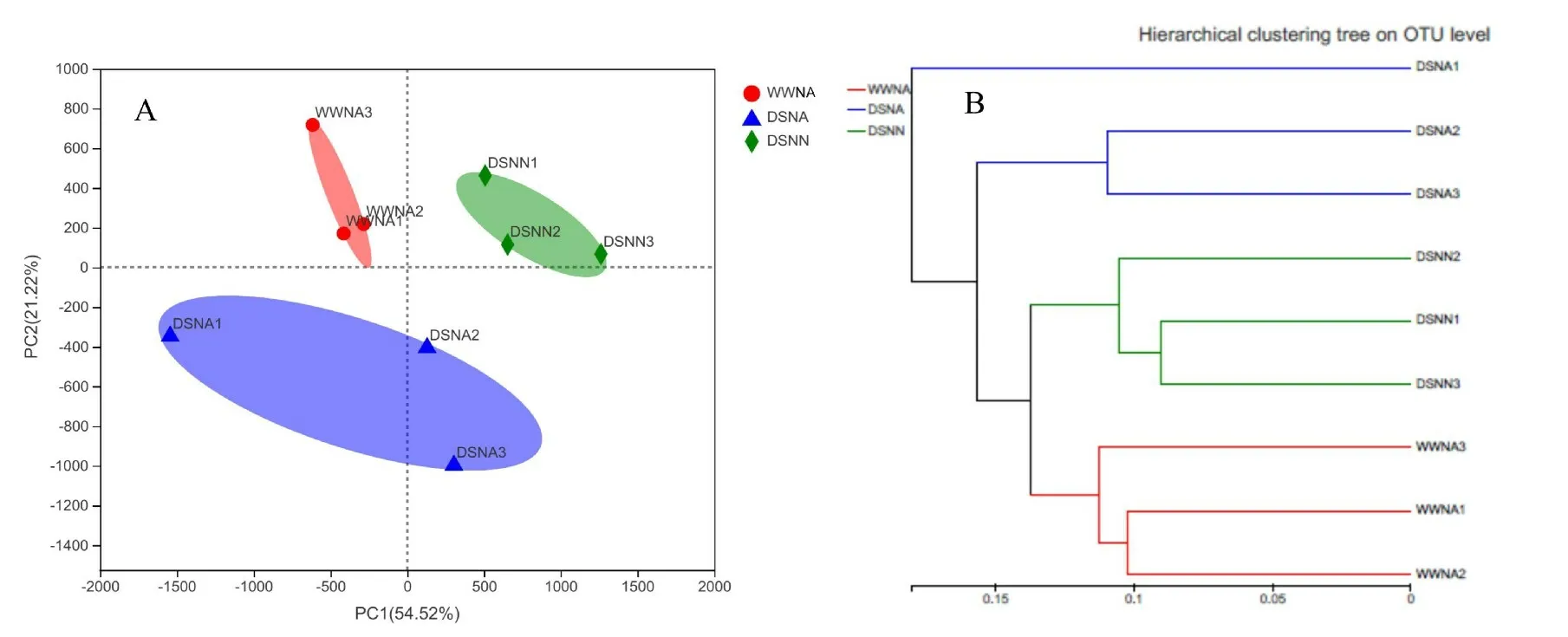
图5 Beta多样性分析Fig.5 Beta diversity analysis
2.4 16S功能预测
不同处理下花生根际细菌群落功能丰度谱通过16S功能预测获得。 分析发现氨基酸转运与代谢(Amino acid transport and metabolism)、转录(Transcription)、翻译、核糖体结构与生物发育(Translation,ribosomal structure and biogenesis)、能量生产与转换(Energy production and conversion)、细胞壁/膜/包膜的生物发育(Cell wall/membrane/envelope biogenesis)、及无机离子转运与代谢(Inorganic ion transport and metabolism)这6类功能所占的比重较大。 干旱胁迫和干旱低氮双重胁迫下细胞运动(Cell motility)和细胞内运输、分泌和囊泡运输(Intracellular trafficking,secretion,and vesicular transport)等功能基因的丰度低于对照处理。 干旱胁迫下信号转导机制(Signal transduction mechanisms)和无机离子转运与代谢等相关功能基因的丰度显著高于干旱低氮双重胁迫处理。 干旱低氮双重胁迫下防御机制(Defense mechanisms)、细胞骨架(Cytoskeleton)、核苷酸转运和代谢(Nucleotide transport and metabolism)等功能基因的丰度相对升高,表明干旱低氮双重胁迫下,花生根际土壤细菌群落产生胁迫应激反应以诱导较高的生命活动 (图6)。
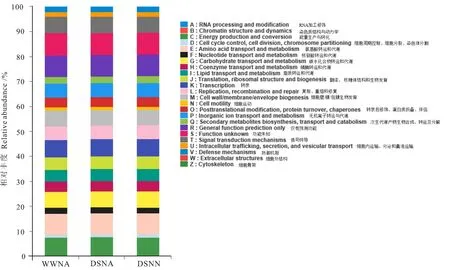
图6 16S细菌菌群功能预测Fig.6 The bacterial functional features via cluster of orthologous groups(COG)analysis
3 讨 论
根际土壤受植物根系活动的影响,其物理、化学和生物学性质不同于其他土体的微域环境。 植物根际微生物是根际的重要组成部分,其中植物根际土壤细菌具有促进植物生长发育、提高矿质养分吸收及增强植物抗逆性的作用[12]。 干旱是影响植物生长发育的重要因素之一,其对植物根际微生物群落结构和多样性组成亦有一定影响。干旱胁迫改变根系分泌物的数量和组成,诱导一系列的生理和分子反应,而根际微生物做出特定响应,使特定微生物在根际富集[13-15]。 土壤氮水平是影响根际微生物的另一重要因素,对土壤微生物多样性和群落结构有重要影响[16-18]。
徐扬等研究表明干旱及旱盐双重胁迫处理下,花生根际土壤细菌群落Alpha多样性指数与对照无显著差异[19]。 不施氮肥显著降低了茶树根际土壤微生物群落多样性[20],氮肥长期施用会降低土壤微生物数量以及细菌群落的Alpha多样性[16]。 本试验表明干旱胁迫及干旱低氮双重胁迫降低了花生根际土壤细菌群落Alpha多样性指数,与茶树中研究结果相一致[20],与徐扬等[8]研究结果略有不同的原因可能是土壤养分含量、干旱胁迫程度差异所致。 干旱胁迫下玉米根际土壤中优势菌群为变形菌、厌氧群菌和酸杆菌[7],水稻根际土壤中酸杆菌门、α-变形菌和疣微菌门等相对丰度增加[21]。 干旱胁迫提高了花生根际α-变形菌纲和蓝藻纲的相对丰度。 小麦生育期和供氮水平均驱动着小麦根际微生物群落结构的变化[22-23]。 缺氮条件下,小麦根际肠杆菌科(Enterobacteriaceae)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)等微生物丰度的增加可能提高其氮肥吸收和利用效率[24]。 本研究表明,放线菌门、变形菌门、绿弯菌门、酸杆菌门及厚壁菌门等5类为花生根际土壤细菌群落优势菌门。 变形菌门在干旱胁迫及干旱低氮双重胁迫处理下的相对丰度降低,而放线菌门和酸杆菌门的相对丰度显著升高,与前人干旱胁迫下的研究结果相一致[8,19]。 放线菌是具有厚细胞的单胚层细菌,其细胞壁具有干旱耐受性的能力[25],因此可能是其在干旱胁迫下放线菌门明显富集的原因。 酸杆菌具有寡营养的特点,因此氮营养缺乏诱导了其丰度的增加。 目和科水平上,与对照相比,干旱低氮双重胁迫均提高鞘脂单胞菌的相对表达丰度。 干旱胁迫和干旱低氮双重胁迫条件均降低了根瘤菌目的表达丰度,降低幅度分别为13.03%和20.36%。由此可知,干旱胁迫影响了花生根瘤固氮菌的活性,而双重胁迫下影响更大,与前人研究表明根瘤固氮需要一定的“起爆氮”相一致[26]。 根际土壤微生物结构受非生物胁迫的影响,优势菌群的改良对花生提高花生抗逆性具有重要作用。
16S功能预测表明非生物逆境胁迫对花生根际土壤细菌群落的功能丰度谱产生了一定影响,根际微生物细菌菌群的信号传导机制和防御机制功能在干旱胁迫处理下明显提高,这可能与植物的抗逆能力和清除有毒物质有关[27]。 干旱低氮双重胁迫处理后细胞骨架、核苷酸转运和代谢等功能基因的丰度相对升高,可能与根际土壤细菌保持旺盛的代谢和活性以抵御环境胁迫相关,与前人的研究结果相一致[19]。 已有研究表明,在土壤-植物根系-微生物交互网络中,根系细菌(根际、根表、根内等)能改变植物的激素水平或产生植物生长调节因子以促进植物根系发育,刺激植物产生抗逆信号通路,从而提高其耐旱性[12]。 因此,今后应深入研究逆境胁迫环境下花生根际微生态的生物平衡调节,探讨根系发育与土壤微生物群落结构的相关关系,为改善根际土壤微生态环境和提高植物抗逆性提供重要理论支撑。
4 结 论
与对照相比,干旱胁迫和干旱低氮双重胁迫处理降低了根际土壤细菌群落多样性。 花生根际土壤细菌群落均以放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、 绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)及厚壁菌门(Firmicutes)等优势菌门为主。 干旱胁迫及干旱低氮胁迫处理均不同程度地提高了放线菌门和酸杆菌门的相对丰度,而降低了变形菌门的相对丰度。 干旱胁迫降低了γ-变形菌纲和根瘤菌目的表达丰度,而干旱低氮双重胁迫加剧了其表达量的降低。 干旱低氮双重胁迫增加了细胞骨架、核苷酸转运和代谢等相关功能基因在根际土壤中的富集。 对花生干旱和低氮胁迫下花生根际土壤细菌群落的功能调节并发掘新的功能类群是改善逆境下花生生长的可行途径。

