microRNA-132和Mecp2在甲基苯丙胺依赖中的作用
石振金,张瑞林,王一航,吴亚梅,杨根梦,沈宝玉,王 上,刘鹏亮, 朱婷娜,赵永娜,李利华,张冬先,洪仕君
(1.昆明医科大学法医学院,云南 昆明 650500;2.楚雄医药高等专科学校,云南 楚雄 675005; 3.昆明医科大学药学院暨云南省天然药物药理重点实验室,云南 昆明 650500)
甲基苯丙胺(methamphetamine,MA)是一种安非他明类中枢神经系统兴奋剂,MA滥用者在我国240.4万名在册吸毒人员中占比56.1%[1],是滥用人数最多的毒品类型。MA具有极强的依赖性,会引起认知障碍、焦虑、抑郁以及暴力行为等精神系统障碍症状,甚至中毒导致因脑出血、缺血缺氧而昏迷或死亡。迄今为止MA的依赖机制尚未明确。微RNA(micro RNA,miRNA)是脑内广泛存在的基因转录调控因子,调节神经元凋亡和突触相关基因表达。既往研究表明,miRNA-132在中枢神经系统中的异常表达可能与MA诱发的神经毒性作用密切相关。在miRNA-132基因上游调控序列中存在转录激活因子环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)结合位点,而与中枢神经发育相关的甲基化CpG结合蛋白2(methyl CpG binding protein 2,Mecp2)则为miRNA-132的直接作用靶点之一。但miRNA-132、Mecp2在MA所致神经毒性损害和依赖中的作用尚未见文献报道。因此,本文试图探讨MA是否可通过CREB调控miRNA-132影响miRNA-132及Mecp2的表达,从而参与MA的依赖机制。
1 材料与方法
1.1 药品、试剂和仪器甲基苯丙胺由云南省公安厅公安部禁毒技术重点实验室合法提供,化学法提纯后用生理盐水配制成10 g·L-1的MA溶液(现用现配)。Mecp2一抗(兔抗,1 ∶1 000,Cell Signaling公司,D4F3,#3456),p-Mecp2一抗(兔抗,1 ∶1 000,Novus公司,pSer421,#NBP2-29524),CREB一抗(兔抗,1 ∶1 000,Cell Signaling公司,D76D11,#9197),p-CREB一抗(兔抗,1 ∶1 000,Cell Signaling公司,Ser133,#9198),β-actin(鼠抗,1 ∶5 000,Proteintech 公司,66375-1-Ig,#2D4H5)。HRP标记山羊抗鼠的二抗(1 ∶5 000,Abbkine公司,A21010),HRP标记山羊抗兔的二抗(1 ∶5 000,Abbkine公司,A21020),mRNA逆转录试剂盒(BestarTMqPCR RT Kit,DBI Bioscience,DBI-2220),qPCR检测mRNA试剂盒(BestarR SybrGreen qPCR Mastermix,DBI Bioscience,DBI-2043),miRNA逆转录试剂盒(All-in-oneTMmiRNA First-Strand cDNA Synthesis Kit,GeneCopoeia,QP014),qPCR检测miRNA试剂盒(All-in-oneTMmiRNA qPCR Kit,GeneCopoeia,QP011)。
主要仪器:条件性位置偏爱检测设备(上海欣软信息有限公司,型号XR-XT401);电泳仪、膜转印装置(Bio-Rad公司);PCR仪(Bio-Rad公司,型号T100TMThermal Cycler),荧光定量PCR仪(Bio-Rad公司,型号C1000 TouchTMThermal Cycler)。
1.2 动物模型雄性SD大鼠60只,5~6周龄,体质量(180~220) g,购于昆明医科大学实验动物学部[许可证号:SCXK(滇)2011-0004],随机分成6组,分别为MA依赖1周、2周、4周组及对照的生理盐水组。腹腔注射MA(10 mg·kg-1·d-1)与生理盐水(10 mg·kg-1·d-1)10 d后,用 条件性位置偏爱(conditioned place preference,CPP)及刻板行为(stereotyped behavior,SB)评分确认大鼠产生MA依赖,再分别给药1、2、4周建立不同依赖时程MA依赖模型,再用CPP实验和SB评分检测行为学改变。末次给药24 h后,用10 g·L-1水合氯醛麻醉,灌注取脑,分离额叶皮质、海马组织,置于-80 ℃超低温冰箱保存。
1.3 Western blot检测蛋白质表达脑组织解冻后称取约200 mg,用含蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液裂解,BCA法检测蛋白浓度,加入上样缓冲液(5X)后混匀、变性。以50 ng上样,SDS-PAGE电泳分离,半干转膜仪转至0.45 μm PVDF膜上;膜用5%脱脂奶粉(或5% BSA)于摇床上室温封闭1 h,分别加入相应Mecp2一抗,p-Mecp2一抗,CREB一抗和p-CREB一抗(1 ∶1 000)4 ℃孵育过夜,再加入相应种属二抗(1 ∶5 000)室温孵育2 h;ECL化学发光显色,Bio-Rad凝胶成像仪显影成像。ImageJ图像软件分析Western blot条带灰度值,计算目的蛋白相对于内参β-actin的相对含量,磷酸化目的蛋白相对于总蛋白的相对含量。
1.4 RT-qPCR检测miRNA及mRNA
1.4.1RT-qPCR引物信息 经NCBI网站查询目的基因序列信息后,用Primer Premier 5软件设计引物,由上海生工生物工程技术有限公司合成(Tab 1)。

Tab 1 Primer sequences for qPCR
1.4.2实验步骤 脑组织解冻后称取约100 mg,用TRIzol法提取总RNA,以2 μg 总RNA进行RT-qPCR反应。①用mRNA逆转录试剂盒合成cDNA,再用qPCR试剂盒检测Mecp2 mRNA,以GAPDH为内参基因。②用miRNA试剂盒合成第一链cDNA,再用qPCR试剂盒检测miRNA-132,以U6为内参基因。2-△△ct法比较各组mRNA和miRNA的表达差异。

2 结果
2.1 动物模型建立MA依赖1、2、4周组大鼠在伴药箱的停留时间明显增加,均产生明显CPP效应。大鼠出现明显的兴奋性及刻板行为,刻板行为评分随着依赖时间延长而减少。实验结果参见课题组前期发表的数据[2]。
2.2 RT-qPCR检测miRNA-132、Mecp2 mRNA表达miRNA-132在甲基苯丙胺依赖1、2周组(P<0.01)和4周组(P<0.05)额叶皮质中表达明显升高;在海马中表达呈降低趋势,其中在MA依赖2、4周组明显降低(P<0.01)(Fig 1A)。Mecp2 mRNA在MA依赖1、2、4周组额叶皮质(P<0.05或P<0.01)和海马(P<0.01)中表达均升高(Fig 1B)。
2.3 额叶皮质中Mecp2、p-Mecp2、CREB、p-CREB表达Mecp2在MA依赖1、2、4周组(P<0.01)额叶皮质中表达明显降低(Fig 2A,B),且磷酸化水平呈升高趋势,在MA依赖1、2周组(P<0.01)中磷酸化水平明显升高(Fig 2A,C)。CREB在1、2、4周组额叶皮质中表达无明显变化(Fig 2A,D),但磷酸化水平呈降低趋势,在1、4周组中磷酸化水平明显降低(P<0.01)(Fig 2A,E)。

Fig 1 Expression of miRNA-132 and Mecp2 mRNA in frontal cortex and hippocampus of MA-induced
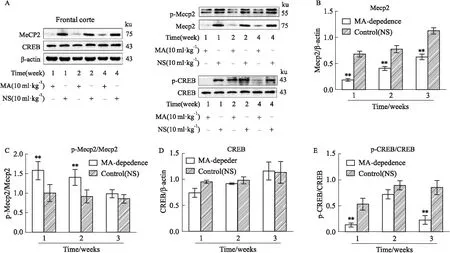
Fig 2 Expression of Mecp2, p-Mecp2/Mecp2, CREB and p-CREB/ CREB in frontal cortex of MA-induced
2.4 海马中Mecp2、p-Mecp2、CREB、p-CREB表达Mecp2在MA依赖1周组(P<0.05)海马中表达明显升高,之后呈降低趋势,在MA依赖4周组(P<0.05)中表达明显降低(Fig 3A,B)。Mecp2的磷酸化水平在MA依赖1周组(P<0.01)表达明显降低,之后呈升高趋势,在MA依赖2周组(P<0.01)中明显升高(Fig 3A,C)。CREB及其磷酸化在MA依赖1、2、4周组海马中均无明显表达变化(Fig 3 A,D-E)。
3 讨论
本研究以腹腔注射MA建立1、2、4周不同时程的MA依赖大鼠模型,MA在各实验组均导致大鼠表现出明显的CPP效应。CPP实验利用条件性刺激影响动物位置偏好,以产生药物依赖动物的行为学特点评价药物的依赖性,是评价动物出现药物依赖的经典动物模型。
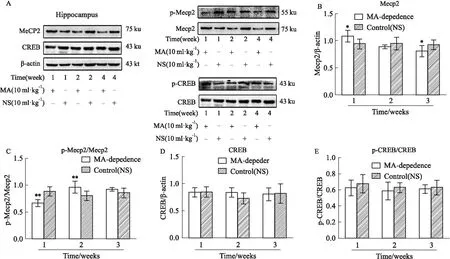
Fig 3 Expressions of Mecp2, p-Mecp2/Mecp2, CREB and p-CREB/CREB in hippocampus of MA dependent n=3)
额叶皮质、海马是调节行为活动、认知功能、学习和记忆的重要脑区,miRNA-132在MA依赖1、2、4周组额叶皮质中表达明显升高,在海马中则表达降低,虽然两个脑区miRNA -132的表达趋势不一致,但均存在明显的异常表达。此前,有研究在体外培养miRNA-212/132敲除幼鼠皮质神经元,神经元有出现树突短缩、分叉等改变[3],靶向敲除miRNA-212/132基因会对海马中mRNA的转录谱产生广泛影响,并出现空间记忆、识别记忆和认知功能障碍[4],miRNA-132表达减少会增加神经退行性疾病的患病率。但Chen等[5]在神经干细胞转染miRNA-132后,也发现miRNA-132通过影响细胞周期,促进细胞凋亡来抑制神经元的分化,且促进胶质细胞分化。维持miRNA-132稳定在中枢神经系统功能调节具有重要作用,miR-132轻度表达增加可增强认知功能,但超生理水平的miR-132则会损害学习功能[6]。上述研究结果说明miRNA-132参与了调节MA依赖引起的神经损害作用。
miRNA为小分子单链非编码RNA,是基因转录后调控因子,由RNA聚合酶II编码生成初级产物pre-miRNA,经Dicer酶切后形成约20个核苷酸的双链miRNA,其中一链与靶mRNA的3′非编码区互补配对,一方面装载成RISC沉默复合体降解mRNA,另一方面与翻译起始区结合抑制mRNA翻译[7]。在MA依赖者的血浆、外泌体以及组织中均发现包括miRNA-132在内的miRNA的异常表达。miRNA-132位于人17号和大鼠10号染色体,与miRNA-212合称为miRNA-212/132家族[8]。MA可增加第二信使环磷酸腺苷(cAMP)分泌,活化CREB后与miRNA-212/132基因上游CRE位点的结合,调节miRNA-212/132的生成[9]。CREB参与MA依赖机制已有多篇文献报道,MA通过cAMP / PKA / CREB通路实现CREB的磷酸化激活,CREB活化后与c-fos、fosb、Syp、BDNF等基因的启动子结合而发挥作用[10],miRNA-132亦受CREB的调控。本研究中,CREB的表达在额叶皮质无明显差异,MA在1周和4周组中抑制了CREB的磷酸化,而海马中CREB及其磷酸化均无明显差异。有报道认为MA可抑制伏隔核、海马中CREB的磷酸化激活,但在不同依赖时程、不同脑区组织中CREB蛋白的磷酸化水平存在差异[11],CREB磷酸化在MA依赖中可能无稳定的表达变化趋势,CREB磷酸化水平降低也未影响miRNA-132的表达。MA可能通过其他转录因子介导调节miRNA-132表达,如已报道的MSK1/2、ERK1/2途径等[12],有待深入探索。
Mecp2 mRNA为miRNA-132的作用靶点之一。Mecp2为甲基CpG结合域家族成员,可招募胞嘧啶甲基转移酶、组蛋白去乙酰化酶和其他染色质重塑蛋白介导基因沉默[13],而Chahrous等[14]检测缺失或过表达Mecp2小鼠下丘脑内基因表达时,发现大部分靶基因被Mecp2激活,其兼具转录激活因子和抑制因子作用。Mecp2基因缺陷为中枢系统发育障碍性疾病Ratt综合征的主要病因,对神经元成熟、突触形成和突触可塑性具有调节作用。在额叶皮质,MA依赖各组中Mecp2 mRNA表达均升高,而Mecp2蛋白表达降低,与miRNA-132对Mecp2 mRNA的转录后调控作用的理论相吻合,miRNA-132对Mecp2 mRNA有转录后抑制作用。但在海马,MA依赖各组中miRNA-132表达降低,Mecp2 mRNA表达升高,Mecp2蛋白在MA依赖1周组时表达增加,此后随MA依赖时间的延长而降低,在MA依赖4周组中Mecp2的表达降低尤为明显,miRNA-132与Mecp2表达趋势未呈现负对应关系。此前,Aten等[15]在昼夜节律研究中也发现,miRNA-132在海马表达变化会影响神经元形态和记忆功能,但Mecp2与miRNA-132表达趋势一致,认为在蛋白表达/调控水平上,中枢内的动力学改变也会影响miRNA的功能效果,mRNA稳定性和翻译速率以及蛋白质的半衰期,均影响着miRNA的作用效应。Morozova等[16]也提出miRNA的作用模式还取决与靶mRNA的自身特征,因此,存在多个靶点时,并非所有靶点表达均受影响。Im等[17]则提出miRNA-212/132和Mecop2之间的作用稳态可调节可卡因的摄取,观察到连续注射7 d可卡因后Mecp2在纹状体和海马中高表达,在额叶皮质中则表达降低,海马中Mecp2的表达与本研究MA依赖1周组的结果相似。Deng等[18]的研究也表明,Mecp2参与慢性MA依赖中兴奋性和抑制性信号传递,慢性MA作用会增加Mecp2磷酸化而调节中枢内蛋白的转录活动,与之相似的是,本研究中MA依赖中Mecp2磷酸化水平也有明显增加。上述结果均说明,Mecp2在MA依赖所致的毒性损害中有调节作用,但额叶皮质和海马两个脑区中Mecp2的作用模式存在差异。
综上,MA依赖可诱导额叶皮质和海马脑区中miRNA-132的异常表达。在额叶皮质,miRNA-132可能通过抑制Mecp2 mRNA的翻译,致Mecp2蛋白表达降低;但在海马,miRNA-132 与Mecp2表达趋势未呈现负对应关系。研究结果提示miRNA-132与Mecp2参与了调节MA诱导的神经毒性损害,miRNA-132在额叶皮质中的作用可能是通过Mecp2发挥的,但在海马中并不依赖于Mecp2发挥其作用,Mecp2在额叶皮质和海马中的作用模式和机制存在差异。

