甲状旁腺激素对大鼠脊髓损伤后骨质疏松的作用和机制
肖振平,龙 慧,2,邹 聪,蒋李平,何云武
(南华大学1. 附属第二医院疼痛康复科,湖南 衡阳 421003;2. 基础医学院,湖南 衡阳 421001)
骨质疏松(osteoporosis,OP)是脊髓损伤(spinal cord injury,SCI)后的一种常见性继发性并发症。研究表明OP的临床表现主要为骨量减少、骨微结构性退化并最终诱发骨脆性增加、骨折,甚至导致患者死亡,严重的危害患者的生命健康[1]。因此,积极探寻有效药物治疗对于改善OP尤为关键。
甲状旁腺激素(parathyroid hormone,PTH)是由甲状旁腺分泌的一种多肽链激素分子,其能够通过靶向骨骼肌、小肠以及肾脏等器官从而调节机体钙、磷代谢平衡。以往文献表明,PTH能够增强破骨细胞活性、促进骨吸收、升高血钙等[2]。另外,PTH也能够通过促进骨髓间充质干细胞向骨细胞分化、增加机体骨形成,改善骨密度,从而改善骨骼肌功能[3]。但是目前有关PTH对OP的作用机制尚不完全清楚。以往研究显示磷酸肌醇3-激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)/蛋白质丝氨酸苏氨酸激酶(protein kinase B,AKT)信号与SCI密切相关。与sham组大鼠相比,SCI组大鼠p-PI3K/PI3K和p-Akt/Akt蛋白表达显著降低,激活PI3K/Akt能够改善SCI大鼠组织炎症和细胞凋亡,缓解OP[4-5]。另外,在大鼠SCI模型中miR-146a表达显著降低[6],过表达miR-146a能够通过TLR/NF-κB信号通路促进大鼠SCI的修复并减少炎症反应[7]。以上研究表明通过激活PI3K/Akt或是促进miR-146a表达能够改善大鼠SCI后OP。但是有关PTH能否通过促进miR-146a表达,从而激活PI3K/Akt信号改善大鼠SCI后OP尚不清楚。既往研究显示心力衰竭大鼠左心腔内注射miR-146a能够通过抑制PI3K/Akt信号通路抑制心肌细胞凋亡,促进疾病的发生与发展[8],表明miR-146a是PI3K/Akt信号调控的上游因子。本研究在大鼠模型上证实了PTH在改善脊髓损伤后OP的同时也上调了骨组织miR-146a、PI3K和Akt的表达水平。而miR-146a抑制剂的使用不仅拮抗PTH对OP的改善,也同时拮抗PTH对miR-146a、PI3K和Akt表达的上调作用。说明PTH是通过上调miR-146a表达进而激活PI3K/Akt信号通路,即调控miR-146a/PI3K/Akt信号轴,从而改善大鼠OP的。我们的研究结果可为OP的临床治疗提供新思路。
1 材料与方法
1.1 材料
1.1.1动物 ♂,6周龄,SPF级SD大鼠40只,体质量(18-200)g,购自于南华大学医学院实验动物学部,许可证号:SYXK(湘)2019-0025,动物实验经过南华大学附属第二医院动物伦理委员会审核批准(批准号:202002003)。
1.1.2药品与试剂 甲状旁腺激素1-34(批号:S110819-04,纯度≥97%,100 μg/支,上海吉尔生化有限公司);血钙检测试剂盒(批号:201935,南京建成生物技术公司);碱性磷酸酶检测试剂盒(批号:201934,南京建成生物技术公司);苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒(批号:C0105S,上海碧云天生物技术);逆转录试剂盒、SYBR Premix Ex Taq以及TRIzol Reagent(日本TAKARA公司);Akt抗体(批号:ab8805,英国Abcam公司);p-Akt抗体(批号:ab38449,英国Abcam公司);PI3K抗体(批号:ab32536,英国Abcam公);p-PI3K抗体(批号:ab76302,英国Abcam公司);β-actin抗体(批号:AF5001,上海碧云天生物技术);羊抗兔IgG抗体(批号:A0239,上海碧云天生物技术);羊抗鼠IgG抗体(批号:A0192,上海碧云天生物技术);极超敏ECL化学发光试剂盒(批号:P0018FS,上海碧云天生物技术)。
1.1.3仪器 TWK-FST32型组织匀浆仪(武汉泰普拓公司);Micro17R型高速冷冻离心机(赛默飞世尔科技(中国)有限公司);GPJ9-TS100-F型倒置荧光显微镜(日本尼康(Nikon)公司);FC型全自动多功能酶标检测仪(赛默飞世尔科技(中国)有限公司);7170A型全自动生化分析仪(日本日立公司);LUNAR- Prodigy型双能X线骨密度测定仪(美国GE公司);1658033型电泳仪(美国伯乐Bio-Rad公司);ChemiDoc XRS+成像系统(美国Bio-Rad公司)。
1.2 方法
1.2.1动物建模与分组 实验SD大鼠在25 ℃,相对湿度50%-70%的室内适应性喂养7 d,期间自由因饮水、饮食。实验分为假手术组(Sham)、脊髓损伤组(SCI)、脊髓损伤+甲状旁腺激素组(SCI+PTH)、SCI+PTH+转染miR-146a无关片段组(SCI+PTH+NC)以及SCI+PTH+转染miR-146a抑制剂组(SCI+PTH+miR-146a inhibitor),每组各10只。其中SCI、SCI+PTH、SCI+PTH+NC和SCI+PTH+miR-146a inhibitor组大鼠构建脊髓损伤模型:大鼠腹腔麻醉,将其取仰卧位固定在大鼠板上,采用剃毛刀剔除大鼠背部手术部位毛发并对其进行消毒。之后利用手术剪刀剪开大鼠背部皮肤使其暴露T9~T11节椎间板与棘突,将T10节椎板切除,并将大鼠脊髓向外缘扩展大约2.5 mm直径的圆形区域,在此区域内于硬膜表层处放置与脊髓表层弯曲度相同的塑料隔片,之后使用砝码(10 g)顺沿玻璃导管垂直下落,打击隔片以制造出大鼠脊髓损伤,Sham组大鼠仅剪开背部皮肤使其暴露T9-T11节椎间板与棘突,之后封闭手术切口并给予青霉素钠皮下注射(2万U·d-1)。在造模成功的基础上大鼠每3 d一次尾静脉注射给予60 μg·kg-1PTH(SCI+PTH组)、60 μg·kg-1PTH及20 pm miR-146a NC(SCI+PTH+NC组)或60 μg·kg-1PTH及20 pm miR-146a inhibitor(SCI+PTH+miR-146a inhibtor组),连续8周。Sham组和SCI组大鼠同法给予等量的生理盐水。
1.2.2各组大鼠行为学评分 依据BBB评分法[9]对各组大鼠进行包括髋关节、踝关节、膝关节以及躯干运动和协调情况进行相关观察,记录手术后1 d、7 d、14 d、21 d、28 d、56 d大鼠行为运动评分,为保证实验数据的准确性,实验通过4人独立观察并打分。BBB评分标准:共21分,全瘫即为0分,正常为21分。
1.2.3骨代谢相关生化指标检测 各组大鼠处理8周后,进行心脏采血并于4 ℃,3 000 r·min-1,离心10 min,取其上清,采用7170A型全自动生化分析仪进行免疫比浊法测定血清钙(calcium,Ca)和碱性磷酸酶(alkaline phosphatase,ALP)含量。
1.2.4骨密度测定 实验各组大鼠处理8周后,采用LUNAR- Prodigy型双能X线骨密度测定仪对大鼠股骨近端以及胫骨近端的骨密度进行测定,每组共计10只SD大鼠。实验操作由2人独立完成,取其平均值即为实验大鼠骨密度值。
1.2.5HE染色 各组大鼠麻醉后,迅速采用断头处死,剪取8周大鼠脊髓损伤部位的脊髓组织,采用4%的多聚甲醛固定各组大鼠脊髓组织,脱水、透明、包埋、石蜡切片,并按照HE染色试剂盒进行脊髓组织染色,显微镜下观察各组大鼠脊髓组织形态学变化。
1.2.6实时荧光定量PCR检测miR-146a表达 依据RNA提取试剂盒说明书步骤提取各组大鼠脊髓总RNA,并运用紫外分光光度计检测总RNA的浓度与纯度。以RNA为模板,参照逆转录试剂盒说明书步骤将其逆转录为单链cDNA。再以cDNA为模板,根据广州锐博公司设计合成的PCR引物进行扩增。扩增条件:92 ℃,30 s;92 ℃,5 s;60 ℃,31 s,共进行30个循环。采用7300 System SDS Software 分析数据,根据2-ΔΔCt值相对定量样本中目的基因表达水平。

Tab 1 Sequence of primer
1.2.7Western blot检测PI3K、Akt蛋白表达 取8周各组大鼠手术截取的脊髓损伤部位的脊髓组织,组织碾磨,裂解;BCA法测定蛋白质浓度;凝胶电泳;湿转转膜;上样;用5%脱脂牛奶室温封闭2 h,孵育对应Akt抗体(1 ∶1 000),p-Akt抗体(1 ∶1 000),PI3K抗体(1 ∶1 000),p-PI3K抗体)以及β-actin抗体(1 ∶2 000),4 ℃过夜,孵育对应的羊抗兔IgG抗体或者羊抗鼠IgG抗体(1 ∶5 000)1~2 h,;摇床摇晃上加TPBS洗涤3次,5 min/次,然后加入显影液,显影并拍照。Akt、p-Akt、PI3K、p-PI3K蛋白表达水平则以目的蛋白条带灰度值与β-actin灰度值相比反映。
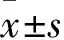
2 结果
2.1 PTH对大鼠BBB评分的影响手术后1 d、7 d、14 d、21 d、28 d、56 d大鼠BBB行为运动评分显示,与Sham组相比,SCI组大鼠BBB评分均明显降低(P<0.05或P<0.01)。与SCI组相比,SCI+PTH组大鼠均明显升高(P<0.05或P<0.01)。与SCI+PTH组相比,SCI+PTH+miR-146a inhibitor组大鼠BBB评分明显降低(P<0.05或P<0.01)(Tab 2)。
2.2 PTH对大鼠血清Ca和ALP含量的影响手术后8周,与Sham组相比,SCI组大鼠血清Ca含量明显降低(P<0.01),ALP含量明显升高(P<0.01)。与SCI组相比,SCI+PTH组大鼠血清Ca含量均明显升高(P<0.05或P<0.01),ALP含量均明显降低(P<0.05或P<0.01)。与SCI+PTH组相比,SCI+PTH+miR-146a inhibitor组大鼠血清Ca含量降低(P<0.01),ALP含量升高(P<0.01)(Fig 1)。
2.3 PTH对大鼠骨密度的影响手术后8周,与Sham组相比,SCI组大鼠股骨近端以及胫骨近端的骨密度均明显降低(P<0.01)。与SCI组相比,SCI+PTH组大鼠股骨近端以及胫骨近端的骨密度均升高(P<0.05或P<0.01)。与SCI+PTH组相比,SCI+PTH+miR-146a inhibitor组大鼠股骨近端以及胫骨近端的骨密度均降低(P<0.05或P<0.01)(Fig 2)
2.4 PTH对大鼠脊髓形态学的影响手术后8周,HE染色显示,Sham组大鼠骨组织结构完整,骨质密度粗壮,形态完整,连接紧密,骨细胞排列齐整,有大量的骨小梁存在。SCI组大鼠出现典型的骨质疏松症状,表现为骨小梁减少、稀疏,骨细胞间隙增宽并伴有骨板层结构疏松等,SCI+PTH和SCI+PTH+NC组大鼠骨组织结构相对完整,骨质密度变密,且骨小梁数目明显高于SCI组,骨质细胞连续性较好,细胞排列基本齐整。SCI+PTH+miR-146a inhibitor组大鼠表现为骨细胞间隙增宽等且出现典型的骨质疏松现象(Fig 3)。

Tab 2 Comparison of BBB scores of rats in each

Fig 1 Comparison of serum Ca and ALP levels in rats of each n=10)

Fig 2 Effect of PTH on bone mineral density in n=10)

Fig 3 Observation of morphological changes of spinal cord of each group of rats by HE staining(400×)
2.5 PTH促进miR-146a表达手术后8周,RT-PCR检测显示,与Sham组相比,SCI组大鼠骨髓组织miR-146a表达下调(P<0.01)。与SCI组相比,SCI+PTH组大鼠骨髓组织miR-146a表达均明显上调(P<0.05)。与SCI+PTH组相比,SCI+PTH+miR-146a inhibitor组大鼠骨髓组织miR-146a表达下调(P<0.01)(Fig 4)。

Fig 4 Expression level of miR-146ain each group of n=10)
2.6 PTH促进p-PI3K、p-Akt 蛋白表达手术后8周,Western blot检测显示,与Sham组相比,SCI组大鼠骨髓组织p-PI3K、p-Akt蛋白表达均明显降低(P<0.01)。与SCI组相比,SCI+PTH组大鼠骨髓组织p-PI3K、p-Akt蛋白表达均升高(P<0.05或P<0.01)。与SCI+PTH组相比,SCI+PTH+miR-146a inhibitor组大鼠骨髓组织p-PI3K、p-Akt蛋白表达均降低(P<0.05或P<0.01)(Fig 5)。
3 讨论
SCI是一种严重性致残性伤害,可导致脊髓支配运动、感觉以及自主神经功能障碍等多种并发症的发生。因此,积极的治疗SCI对于改善患者继发性并发症,减轻家庭负担具有重要意义。目前有关SCI的临床治疗措施主要包括急性期保护措施、并发症治疗、康复治疗、SCI修复治疗如神经因子、相关激素、组织干细胞移植治疗等[10]。研究表明PTH作为SCI修复激素治疗对于改善其临床并发症具有显著疗效[11]。另外,PTH在维持SCI后OP中具有双重调节作用,一方面可以增加成骨细胞数量、促进骨生长因子释放,进而促进骨形成。另一方PTH能够增加破骨细胞活性,促进骨吸收[2]。血清Ca和ALP是骨代谢的关键性生化指标,其中Ca参与机

Fig 5 Effect of PTH on PI3K/Akt signal
体内矿物质平衡以及骨骼肌生长发育等。ALP是与骨形成和骨细胞活性密切相关的生化指标。通过检测血清Ca和ALP含量能够反映SCI后OP状况。基于以上本研究首先通过构建SCI大鼠模型探究PTH能够改善SCI并发OP。结果显示,与Sham组相比,SCI组大鼠BBB评分均明显降低,血清Ca降低、ALP升高,股骨近端以及胫骨近端的骨密度降低且脊髓组织出现典型的骨质疏松症状,表现为骨小梁减少、稀疏,骨细胞间隙增宽并伴有骨板层结构疏松,表明SCI大鼠模型构建成功。而SCI+PTH组大鼠上述症状得到明显改善。以上研究初步表明PTH对SCI后OP大鼠具有一定治疗作用,但是有关PTH对SCI的具体作用机制尚不完全清楚。
miRNA是一类广泛存在于真核生物中的小分子非编码RNA,其在SCI的发生发展中发挥重要作用[12]。既往研究证实,miRNA能够靶向抑制目标蛋白mRNA,抑制转录和翻译过程,参与了机体细胞的增殖、分化以及代谢等病理生理过程,特别是在SCI的进展中起到至关重要的作用[13]。研究miR-146a是位于染色体5q24参与SCI骨髓细胞凋亡和炎症反应。在SCI小鼠模型中通过基因芯片筛选显示miR-146a表达明显降低,其表达水平与SCI损伤程度呈负相关[14]。表明miR-146a可能是SCI病理过程中的重要调控因子。但是有关PTH能否通过影响miR-146a表达进而改善SCI尚不清楚。因此,本研究通过RT-PCR检测各组大鼠脊髓组织miR-146a水平。结果显示与Sham组相比,SCI组miR-146a表达明显下调。与SCI组相比,SCI+PTH组大鼠骨髓组织miR-146a表达均明显上调。以上研究结果表明PTH能够通过促进miR-146a表达,继而改善SCI后OP。PI3K/Akt信号是与SCI骨髓细胞增殖、凋亡、炎症以及成骨等密切相关。以往文献报道显示激活PI3K/Akt能够增加星形胶质神经营养因子和粘附分子释放,增强体外伤口修修复,从而促进SCI大鼠后肢运动功能恢复[15]。另外,PTH通过PTH受体激活下游PI3K/Akt/Bad通路从而发挥抗成骨样细胞凋亡作用[16]。因此,本实验通过Western blot检测显示与Sham组相比,SCI组大鼠骨髓组织p-PI3K、p-Akt蛋白表达均明显降低。与SCI组相比,SCI+PTH组大鼠骨髓组织p-PI3K、p-Akt蛋白表达均显著升高。本研究结果与Chen等[4]研究一致。表明PTH能够通过促进PI3K/Akt信号活化,改善大鼠SCI后OP。为进一步明确miR-146a/PI3K/Akt信号在PTH治疗SCI中的关键调控作用。本研究通过SCI大鼠尾静脉注射miR-146a inhibitor,观察PTH是否通过上调miR-146a,从而激活PI3K/Akt信号,并最终改善SCI后OP。结果显示与SCI+PTH组相比,SCI+PTH+miR-146a inhibitor组大鼠骨髓组织p-PI3K、p-Akt蛋白表达均显著降低,BBB评分明显降低、血清Ca含量降低,ALP含量升高、股骨近端以及胫骨近端的骨密度均降低且伴有典型的骨质疏松症状。以上研究结果表明PTH能够通过miR-146a/PI3K/Akt信号改善SCI后大鼠OP。既往研究显示miR-146a能够通过PI3K/Akt信号调控肿瘤细胞、巨噬细胞等增殖、迁移等[17-18]。因此,在PTH改善SCI大鼠OP时miR-146a可能是PI3K/Akt的关键上游调控因子。
综上所述,本研究通过探究PTH对SCI后大鼠OP的影响及其作用机制。结果显示PTH对SCI骨质疏松症具有一定的治疗作用,其机制可能通过调控miR-146a/PI3K/Akt信号实现。

