基于HK-2细胞的左金丸中生物碱类组分体外毒性筛选及机制初探
杨春启,连闻雨,林 毅,谢光辉,马增春,谭洪玲,肖成荣,王宇光,高 月
(1.安徽医科大学,安徽 合肥 230032;2.军事科学院军事医学研究院 辐射医学研究所,北京 100850;3.广东药科大学,广东,广州 510006)
经典名方左金丸最早出自于医学名家朱丹溪撰写的《丹溪心法》,又被称之为回令丸,六一丸或茱萸丸[1]。左金丸原方由黄连和吴茱萸两味单药按照6:1配伍制成,其具有清肝泻火,降逆止呕的功效,临床主要用于治疗肝火犯胃等症状[2]。此外,根据黄连和吴茱萸配比不同又被称为甘露散、反左金丸等[3]。
左金丸在临床应用广泛,但研究发现左金丸中单药黄连能够诱发并加重新生儿黄疸,新加坡政府于1978年认定其为有毒中药并严禁临床使用。蔡薇等[4]通过体内实验认为,黄连能够明显降低体内胆碱酯酶活性并产生毒性作用,并且毒性强弱与药物的品种,使用方法及药物剂量有关系。黄连中主要生物碱为小檗碱、黄连碱、表小檗碱和小檗红碱等[5],其中小檗碱在高脂饮食患者中能够加重肾脏毒性[6]。此外,左金丸中单药吴茱萸在药典中被记录为小毒中药,李文兰等[7]研究表明吴茱萸碱(Evodiamine,EVO)具有潜在的肝肾及胃肠道毒性,临床报道中由于不当使用吴茱萸而造成的中毒事件也时有发生。周倩等[8]探讨吴茱萸中成分吴茱萸碱、吴茱萸次碱、吴茱萸内酯和辛弗林在体外对人胚肾细胞(HEK-293)的影响,结果表明吴茱萸碱[9]、吴茱萸次碱、吴茱萸内酯均具有潜在肾细胞毒性。因此研究选用左金丸中小檗碱、黄连碱、表小檗碱和小檗红碱,吴茱萸碱、吴茱萸次碱、吴茱萸内酯和辛弗林8种主要生物碱探讨其对HK-2细胞的潜在细胞毒性。
随着中药在全球的广泛发展和使用,中药安全性问题日益受到关注,其中以马兜铃酸事件为主的中药安全问题严重阻碍了中药发展进程。2020年版《中国药典》中共收录马兜铃酸在内的52种有毒中药,肾毒性中药包括马兜铃酸、雷公藤、大黄素以及朱砂等24种药物。如何验证和实现中药的配伍减毒增效,并为助力中药复方新药创新和优化提供方法和技术支撑,是中药肾毒性研究的重要方向。目前左金丸的药效研究十分广泛,但其是否具有潜在肾毒性仍研究不足,临床使用过程中存在潜在风险。为了探究左金丸中是否存在潜在的具有肾毒性的成分,为临床合理使用提供实验依据,本研究采用高内涵实验技术对左金丸及相关组分进行体外肾细胞损伤筛选,并对相关成分可能的肾损伤机制进行初步探讨。
1 材料与方法
1.1 主要试剂盐酸黄连碱(批号:112026-201802;94%)小檗碱(批号:110713-201613;86.8%);吴茱萸碱(批号:110802-201710;99.4%)、吴茱萸次碱(批号:110801-201608;99.7%)、吴茱萸内脂(批号:110800-201707;97.9%)均购于中国食品药品检定研究所。辛弗林(CAS:94-07-5);小檗红碱(CAS:15401-69-1);表小檗碱(CAS:6873-09-2)购于上海一飞生物科技有限公司,纯度均为98%。DMEM培养基(批号:C11995500BT)、0.25% EDTA胰蛋白酶(批号:25200-056),PBS缓冲液(批号:C10010500BT)均购于Gibco公司。细胞核染料Hoechst33342(H1399);SYTOXTMGreen Nucleic Acid Stain(S7020);MitoTrackerTMRed CMXRos(M7512)购于赛默飞世尔科技(中国)有限公司。Bax(货号:2772)、Bcl-2(货号:3498)和细胞色素C抗体(货号:12963)购于美国CST公司。KIM-1抗体(货号:ab228973)购于艾博抗(上海)公司。
免疫染色固定液(批号:P0098),免疫染色洗涤液(批号:P0106),免疫染色封闭液(批号:P0102),一抗稀释液(批号:P0103),二抗稀释液(批号:P0108),含DAPI防淬封片液(批号:P0131)均购于碧云天生物科技公司。澳洲健康胎牛血清(TransSerum®EQ Fetal Bovine Serum批号:FS201-02), 青霉素-链霉素溶液[Penicillin-Streptomycin (100×) 批号:FG101]购于Gibco公司。细胞毒性检测试剂盒(Cell Counting Kit-8 批号:CK04),细胞凋亡试剂盒(批号:AD10)购于北仁化学科技(北京)有限公司。乳酸脱氢酶检测试剂盒(批号:03004732122)购于罗氏诊断公司。
1.2 细胞培养人肾近曲小管上皮细胞(HK-2,Procell CL-0109))由武汉普诺赛生命科技有限公司提供,经过STR检验合格后使用。细胞接种于猪皮肤胶原蛋白包被后的培养皿中(sigma, NO.48722-500G-F),于37 ℃,5% CO2条件下进行培养。待细胞培养至密度为80%时,按照1 ∶3传代,培养于DMEM完全培养基中(10%胎牛血清、1%双抗)。传代周期控制在2-3 d/代,实验选取处在对数生长期细胞进行。
1.3 主要仪器培养箱(美国Thermo公司);离心机;ImageQuant Las500 型显影仪(瑞典Healthcare 公司);高内涵分析仪(Molecular Devices公司,ImageXpress Micro Confocal),高内涵成像系统(Molecular Devices公司,Metaxpress);罗氏生化仪;PE VictorX型酶标仪(美国Perkin Elmer 公司);荧光显微镜(蔡司公司,型号Vert200)。
1.4 基于CCK-8法的肾细胞毒性筛选通过预实验确定种板细胞量以及CCK-8孵育时间后进行正式实验。收集对数生长期肾细胞,根据预实验结果使用DMEM完全培养基调整细胞浓度,在96孔板中接种调整细胞悬液100 μL/孔,于37 ℃,5% CO2的培养箱中培养24 h后,选择黄连中4种单体和吴茱萸中4种单体的不同浓度处理细胞,同时设置阴性对照组。处理细胞的浓度设置及分组如下:
小檗碱(12.5、25、50、100、200 μmol·L-1);小檗红碱(12.5、25、50、100、200 μmol·L-1);表小檗碱(7.5、15、30、60、100 μmol·L-1);盐酸黄连碱(6.25、12.5、25、50、100 μmol·L-1);吴茱萸碱(3.125、6.25、12.5、25、50、100 μmol·L-1),吴茱萸次碱(3.125、6.25、12.5、25、50、100 μmol·L-1)吴茱萸内脂(12.5、25、50、100、200、400 μmol·L-1);辛弗林(12.5、25、50、100、200、400 μmol·L-1)。每组设置3个复孔,同时设置空白对照,置于37 ℃,5% CO2中处理24 h。孵育完成后弃去培养基,在每孔中加入提前配置的CCK-8工作液(DMEM培养基 ∶CCK-8储备液=1 ∶9),根据预实验摸索条件,将96孔置于培养箱中孵育。使用酶标仪测定96孔白板在450 nm下的吸光度。
计算公式:细胞活力/% = [D(450)待测-D(450)空白对照]/[D(450)正常对照-D(450)空白对照]×100%
1.5 基于高内涵技术的肾细胞毒性筛选将处于对数生长期的HK-2细胞按照“1.2”方法收集细胞并计数,调整细胞浓度为107·L-1,100 μL/孔接种于胶原蛋白包被的黑色96孔板中置于37 ℃,5% CO2的细胞培养箱中培养24 h。培养24 h后,弃去原培养液,处理细胞的浓度设置及分组如下:
小檗碱(12.5、25、50、100、200 μmol·L-1);小檗红碱(12.5、25、50、100、200 μmol·L-1);表小檗碱(7.5、15、30、60、100 μmol·L-1);盐酸黄连碱(6.25、12.5、25、50、100 μmol·L-1);吴茱萸碱(0.1、0.2、0.4、0.8、1.6、3.2 μmol·L-1),吴茱萸次碱(3.125、6.25、12.5、25、50、100 μmol·L-1)吴茱萸内脂(12.5、25、50、100、200、400 μmol·L-1);辛弗林(12.5、25、50、100、200、400 μmol·L-1)。每个孔设置3个平行孔,37 ℃,5% CO2的细胞培养箱中培养24 h。
染料配置:核染料Hoechst用不含血清的DMEM培养基按照1 ∶2 000的比例稀释10 mmol·L-1细胞核染料,避光保存,备用。SYTOXTMGreen Nucleic Acid Stain染料母液使用前稀释为1 μmol·L-1工作液避光保存,备用。MitoTrackerTMRed CMXRos染液使用DMSO制备为1 mmol·L-1储备液避光保存,备用,使用时1 ∶1 000配置使用。
细胞经药物处理后,弃去原培养液,每孔中加入各配置染料50 μL,置于37 ℃下培养30 min。染料孵育完成后,弃去孔中染料,并在孔中加入已恢复至室温的细胞固定液固定细胞状态,置于室温下孵育20 min。细胞固定后弃去固定液,在孔中加入PBS清洗细胞3次。清洗后每孔中加入200 μL PBS后,使用高内涵成像系统进行检测。
1.6 EVO对HK-2肾细胞功能(LDH)检测收集对数生长期肾细胞,使用DMEM完全培养基调整细胞浓度,接种于培养皿中培养24 h后弃去上清,分别使用不同浓度EVO处理肾细胞24 h,同时设置不加药物组作为Ctrl组。处理后收集上清1 mL于离心管中,3 000 r·min-1离心5 min,取500 μL上清。使用罗氏cobas c111全自动生化仪(UV法)检测肾细胞外LDH浓度。
1.7 EVO处理后HK-2细胞形态学变化细胞处理同“1.6”,药物处理24 h后倒置显微镜镜下观察EVO不同浓度处理后细胞形态学变化。
1.8 EVO处理后HK-2细胞色素C释放率变化采用高内涵细胞毒性筛选技术同“2.2”,检测筛选成分吴茱萸碱处理后HK-2细胞内细胞色素C变化。
1.9 EVO处理后HK-2细胞凋亡变化细胞处理同“2.3”,收集细胞于离心管中,在1 000 r·min-1下离心3 min弃去上清,并重复清洗2~3次。加入预配置的Annexin V Blinding Solution将收集的细胞制成终浓度为109个·L-1的细胞悬液,并按照细胞凋亡试剂盒加入染料后,上机检测。
1.10 EVO处理后HK-2细胞蛋白表达变化细胞采用同“1.6”处理后采用Western blot法检测细胞凋亡相关蛋白及肾损伤相关蛋白表达水平,并重复4次独立实验。EVO处理后的细胞收集后按照BCA蛋白定量试剂盒说明书进行定量后进行Western blot实验。实验采用10% SDS-PAGE凝胶电泳,采用湿转法转膜后,封闭,孵育一抗、二抗后进行ECL发光显影。实验采用GAPDH作为内参蛋白,ImageJ图像分析软件进行分析。
1.11 图像采集与分析采用Metaxpress平台采集图像,每孔采集2个视野图像。图像采集条件如下:第一孔道于350 nm/461 nm检测Hoechst33342标记染色;第二通道于491 nm/509 nm检测Permeability Dye染色;第三通道于551 nm/576 nm检测Mitochondrial Potential Dye染色。采用ImageXpress Micro Confocal分析系统对获得的图片信息导入进行分析。分析条件为细胞数目为第一通道染料荧光数目;DNA密度为第一通道染料荧光强度;细胞膜通透性为第二通道染料荧光强度;线粒体膜电位为第三通道中细胞质与细胞核荧光强度差值。
2 结果
2.1 左金丸中主要单体成分对HK-2细胞存活率的影响CCK-8法对左金丸中8种主要生物碱处理后观察HK-2细胞24 h后细胞存活率变化,结果如Fig 1所示,左金丸中单药黄连中主要单体成分小檗碱(Fig 1A)、小檗红碱(Fig 1B)、盐酸黄连碱(Fig 1D)在高浓度下具有潜在的肾细胞毒性,并且细胞存活率呈现浓度依赖性降低;黄连中小檗碱未呈现显著细胞毒性(Fig 1A)。左金丸中另一味单药吴茱萸中主要成分吴茱萸次碱在高浓度>12.5 μmol·L-1时可能具有潜在的肾细胞毒性,并且细胞存活率呈现浓度依赖性,吴茱萸内酯、辛弗林、吴茱萸碱并未呈现出明显细胞毒性。上述结果与镜下观察结果一致,但EVO处理HK-2细胞活力的检测结果与镜下细胞形态观察结果不一致,3.125 μmol·L-1EVO处理后HK-2细胞形态即发生显著变化,显示出一定的细胞毒性,如Fig 4。
2.2 利用高内涵筛选技术检测左金丸中主要单体成分对HK-2细胞的影响鉴于CCK-8法检测细胞活力的结果与镜下细胞形态的改变存在差异,拟采用高内涵技术对左金丸中8种主要单体成分进行肾细胞毒性筛选,结果如Fig 2。左金丸中8种单体处理HK-2细胞24 h后,黄连中小檗红碱、盐酸黄连碱和吴茱萸中EVO能够降低HK-2细胞数目,且EVO在3.2 μmol·L-1时细胞数目减少至59%,并与镜下细胞形态变化结果一致,如Fig 4。
同时采用高内涵技术,对左金丸中8种单体处理后细胞膜通透性,核DNA密度和细胞线粒体膜电位变化进行检测, 盐酸黄连碱(25 μmol·L-1)和吴茱萸碱(0.4 μmol·L-1)能够升高细胞膜通透性,并呈浓度依赖性,小檗红碱、表小檗碱处理后HK-2细胞核DNA密度明显升高。此外,根据数据表明吴茱萸次碱处理后HK-2细胞核DNA密度升高最明显,结合高内涵图片采集及分析系统发现,其可能是由于吴茱萸次碱重结晶导致假阳性。对线粒体膜电位检测发现,盐酸黄连碱(50 μmol·L-1)、吴茱萸碱(3.2 μmol·L-1)能够降低线粒体膜电位,并伴随浓度升高而逐渐降低。综合上述指标,左金丸中吴茱萸碱在>0.2 μmol·L-1时能够降低细胞核数目,即存活细胞数降低,显示出具有潜在的肾细胞毒性,如图Fig 2E。

Fig 2 Effect of eight alkaloids in Zuojin Pills on HK-2 cell number(A), nuclear DNA density(B), membrane permeability(C), and mitochondrial membrane potential(D); Effect of EVO on nucleus number(E).
2.3 EVO对HK-2细胞功能指标的影响在上述筛选的基础上,采用EVO处理HK-2细胞24 h后进行细胞功能检测,结果显示,EVO在浓度高于0.8 μmol·L-1时,HK-2细胞培养上清中LDH值升高(P<0.01),且释放率呈现剂量依赖性。EVO处理后细胞LDH释放率与镜下细胞形态及高内涵筛选结果一致,见Fig 3。

Fig 3 Effect of cell function indexes on HK-2 cells
2.4 EVO对HK-2细胞形态的影响倒置显微镜镜下观察溶剂对照组HK-2细胞为铺路石状贴壁生长,加入EVO(0、3.125、6.25、12.5、25、50、100 μmol·L-1)处理24 h后,随着药物浓度升高,细胞贴壁性降低,细胞边界轮廓清晰,细胞皱缩变圆。高浓度组EVO 100 μmol·L-1时细胞出现破裂,细胞内容物流出,细胞脱落悬浮于培养基中,如Fig 4。
2.5 EVO对HK-2细胞色素C释放率影响细胞色素C在细胞凋亡中发挥着重要作用。细胞线粒体发生损伤时,细胞色素C由线粒体释放至胞质中,并引发caspase活化级联反应诱导细胞死亡。EVO处理24 h后HK-2胞内细胞色素C释放率显著升高,并呈浓度依赖性,如Fig 5。
2.6 EVO对HK-2细胞凋亡的影响采用Annexin V/FITC对细胞凋亡进行标记,如图Fig 6,EVO处理HK-2细胞24 h后细胞凋亡升高,结果与高内涵实验中细胞色素C表达一致,差异具有显著性(P<0.01)。
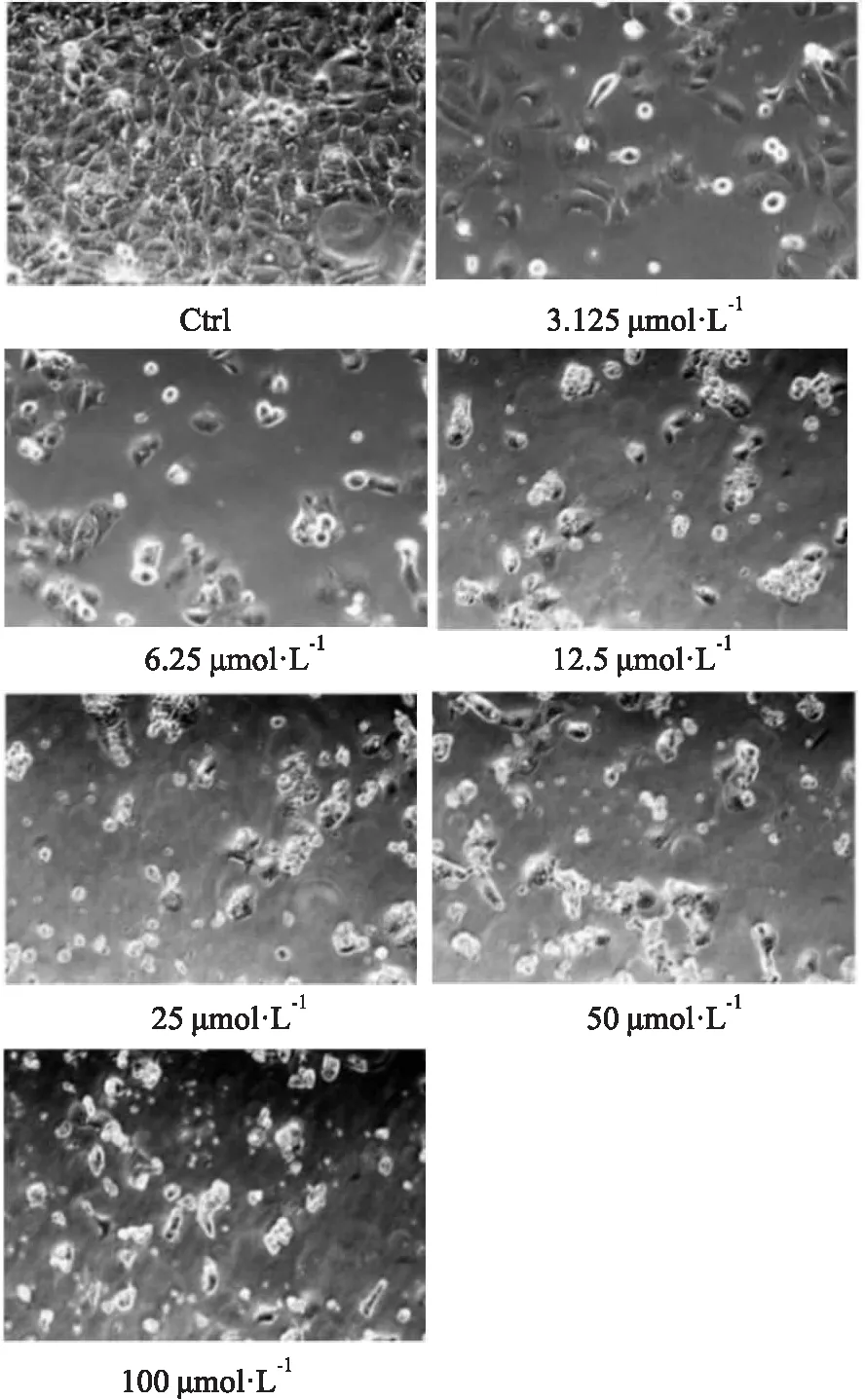
Fig 4 The morphological changes of HK-2 cells treated with different concentrations of evodiamine for 24 h(100×)

Fig 5 Changes of cytochrome C release rate in HK-2 cells aftertreatment with different concentrations of EVO
2.7 EVO对HK-2蛋白表达的影响肾损伤分子-1(KIM-1)是一种新型的I型跨膜糖蛋白,当肾受到损伤后能够迅速升高而特异、灵敏的反映肾损伤情况。Western blot法检测EVO处理后HK-2细胞中KIM蛋白的表达量,结果表明:随着EVO浓度升高,HK-2细胞中KIM蛋白表达逐渐升高,如Fig 7。细胞凋亡相关蛋白Bax/Bcl-2如图Fig 7,EVO处理后,HK-2细胞凋亡相关蛋白Bax/Bcl-2表达随着浓度升高而降低,并呈浓度依赖性,结果与细胞色素C表达相反。

Fig 6 Changes of HK-2 cell apoptosis after treatment withdifferent concentrations of

Fig 7 Changes of protein expression in HK-2 cells treated withdifferent concentrations of
3 讨论
肾脏是人体重要的代谢器官,其每分钟流量约占心搏血流量的1/4。人体内药物代谢产物及机体废物会通过血流到达肾脏,并通过肾脏清除有毒外来物和代谢废物,因此容易由于药物蓄积导致药源性肾损伤。药源性肾损伤最早被发现于20世纪90年代,截至2019年5月1日《中国药品不良反应信息通报》统计共162种药物,其中中药类药物有52种(32.1%)。中药中有32种存在肾毒性风险,占所有不良反应的61.5%[10]。目前中药已出口到包括美国、日本和印度等175个国家和地区,而与中草药相关的药源性肾损伤包括急性肾损伤、慢性肾病、肾结石、横纹肌溶解症、范可尼综合征和尿路上皮癌等,但确切作用机制尚不清楚[11]。Ye等[12]针对马兜铃酸诱导的肾脏损伤机制研究发现,马兜铃酸除了通过与DNA形成络合物产生肾毒性外,还可能通过异常激活补体系统中C3a和其受体C3aR诱导TGF-β1表达升高,调控肾细胞纤维化相关通路。早期药源性肾损伤由于药物毒性低或者蓄积量少通常难以发现,临床诊断难度大,容易延误诊治,最终发展为不可逆的肾损伤[13]。近年来针对中药肾损伤研究逐渐深入, 采用血清肌酐和尿素氮作为肾脏损伤的标准生物标志物,其敏感性和特异性较低已经不能够满足临床需求。Kagawa等[14]采用下一代测序分析对血清中miR-143-3p和miR-122-5p进行特异性检测,发现其表达下调,且变化明显早于血清肌酐和尿素氮。
目前毒理学研究主要采用MTT、台盼蓝染色、结晶紫以及CCK-8等传统细胞毒性检测方法,然而传统检测手段由于其通量低、检测效率慢、细胞毒性高和易受药物自身性质影响等缺点严重阻碍了毒理学研究进程。高内涵筛选分析技术是一种将目的细胞进行特异性染色,并通过高分辨率成像、自动化分析系统以及数据分析系统获取细胞详细生长状态的技术。在细胞水平,对不同处理后的细胞利用显微成像技术记录细胞荧光图像及荧光强度变化,能够高通量、精准化进行分析检测,极大提高工作效率。该技术弥补了目前现有的发现毒理学检测方法在通量、检测毒性物质机制、揭示潜在毒性等方面的不足,这为药物的肾毒性筛选提供了更为方便、快捷的方法。目前高内涵技术运用于发现药物、功能基因组学(如前导化合物优化、化合物库富集等)、毒理学研究(发育毒性、遗传毒性、神经毒性、肝毒性、心脏毒性和肾毒性等)等方面,极大的促进药物发现,并在开发药物以及简化毒理学研究中具有重要意义,是21世纪毒性测试的有力工具。
本实验基于HK-2细胞对左金丸中所含的8种主要单体成分(小檗碱、小檗红碱、盐酸黄连碱、表小檗碱、吴茱萸碱、吴茱萸次碱、吴茱萸内脂、辛弗林)的肾细胞毒性进行初步筛选。研究首先采用CCK-8法对左金丸中8种单体进行筛选,小檗碱、小檗红碱、盐酸黄连碱在高浓度具有潜在肾细胞毒性,其他五种单体成分未显示出肾细胞毒性,但EVO处理后细胞形态学结果与CCK-8细胞活力的结果存在一定偏差。相关研究提示吴茱萸中生物碱清除羟基自由基能力和二苯代苦味酰基自由基强于Vc,其还原能力随药物浓度升高而增强,可能影响CCK-8检测细胞活力结果[15-16]。进一步采用高内涵技术对左金丸中八种单体成分进行筛选,通过对EVO处理后HK-2细胞数目、核DNA密度、细胞膜通透性、线粒体膜电位以及细胞色素C释放率进行检测筛选,结果表明黄连中小檗红碱、盐酸黄连碱在高浓度时具有潜在的肾细胞毒性,与细胞活力结果一致。吴茱萸中EVO在0.2 μmmol·L-1时使细胞核数目降低,核DNA密度不变,细胞膜通透性明显升高,线粒体膜电位降低,同时细胞色素C释放率随EVO浓度升高而增加。进一步研究发现,EVO处理后细胞LDH释放率呈现浓度依赖性升高。Western blot实验结果显示EVO能够诱导细胞凋亡相关蛋白Bax和Bcl-2表达进而造成肾细胞损伤。
通过CCK-8和高内涵技术我们对左金丸中的8种成分进行了初步的筛选,并对细胞毒性各项指标明显的吴茱萸碱前期进行了相对全面的研究。研究提示左金丸中具有潜在肾细胞毒性成分为吴茱萸碱(EVO),在配伍组方和组分减毒过程中应关注该成分可能存在的肾脏毒性,通过配伍减毒等技术手段降低其发生不良反应的风险。但由于中药的毒性问题不可能也不应该是单一成分所能够主导的,因此其他相关成分的毒性后续研究中将更加综合和全面的考察,特备是组分配伍条件下的毒性变化,相关工作正在进行中,仍需要深入研究。

