急性一氧化碳中毒迟发性脑病大鼠海马区长时程脑电信号研究
张凌星 张晓莉 张业宏 于 毅 顾仁骏∗ 高智贤∗
1(新乡医学院医学工程学院,河南 新乡 453003)
2(河南省神经传感与控制工程技术研究中心,河南 新乡 453003)
3(新乡医学院第二附属医院,河南 新乡 453003)
引言
急性一氧化碳中毒迟发性脑病(delayed encephalopathy after acute carbon monoxide poisoning,DEACMP),是指一氧化碳(CO)中毒症状恢复后,患者经2~60 天假愈期,再次出现以精神意识障碍、大脑皮层局灶性功能障碍、脑神经损害及周围神经炎等神经系统损害[1]。据统计,DEACMP 发病率约为CO 中毒患者的3%~30%,但因其在假愈期无明显症状、隐匿性强,易被忽视而导致预后较差。因此,早发现、早治疗对该病的防治及康复十分重要。国内病理报告,DEACMP 发病时常见苍白球对称性病变和海马病变,但相应区域的病变过程和机制尚不清楚[2]。
目前,临床检查的方法主要有脑CT[3]、MRI[4]、实验室病理检查[5]、神经电生理检查等[6],虽能检测到脑部病变,但难以连续监测脑部病程变化。头皮脑电(EEG)因无创、灵敏度高、简单易行且时间分辨率高等特点,已被应用于临床进行DEACMP 分级诊断,通过观察患者的原始脑电波形变化是否出现广泛而不规则的高振幅慢波活动来进行判定[7-8]。但这种读图方法依赖于临床医生的主观经验和诊断水平,缺少客观的检测指标。头皮脑电也难以获知位于大脑中部特定受损区域在假愈期内的活动状态变化。
因此,本研究使用植入电极记录DEACMP 大鼠海马区的局部场电位信号(local field potential,LFP),持续记录8 周,通过提取LFP 频段振荡的特征参数,探究DEACMP 的长时程海马区脑电信号的变化规律,以期为DEACMP 的临床检测与治疗提供理论支持和参考。
1 材料和方法
1.1 实验动物
36 只健康成年雄性清洁级SD 大鼠,体重250~350 g,由河南省动物实验中心提供。大鼠饲养于空调室(20~23℃),光照/暗循环12 h。实验严格执行新乡医学院实验动物使用规定。
1.2 实验设计
1.2.1 模型制备
随机挑选30 只大鼠进行造模,按照本研究组提出的造模方法[9-10],每隔4 h 腹腔注射一次CO 气体,注射剂量分别为10、5、5、5 mL/100 g,观察染毒后大鼠的症状及体征行为变化。
1.2.2 电极植入
10%水合氯醛(3.5 mL/kg)腹腔麻醉大鼠,将头部固定于立体定位仪上,颅骨前囟和后囟在同一水平面上。剃毛后,在颅骨上磨4 个小孔,并放置螺丝用于固定电极,参照Paxinos 等的大鼠脑立体定位图谱[11],在海马体上方(连合线外侧2.0~2.5 mm,中间连合点后方2.5~3.8 mm,下方2.6 mm)磨开2×2 mm 小窗口,剥离硬脑膜和软脑膜,使用微推进器,将自制的4 通道电极(镍铬合金,单根电极直径460 μm,间隔200 μm)缓慢植入至海马区。牙科水泥固定电极后缝合,术后注射青霉素防止感染。将大鼠转移到笼中单独饲养,用白炽灯辅热,确保术后恢复。待大鼠醒来之后给予食物和水,并进行术后跟踪观察。因染毒后大鼠健康状态不佳,再开颅植入电极后存活时长较短,难以存活8 周(最长存活5 周)。为了观察假愈期大鼠海马区局部场电位变化,本研究选择对大鼠分批植入电极。造模当天选择4 只大鼠进行电极植入,之后以周为时间节点,每次增补2~3 只大鼠植入电极,以保证每周4~5 只存活大鼠进入脑电记录。而6 只正常大鼠直接植入电极,作为造模前的参照基准。
1.3 脑电分析
大鼠电极植入后,经过恢复,于次日采集局部场电位,使用Cerebus 多通道信号采集系统记录信号,采样频率为30 kHz,每次采集4~5 min,连续采集3 次,保证至少合计有1 min 时间大鼠处于安静状态作为有效数据。剔除模型失败、手术失败、异常数据的大鼠后,共20 只大鼠(造模前正常鼠,n=4;染毒造模大鼠,n=16)进入脑电信号数据分析。
原始脑电信号以128 Hz 的频率降采样,然后使用0.5~30 Hz 的7 阶椭圆带通滤波器,提取出有用的信号频带。选择一维小波包分解函数(wpdec)和db4 小波对预处理后的脑电信号进行分解重构,为α 波(8~13 Hz)、β 波(14~30 Hz)、θ 波(4~7 Hz)和δ 波(0.5~3.5 Hz)等4 个频段,计算各波段均方根值和能量占比。其中,均方根值(RMS)用来衡量4 个频段振荡的幅值,计算公式如下:
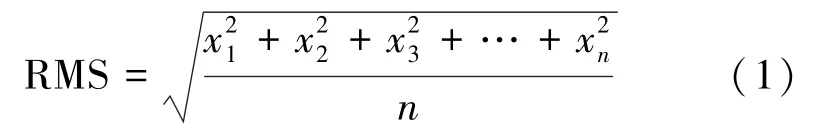
能量(E)是频段的能量值,计算公式如下:
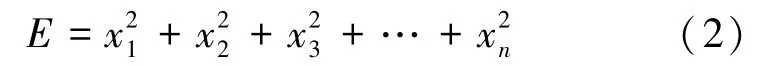
式中,xn代表第n个样本点数据。
能量占比(pi)是用来计算某个频段能量相对于4 个频段总能量的占比,计算公式如下:
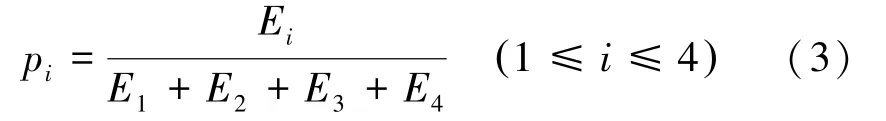
式中,Ei为第i个频段能量值,pi为第i个频段的能量占比,i取值1~4,分别对应α 波、β 波、θ 波、δ 波。
1.4 统计学处理
数据统计结果以均数±标准差表示,采用统计软件SPSS19.0 进行分析。为研究时间节点(造模前和造模后1~8 周)对局部场电位4 种震荡成分的幅值和能量占比的影响,采用重复测量方差分析,若时间对参数具有显著影响,则再使用LSD 检验对不同时间节点进行成对比较。所有数据以P<0.05视为有统计学意义。
2 结果
2.1 造模情况
腹腔注射CO 染毒后,诱发急性一氧化碳中毒(ACMP),观察大鼠的主要表现为:兴奋、呼吸短促、爬动频繁、易怒和体重逐渐增加;部分大鼠口鼻、耳、爪、尾部皮肤呈现樱桃红色,行走不稳,嗜睡昏迷(见图1(a))。存活下来的老鼠症状逐渐消退,直到苏醒。正常表现几周后,开始出现抑郁、肌张力增高、行走不稳、毛发增多、肌肉收缩、暴饮暴食等神经症状(见图1(b))。该模型视为接近临床标准的DEACMP 中毒模型。
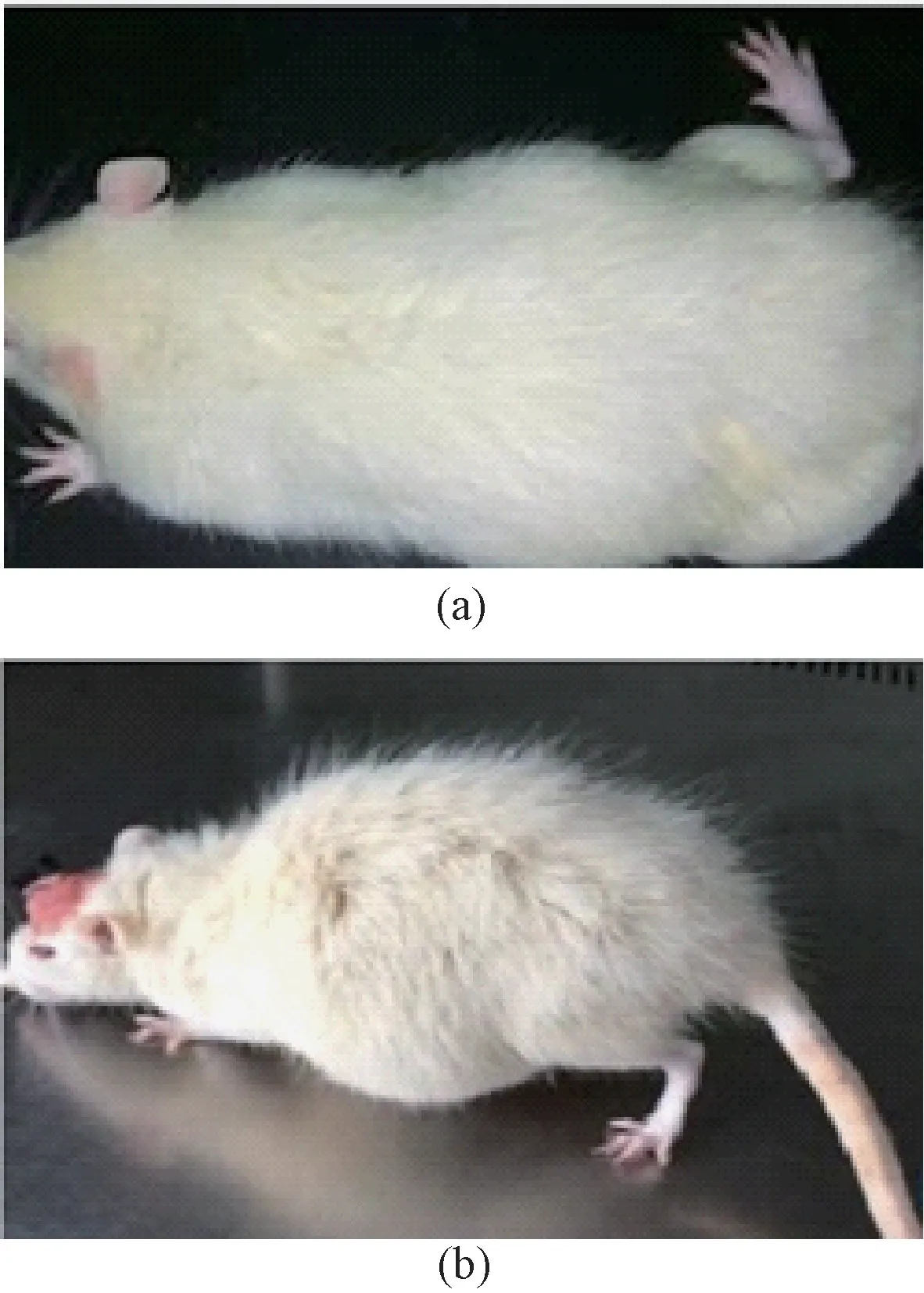
图1 CO 腹腔注射诱导ACMP 和DEACMP 的临床表现。(a)造模后30 min;(b)造模后3 周Fig.1 Clinical manifestations of ACMP and DEACMP induced by CO injection.(a) 30 min after modeling;(b)Three weeks after modeling
2.2 波段提取
对原始数据预处理,在降低计算量的基础上提取出有用的信号频带,得到降采样和滤波后的数据结果如图2所示。将预处理后的数据进行一维小波包分解与重构,得到α、β、θ 和δ 频段及其频谱分布(见图3),与设定的4 个频段频谱范围相符。
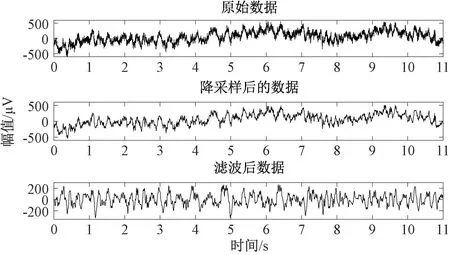
图2 原始脑电信号(上图)、降采样(中图)和滤波(下图)处理后的信号Fig.2 Original electroencephalogram signal (above),down- sampling signal (middle) and filtering signal(below).

图3 一维小波包分解与重构后的频段波形和信号频谱。(a)频段波形;(b)信号频谱Fig.3 Waveforms and signal spectrum after wpdec decomposition and reconstruction.(a) Frequency waveform;(b) Signal spectrum
2.3 振荡幅值
造模前与造模后8 周的4 个波段均方根值结果如图4所示。重复测量方差分析的结果表明,时间对幅值具有显著影响,4 个波段的统计结果如表1所示。与造模前相比,造模后1~8 周(后简称1~8周)α、β、θ 和δ 波的幅值在大鼠染毒后早期(1/2周)和后期(7/8 周)增加,而在染毒后中期(3/4/5/6 周)接近正常水平。与造模前相比,4 个波段相应幅值具体增加的周次分别是α 波、β 波和θ 波,均为1/2/6/7/8 周(α 波见图4(a);β 波见图4(b);θ 波见图4(c)。δ 波为造模后1/2/3/4/7/8 周(见图4(d)),各周的相应幅值如表1所示。造模后1~8周,4 个波段的幅值总体呈现出先增加、后降低、再升高的变化趋势。经成对比较表明,4 个振荡成分在造模后早期和后期的幅值高于造模后中期的振荡幅值。4 种成分造模后3~6 周的幅值显著低于1/2/7/8 周的值,如表1所示。
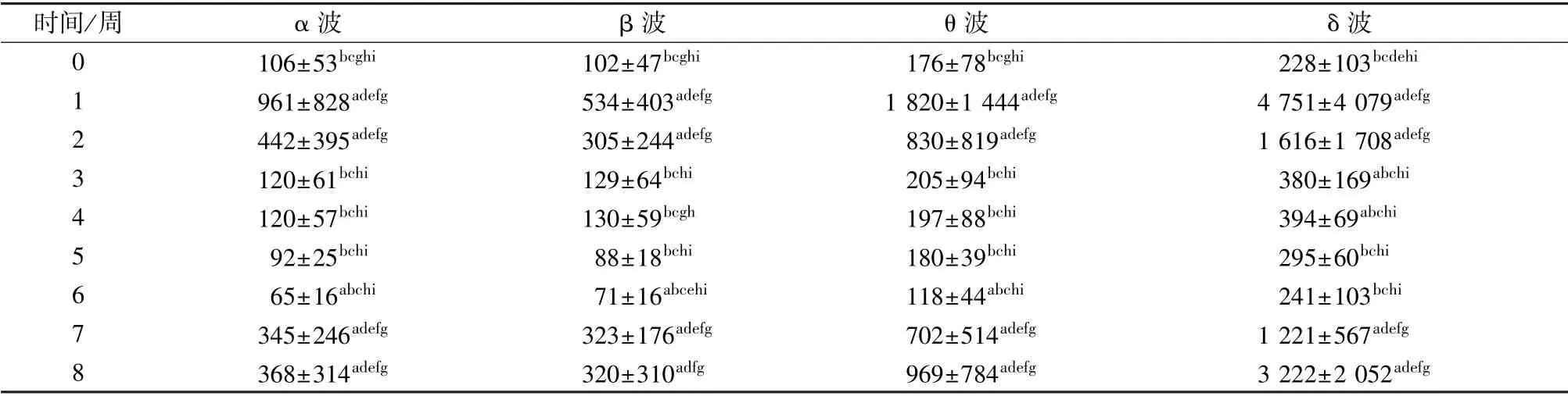
表1 造模前与造模后(1~8 周)的各频带振荡幅值Tab.1 Oscillation amplitude of each frequency band of before and after modeling (1~8 weeks)μV
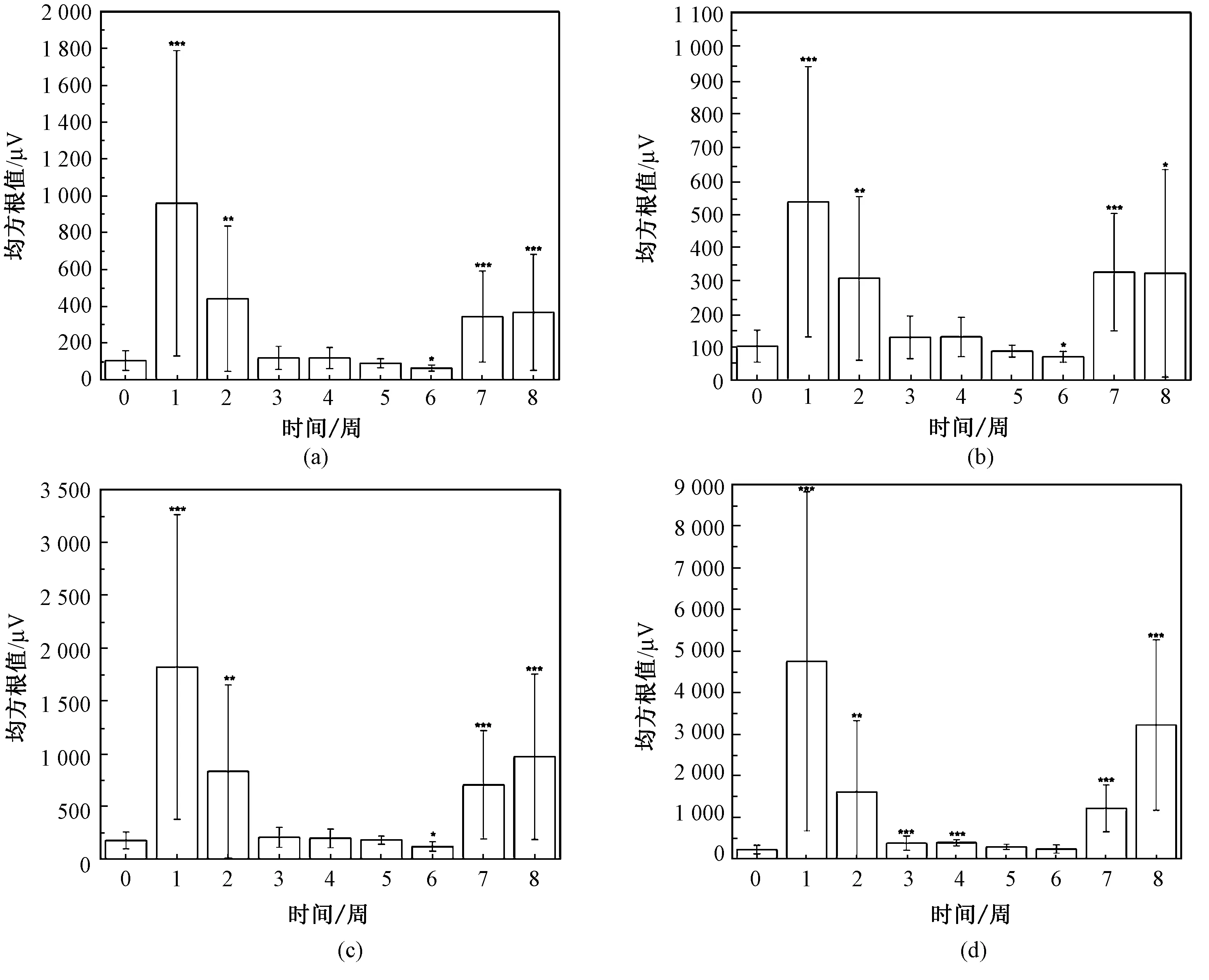
图4 造模前与造模后的各频带振荡幅值(每个子图的横坐标中,0 表示造模前,1~8 表示造模后1~8 周;∗P<0.05,∗∗P<0.01,∗∗∗P<0.005,表示造模前与造模后存在显著差异)。(a)α 波;(b)β 波;(c)θ 波;(d)δ 波Fig.4 The oscillation amplitude in each frequency band of before and after modeling (In the abscissa of each sub graph,0 represents before modeling,1~8 represents 1~8 weeks after modeling;∗P<0.05,∗∗P<0.01,∗∗∗P<0.005,significant difference between before and after molding).(a)α wave;(b)β wave;(c)θ wave;(d)δ wave
2.4 能量占比
造模前与造模后8 周的4 个频段能量占比结果如图5所示。重复测量方差分析的结果表明,时间对能量占比具有显著影响,统计结果如表2所示。图5中与造模前相比,造模后α、β、θ 和δ 波的能量占比在1~8 周出现显著变化。相对于造模前,造模后1~8 周α 波、β 波和θ 波的能量占比普遍出现显著减小。3 种成分能量占比显著减少的周次分别为:α 波为造模后3/4/6/7/8 周(见图5(a)),β 波为造模后2/3/4/7/8 周(见图5(b)),θ 波为造模后2/3/4/6/7/8 周(见图5(c))。相对于造模前,δ 波在1~8 周显著增加,1~4 周升高较缓,5~8 周逐渐上升(见图5(d))。其中,α 波的能量占比在1~4周变化较小,而在5~8 周表现为逐步下降,具体的能量占比值如表2所示。成对比较结果显示,4 个波段在造模后8 周的能量占比与造模后1~7 周具有显著差异。δ 波造模后8 周的能量占比显著高于1~7 周的值,α 波、β 波和θ 波造模后8 周的能量占比显著低于1~7 周的值,如表2所示。
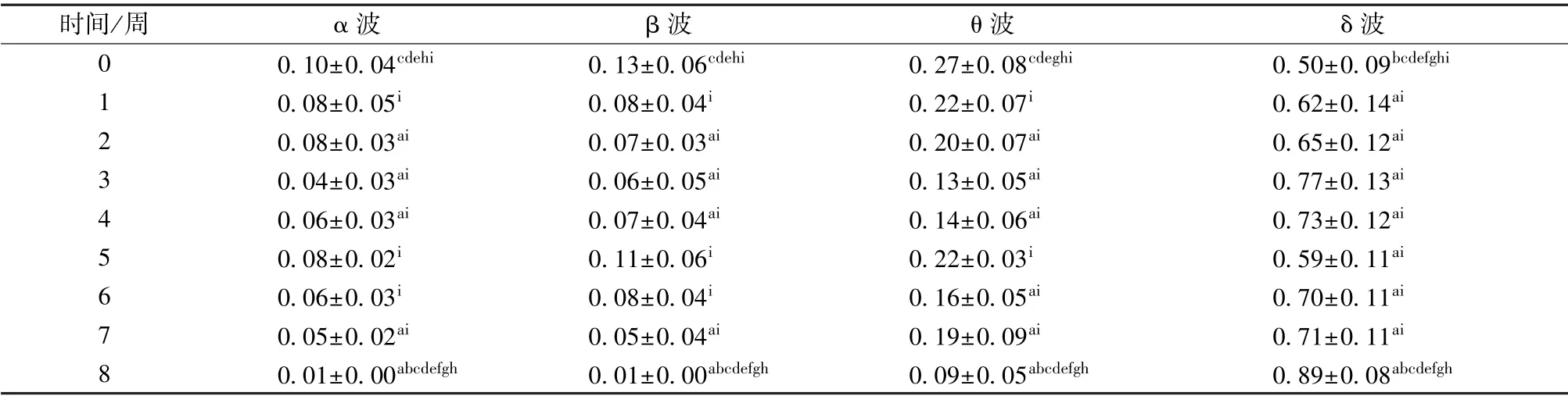
表2 造模前与造模后(1~8 周)的各频带能量占比Tab.2 Energy proportion of each frequency band before and after modeling (1~8 weeks)
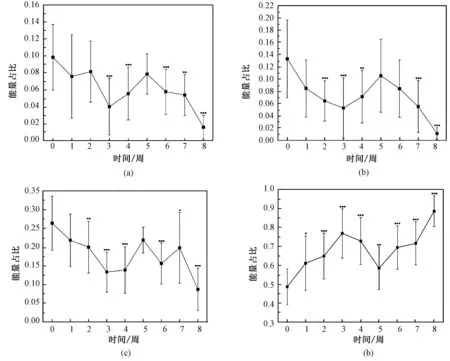
图5 造模前与造模后的各频带振荡能量占比(每个子图的横坐标中,0 表示造模前,1~8 表示造模后1~8 周;∗P<0.05,∗∗P<0.01,∗∗∗P<0.005,表示造模前与造模后存在显著差异)。(a)α 波;(b)β 波;(c)θ 波;(d)δ 波Fig.5 The proportion of oscillation energy in each frequency band of before and after (In the abscissa of each sub graph,0 represents before modeling,1~8 represents 1~8 weeks after modeling;∗P<0.05,∗∗P<0.01,∗∗∗P<0.005,significant difference between before and after molding).(a)α wave;(b)β wave;(c)θ wave;(d)δ wave
3 讨论
急性一氧化碳中毒的医治近年来取得了一定进展,但迟发性脑病的发病率没有降下来,主要原因是未及时发现导致患者出现严重的精神和运动障碍甚至死亡[8]。然而,目前DEACMP 的具体发病机制尚不清楚。研究显示,海马区是DEACMP 累及的主要部位之一,该区是高等动物学习记忆与认知功能形成的重要脑功能区,也是调节应激反应并受应激影响最重要的脑部结构[12]。因其对缺血和缺氧耐受力很低,所以缺血缺氧会引发海马细胞持续凋亡[13],导致智力、记忆力、计算力和空间定位力下降,即出现迟发性脑病[14]。临床发现,一氧化碳中毒除了会继发脑组织缺血、缺氧外,还会引发脑水肿和脱髓鞘等弥漫性损害,会导致大脑振荡模式受到影响[7]。
鉴于DEACMP 病程发展呈现异常-正常-再异常的动态变化[9],连续监测脑部变化才有可能找到有效的监测指标。因此,选择海马区作为研究对象,记录该区域长时程脑电信号,探究DEACMP 病程发展对脑电振荡模式的影响。使用课题组提出的腹腔注射法,建立DEACMP 模型大鼠[9-10],成功辅以大鼠的行为学评价判断造模。通过分析α、β、θ 和δ波等4 个频段振荡的均方根值,发现DEACMP 模型大鼠海马区4 个波段振荡的幅值在发病早期(1/2周)普遍存在异常,可能与脑水肿产生的高幅弥漫性电活动和脱髓鞘造成的神经传导速度失衡和频率紊乱有关[13]。临床上诊断DEACMP 的先决条件之一,就是在疾病开始时脑电信号出现100%异常[6]。因此,这4 种波形早期的显著增加可能预示着DEACMP 发病的风险。在后期(7/8 周)4 个波幅值也表现出普遍增加,可归因于DEACMP 病情加重。而在中期有一些时段的幅值则显著降低,整体呈现增加-降低-增加的变化趋势,这可能与DEACMP 的假愈期异常-正常-再异常的变化有关[14-15]。
局部场电位(LFP)与头皮脑电(EEG)都是对脑电信号进行测量,两者之间既有区别又有联系。局部场电位(LFP)通过植入电极,记录大脑特定核团中全部神经元的电活动信号。头皮脑电(EEG)利用置于头皮上表面电极,无创地测量大脑神经活动生物电位。二者之间有相关关系,互为表征[16]。本研究各频段能量占比的结果表明,DEACMP 组的δ波频所占比例显著增加,α 波、β 波占比显著减小。这与临床上DEACMP 患者的EEG 呈广泛慢波活动,α、β 波解体、减弱,δ 波广泛出现的结果一致[17]。δ 波占比增加和α 波占比降低的结果就产生了临床上α 波频率减慢的现象,该现象是脑功能减退的早期敏感指标[18]。进一步观察病程进展对能量占比的影响发现,能量占比变化可分为波动段和持续变化段。造模后1~4 周,δ 波和α 波占比有所波动;而在5~8 周,δ 波占比呈现持续上升,α 波占比则持续下降。这种分段变化可能与DEACMP患者脑部病变加重有关。临床研究发现,脑电信号波形的异常程度与疾病轻重具有对应关系。轻度异常EEG 表现为低中幅的α 波为主;中度异常EEG表现为混有高幅的δ 波;重度异常EEG 表现为广泛性波幅平坦,有大量的δ 波出现[18-19]。因此,病程后期δ 波占比持续增加和α 波占比持续减少变化,提示海马区应存在中重度异常,如脑组织缺氧细胞受损加重,广泛受累[20-21]。
4 结论
以DEACMP 主要受累部位之一的海马区作为研究对象,记录该区域长时程(8 周)的脑电信号,提出以脑电振荡幅值和能量占比两个参数监测DEACMP 假愈期病程变化。结果表明,脑电振荡各波段幅值初期的普遍异常可能预示DEACMP 发生高风险;δ 波能量占比偏高和α 波能量占比偏低不仅可以作为早期指标,二者分段变化还可不受假愈期表象影响来表征疾病严重程度。因此,本研究提出脑电振荡分析方法不仅可作为预测DEACMP 发病风险的指标,而且还可表征DEACMP 的实际严重程度,为监测DEACMPD 的EEG 特征提供了一种新方法。后续将进一步研究使用无创的头皮脑电验证方法的有效性,从而推进该方法的临床应用。

