血清蛋白醋酸纤维膜电泳缓冲液的筛选
赵泽鹏,张佳音,苑飒龙,白佳鹏,杨荞瑀,张丽云
(河北北方学院 动物科技学院,河北 张家口 075000)
电泳技术在大分子物质的定性、定量分析等方面具有重要地位,其中醋酸纤维膜电泳具有分离速度快、区带清晰、样品用量小等特点,在高校开出率很高,是高校生化实验教学中最基本的教学项目之一[1]。血清蛋白电泳对于某种血清蛋白的异常变化推测发生了某些疾病意义重大,例如血清球蛋白水平对神经介入术后急性缺血性脑卒中患者炎症因子和神经激素水平有一定影响[2],多发性骨髓瘤会分泌异常单克隆免疫球蛋白(M蛋白)导致异常球蛋白增加,正常球蛋白合成减少[3-4]。近些年,醋酸纤维膜电泳常用的巴比妥缓冲液试剂不易购得,其他替代缓冲液分离血清蛋白效果又说法不一,因此,筛选适合该电泳的缓冲液对保障实验质量有重要意义。基于实验原理及电泳缓冲液的特点,选取几种常用缓冲液进行筛选试验,为教学和科研提供依据。
1 材料和方法
1.1 材料
(1)成年家兔:由河北北方学院实验动物科提供。
(2)电泳支持物:醋酸纤维膜,2.0 cm×8.0 cm,购自北京六一生物技术有限公司。
(3)主要试剂:Tris碱,盐酸,磷酸,乙二胺四乙酸二钠(Na2EDTA),硼酸,四硼酸钠,氯化钠,磷酸氢二钠,磷酸二氢钠,巴比妥钠,巴比妥,氨基黑10B,甲醇,冰乙酸,95%乙醇,天津市津东天正化学试剂厂生产,均为分析纯。
(4)主要仪器:JA3003分析天平,购自上海舍岩仪器有限公司;DYY-12型电泳仪、DYCP-38B型卧式电泳槽,购自北京六一生物科技有限公司;EOS 6D Mark II单反相机,购自佳能(中国)有限公司。
1.2 实验方法
1.2.1 实验准备
(1)血清的制备
选取健康成年家兔,保定,使用10 mL真空负压采血管(带有枸橼酸钠),从耳缘静脉抽取静脉血,静置30 min,离心,2 000 rpm,10 min,取上清液,冷藏备用。
(2)制备滤纸桥
裁剪合适尺寸的滤纸条,4层附着在电泳槽的支架上,一端与支架的前沿对齐,另一端浸于缓冲溶液中,而后用缓冲溶液全部浸湿,驱赶滤纸与支架间的气泡,使之紧贴于支架上。
(3)试剂的配制
①电泳缓冲溶液:6种电泳缓冲溶液按表1分别称取试剂,放入烧杯加水溶解后,移至1 000 mL容量瓶,定容,混匀备用。
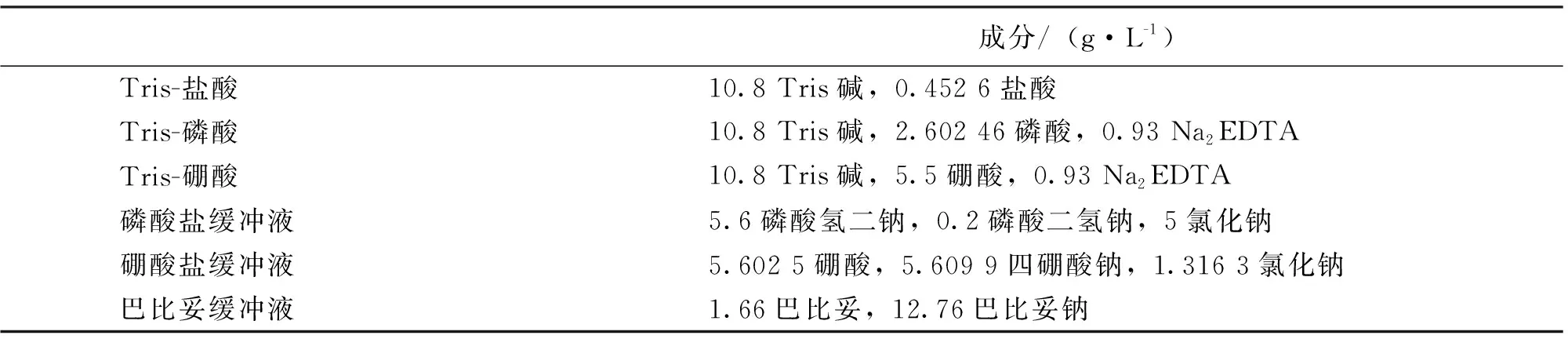
表1 6种缓冲溶液的成分
②染色液:称取氨基黑10B 0.5 g,放入烧杯中,加40 mL蒸馏水溶解后,移至100 mL容量瓶,加入冰乙酸10 mL,用甲醇定容至刻度。
③漂洗液:量取95%乙醇45 mL、冰乙酸5 mL,在100 mL容量瓶中用蒸馏水定容至刻度。
1.2.2 分组与薄膜的选择处理
将选定的缓冲液编号分组,1~6组分别为Tris-盐酸缓冲液、Tris-磷酸缓冲液、Tris-硼酸缓冲液、磷酸盐缓冲液、硼酸盐缓冲液、巴比妥缓冲液。
取6套玻璃平皿,按照1~6的顺序编号,依次加入对应的缓冲液。每套平皿中浸泡12张标记好的醋酸纤维膜,方法:辨别无光泽面,用铅笔在膜的一端2 cm处作标记,作为点样位置,然后将无光泽面向下,浸泡于平皿内缓冲液中,注意观察薄膜触及液面的瞬间,若瞬间全部浸湿说明薄膜质量好,否则应弃掉。使薄膜自然下沉,浸泡30 min。
1.2.3 最适电压的筛选
根据薄膜的长度计算电压[5],设定60 V、70 V、80 V 3种电压条件,观察各种缓冲液分离血清蛋白效果,最佳电压以图谱蛋白区带出现5条、条带整齐、清晰为判定标准。电泳时间为50 min。试验操作方法如下:
(1)点样 将充分浸泡的薄膜取出,用滤纸吸干多余缓冲液,无光泽面向上平放于干净的玻璃板上。取20 μL新鲜血清加在载玻片上,倾斜载玻片使血清分散,用点样器沾取血清,在纤维膜标记的位置垂直点样,并随之提起。
(2)电泳 将点样的醋酸纤维膜无光泽面向下,点样端靠近负极,两端紧贴电泳槽上的滤纸桥,拉直放好,每个电泳槽放置12条,盖好盖子,平衡10 min,选择电压和电泳时间,通电(3台电泳仪同时电泳,每台电泳仪连接2个电泳槽,电泳槽按照1-6编号,槽内是对应编号的缓冲液)。
(3)染色及漂洗 将纤维膜放入氨基黑染液染色5 min,取出,再漂洗3~5次,至背景清晰,记录试验结果。
1.2.4 缓冲溶液稳定性试验
(1)使用频次:每种缓冲液120张醋酸纤维膜,在最适电压下,观察各缓冲液分离血清蛋白图谱效果,操作方法同上,重复操作5次(24条/次)。根据有效纤维膜的蛋白区带出现条数及概率判定使用频次对缓冲液稳定性的影响。
(2)使用时间:室温放置6个月的缓冲液分离血清蛋白,重复上述操作1次(即每种缓冲液24条纤维膜),试验条件、操作方法和判定标准同上,观察放置一定时间对缓冲液稳定性的影响。
1.2.5 各种缓冲液电泳结果的比较
(1)电泳图谱蛋白质分离效果的比较
比较各种电泳缓冲液分离血清蛋白的效果,根据蛋白区带出现条数、概率以及分辨力对缓冲液进行评价。
(2)蛋白质区带分散程度定量分析
分别选择各种缓冲液电泳效果较好的图谱,测量各组蛋白间距,计算并取均值,根据膜条扩展的总距离(从点样区到清蛋白最远端的距离)、点样区距第一条带远端、最远区带与最近区带的距离对缓冲液进行评价。
1.2.6 统计学处理
用IBM SPSS Statistics 25对实验数据进行统计学处理。缓冲液的区带分散程度定量分析比较采用配对样本t检验。
2 结果与分析
2.1 最适电压的筛选结果
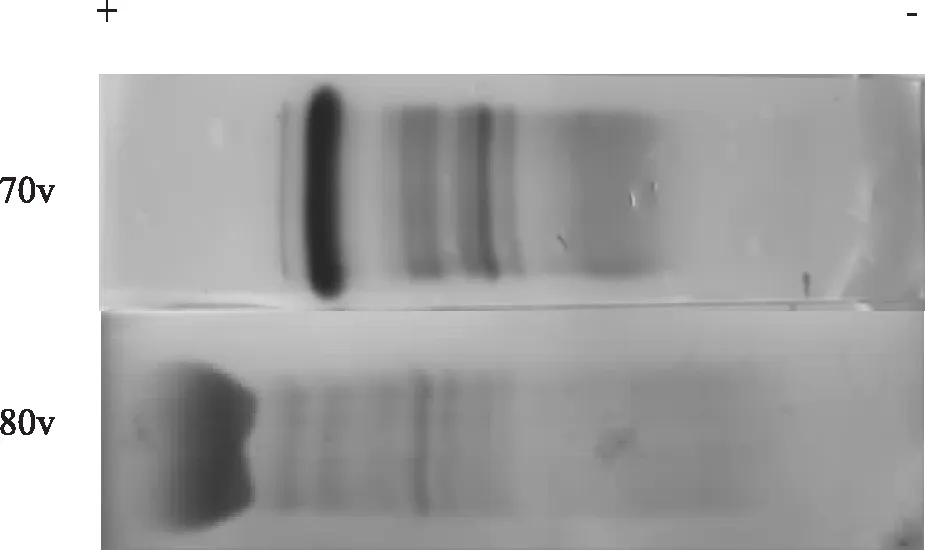
在60 V电压时,Tris-盐酸、Tris-磷酸、磷酸盐、巴比妥缓冲液的电泳图谱均出现4条蛋白质区带,其中第3条为α2-球蛋白和β-球蛋白合并,称为α2、β-球蛋白(下同),从正极到负极依次为清蛋白、α1-球蛋白、α2、β-球蛋白、γ-球蛋白;硼酸盐缓冲液出现3条蛋白质区带,其中第2条为α1、α2、β-球蛋白合并。70 V电压时,Tris-盐酸、Tris-磷酸、磷酸盐、巴比妥缓冲液图谱出现5条区带,从正极到负极依次为清蛋白、α1-球蛋白、α2-球蛋白、β-球蛋白、γ-球蛋白,硼酸盐缓冲液的电泳图谱则均出现4条区带。80 V电压时,Tris-盐酸、Tris-磷酸、巴比妥缓冲液的电泳图图谱均出现5条区带,磷酸盐、硼酸盐缓冲液的电泳图谱均出现4条(表2)。Tris-硼酸缓冲液在3个电压梯度下图谱均出现8条区带。70v时各缓冲液电泳图谱区带数量出现最多,且区带整齐、分辨力高、位置较适中,为最佳电压。
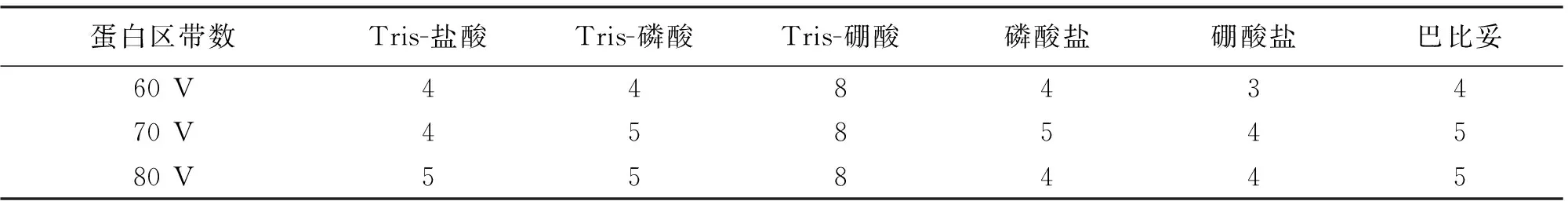
表2 不同梯度电压各种缓冲液电泳图谱最多区带数统计(n=12)
2.2 稳定性测试试验结果
2.2.1 使用频次
除去薄膜质量、操作失误等问题导致结果无效的,在使用频次稳定性试验中有效薄膜及区带数量见表3。第1次试验中,Tris-盐酸、Tris-磷酸和巴比妥缓冲液中图谱出现5条区带概率分别为8.33%、66.66%、65.22%;第5次试验中,Tris-盐酸、Tris-磷酸、磷酸盐和巴比妥缓冲液中图谱出现5条区带概率分别为8.33%、68.18%、62.50%,出现5条区带概率相差不大。Tris-硼酸和硼酸盐缓冲液电泳图谱均未出现5条蛋白质区带。
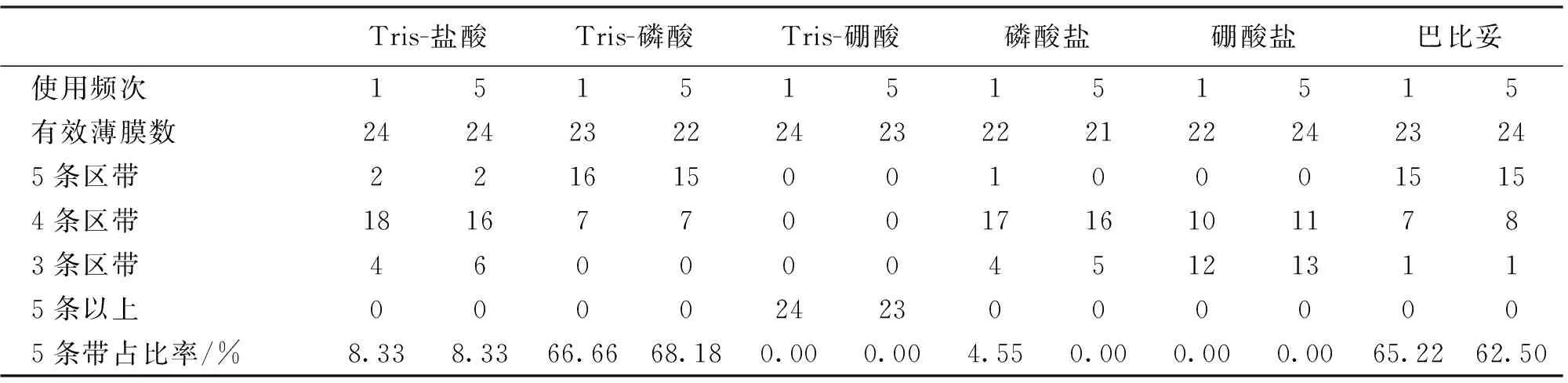
表3 各种缓冲液使用频次稳定性试验结果
2.2.2 使用时间
缓冲液放置6个月稳定性电泳试验结果见表4,Tris-盐酸、Tris-磷酸和巴比妥缓冲液图谱出现5条区带概率分别为8.69%、62.50%、58.33%,与使用频次稳定性试验中首次电泳结果相比差异较小。
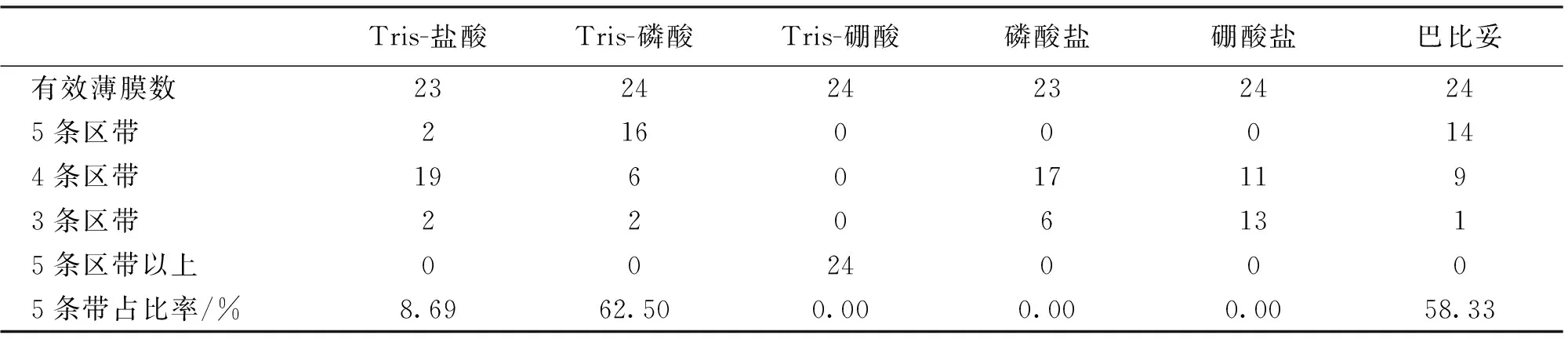
表4 缓冲液放置6个月电泳稳定性试验结果
2.3 各种缓冲液电泳图谱的比较结果
2.3.1 电泳图谱蛋白质分离效果的比较
选择的是70 V电压、50 min条件下各种缓冲液具有代表性的图谱,并根据蛋白质泳动速度和分散距离分类比对,见图1~3。图1为Tris-盐酸、Tris-磷酸和巴比妥缓冲液,这3种缓冲液虽然分散有所程度不同,但图谱居中;与其他两种缓冲液不同的是,Tris-盐酸4条蛋白质区带居多;图2为硼酸盐和磷酸盐缓冲液,二者区带数及位置基本相同。图3为Tris-硼酸缓冲液,图谱有9条区带。可见在相同试验条件下,Tris-磷酸和巴比妥缓冲液图谱效果优于其他缓冲液。
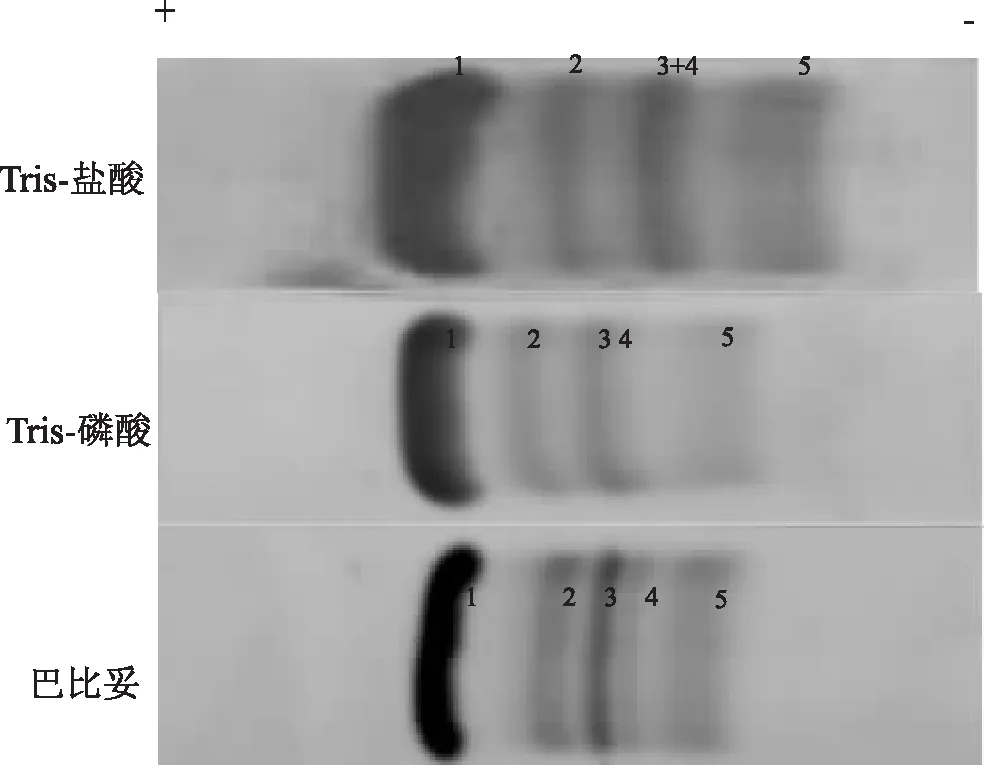
注:1.清蛋白;2.α1-球蛋白;3.α2-球蛋白;4.β-球蛋白;5.γ-球蛋白图1 Tris-盐酸、Tris-磷酸和巴比妥缓冲液电泳图谱分离效果的比较

注:1.清蛋白;2.α1-球蛋白;3.α2β-球蛋白;4.γ-球蛋白图2 硼酸盐和磷酸盐缓冲液电泳图谱分离效果的比较
注:因不能确定图谱蛋白区带名称故没有进行标记图3 Tris-硼酸缓冲液电泳图谱分离效果
2.3.2 区带分散程度定量分析
每种缓冲液选取50张醋酸纤维膜,分别统计薄膜蛋白区带分布距离,取其平均值进行统计学分析,结果见表5。膜条扩展的总距离,Tris-盐酸、Tris-磷酸和巴比妥缓冲液三者间差异不显著(P>0.05),与磷酸盐和硼酸盐缓冲液间差异极显著(P<0.01);点样区距第一条带远端的距离和最远区带与最近区带的距离,Tris-磷酸与巴比妥缓冲液二者间无显著差异(P>0.05),与Tris-盐酸差异显著(P<0.05)、与磷酸、硼酸盐缓冲液差异极显著(P<0.01),Tris-盐酸与其他4种缓冲液均差异显著(P<0.05);最远区带与最近区带的距离,磷酸盐缓冲液与硼酸盐缓冲液间差异显著(P<0.05)。Tris-硼酸图谱均出现超过5条区带的现象,此处不做分析。

表5 各种缓冲液电泳图谱蛋白区带分散程度分析
3 讨 论
3.1 电泳电压的选择
影响质点迁移率的因素有多种,包括带电质点的性质、电场强度、缓冲液的黏度、温度、pH值和离子强度以及固体支持物的电渗现象等。由于醋酸纤维薄膜电渗很小,如果缓冲液性质稳定,此时影响质点迁移的主要因素便是电场强度。电泳速度与电场强度和电流强度成正比,电压增加,电流也相应增大,从而加速电泳。但电流过大时,血清蛋白运动快但区带却分不开,产生的热效应足够高的话甚至会使血清蛋白变性而不能分离[6]。此外,还应根据室温对电压适当调整[7,8],因此选择合适的电压是电泳试验良好效果的重要环节。
通过对60 V、70 V、80 V 3种电压梯度的对比,60 V时区带紧密不易分离,随着电压的增大,移动的距离越远,区带整体向正极方向移动的距离增加;80 V时蛋白区带整体明显偏向正极,导致缓冲液图谱的清蛋白泳动到滤纸桥边缘,造成蛋白丢失,且电压过高导致Tris-硼酸的清蛋白出现了“蝴蝶状”。说明电压过高,蛋白质各组分之间展开距离短,出现挤压,导致区分困难,并且极易造成蛋白质区带过度移动;电压过低,样品泳动速度慢且易扩散,所呈现的图谱常有“拖尾”现象不利于图谱的观察。
3.2 电泳缓冲液的稳定性
除了离子强度和电场强度,使用频次和放置时间也是影响电泳缓冲液稳定性的主要因素。试验表明,图谱出现各种蛋白质区带数量首次比末次(第5次)相比较,Tris-磷酸、Tris-硼酸、磷酸盐、硼酸盐和巴比妥缓冲液基本一致,说明使用频次5次以内,各缓冲液图谱区带数量和清晰度变化不大;Tris-盐酸缓冲液图谱出现4条和3条蛋白质区带的薄膜数量前后相差2张,说明重复使用5次对该缓冲液电泳效果有一定影响。放置了6个月的缓冲液图谱出现各种蛋白质区带数量与频次稳定试验中首次数量对比,各种缓冲液相差不明显,出现5条的占比率有所下降,其中Tris-磷酸缓冲液比放置前降低了4.16%,巴比妥缓冲液降低了4.17%,可见放置6个月时间的电泳缓冲液的电泳图谱区带占比率总体是下降的,但下降幅度不大,可以继续使用,表明室温下放置6个月时间对缓冲液稳定性影响较小。含Tris碱的电泳缓冲溶液对温度比较敏感,在温度改变10摄氏度时,电泳缓冲液的pH会发生明显的改变[9],因本试验温度在20~25 ℃,故不存在这种可能性。电泳槽中缓冲溶液经6次使用后不应简单地采取交换电极的方法,而是将缓冲液取出重新混合过滤后再进行使用,一般用4个周期后需更换新溶液[10]。
3.3 区带分离效果及分散程度
电泳图谱和各蛋白分散程度分析是验证优质电泳缓冲液的两个重要条件。选择适合电泳的电极缓冲液是蛋白分离图谱质量的保障,不仅可以提高区带分辨力和清晰度,还能降低拖尾和吸附现象。通过缓冲液对比试验发现,以Tris碱制成的有机电泳缓冲溶液比无机缓冲溶液出现的试验结果好。原因可能为Tris缓冲溶液稳定,与血清的相容性好,Tris-硼酸缓冲溶液与钙、镁离子不会形成沉淀;相反,硼酸盐与钙、镁离子会产生沉淀,当相同pH、相同浓度的Tris-硼酸缓冲溶液的离子强度比硼酸盐缓冲溶液的离子强度低,这对血清蛋白测定尤为重要[9]。
Tris-磷酸与巴比妥缓冲液的电泳图谱不仅出现5条蛋白质带比率相当,而且区带清晰、整齐、易分辨,说明这2种缓冲液分离血清蛋白的效果相当;同样的磷酸和硼酸盐缓冲液图谱蛋白质出现4条,且结构紧密,泳动距离短,用于醋酸纤维膜电泳效果较差;Tris-磷酸与巴比妥缓冲液、磷酸盐和硼酸盐缓冲液的膜条扩展的总距离、点样区距第一条带远端的距离、最远区带与最近区带的距离均相差不大,虽然Tris-盐酸上述3项指标都优于巴比妥,但Tris-盐酸出现4条区带比率较大,且蛋白区带有扩散现象,综合考虑效果不如巴比妥缓冲液。
综上所述,采用醋酸纤维膜电泳分离家兔血清蛋白,在电压条件为70 V时,各种缓冲液电泳分离血清蛋白图谱均达到最佳,其中Tris-磷酸、巴比妥、Tris-盐酸缓冲液均出现5条清晰区带;各缓冲液稳定性在使用5次以内、室温条件放置6个月后影响不大;图谱区带数量、清晰度、分散程度分析表明Tris-磷酸、巴比妥缓冲液效果最好,Tris-盐酸缓冲液次之,磷酸盐、硼酸盐缓冲液较差;Tris-硼酸缓冲液为何出现的多于5条蛋白质区带、每条区带是什么蛋白质,尚待进一步研究探讨。
4 结 论
6种电泳缓冲液在电压为70 V、电泳时间为50 min试验条件下分离血清蛋白,图谱区带清晰、重复性好、结果稳定。以图谱分离5条蛋白质区带为准,Tris-磷酸缓冲液与巴比妥缓冲液效果相当,可以替代巴比妥缓冲液用于血清蛋白纤维膜电泳。

