基于模拟CT 图像分割肿瘤治疗电场电极贴片对共面调强放疗计划剂量分布的影响
冯婧文,王 政,石祥宇,杜芳芳,姜 炜
(天津市环湖医院肿瘤放射治疗科,天津 300222)
0 引言
胶质母细胞瘤(glioblastoma,GBM)是一种侵袭性极强的常见脑部原发性肿瘤[1]。肿瘤治疗电场(tumor treating fields,TTFs)已被美国食品药品监督管理局(Food and Drug Administration,FDA)批准用于GBM治疗。TTFs 装置形成的低强度中频电场可以通过多种途径抑制肿瘤细胞增殖和迁移,同时显示出与放疗的协同作用[2-7]。TTFs 电极贴片的分布具有肿瘤位置和颅骨形状的特异性,更换贴片需要较长时间。有学者指出放疗期间佩戴电极贴片有望提高患者依从性,同时节约更换贴片的成本[8]。
TTFs 装置由4 个独立的电极贴片阵列组成,每个阵列包括9 个规则排列的高密度贴片和金属导线。电极贴片的组成材料主要包括铅、镁、铌酸铅、钛酸铅等高密度材料[9],其直径为20 mm,厚度为2.5 mm,在千伏级CT(kV-CT)上产生很强的伪影,给电极贴片结构的勾画带来很大挑战。因此,有效地勾画出TTFs 电极贴片的结构并分析其对剂量计算和分布的影响,可以为临床应用提供参考。
早期的研究通过kV-CT 进行扫描,给电极贴片赋予铝的电子密度,并通过容积旋转调强放疗(volumetric modulated arc therapy,VMAT)计划计算贴片对剂量的影响[10]。同年,有学者利用兆伏级CT(MVCT)显示出电极贴片的结构,其厚度小于电极贴片的实际厚度,随后通过开野照射测量得出不同深度的剂量衰减介于kV-CT 和MV-CT 计算结果之间,并通过VMAT 计划计算并比较两者的差异[11]。随后,其他研究者利用锥形束CT(cone beam CT,CBCT)获取电极贴片结构,以实际测量和线性衰减系数推算出TTFs 电极贴片的物理密度为3.56 g/cm3,CT 值为3 832 HU,并通过非共面调强放疗(intensity-modulated radiation therapy,IMRT)计划计算并分析电极贴片对剂量的影响[12]。模拟CT(simulated CT,sim-CT)(一种kV-CT)在脑组织成像的清晰度和对比度上要优于CBCT 和MV-CT,广泛应用于靶区勾画、计划设计和剂量计算中。通过sim-CT 对电极贴片进行扫描减少了与患者sim-CT 配准的误差。但研究者们没有明确阐述在kV-CT 图像中如何获取TTFs 电极贴片的结构、结构的大小,以及电极贴片结构对临床广泛使用的共面IMRT 计划剂量分布的影响。本研究设计并测试一种sim-CT 图像中TTFs 电极贴片的勾画方法。在此基础上建立不同的模型定量分析开野照射和共面IMRT 计划计算中电极贴片对剂量分布的影响,并与上述的剂量学研究作对比以分析方法的有效性,为临床工作提供参考。
1 材料和方法
1.1 TTFs 电极贴片自动分割
以SP24(IBA dosimetry,Germany)固体水模体建立一个30 cm×30 cm×20 cm 的模型。在模体表面的中心分别粘贴1 个单独的电极贴片和由9 个电极贴片组成的阵列,之后进行sim-CT 扫描,获取图像。扫描设备为Brilliance CT BigBore(Philips Medical Systems,Netherlands)。扫描条件为:层厚2 mm,层间隔1 mm,电压120 kV,图像分辨力为512×512 像素。将图像传输至放疗计划系统(treatment planning system,TPS),TPS 版本为Eclipse15.1(VarianMedical Systems,Palo Alto,CA,USA)。为去除伪影和减少CT 容积效应影响,经多次实验研究后将2 800~3 071 HU 作为自动分割的阈值勾画出电极贴片的结构,再通过逻辑运算去除体轮廓线(Body 轮廓线)以内重叠的结构,将新的结构作为电极贴片用于后续研究。在放射治疗计划优化和剂量计算的过程中,参考Guberina 的研究结果,为电极贴片赋值3 832 HU[12]。CT 质量控制使用DOSE1 剂量仪、FC-65G 指型电离室(IBA dosimetry,Germany)和随机器附带的测量模体(Performance Phantom Kit)。
1.2 分析电极贴片和电极贴片阵列对剂量的影响
分别针对单一电极贴片和电极贴片阵列的2 种模型设置10 cm×10 cm 和15 cm×15 cm 的单一照射野,电极贴片和电极贴片阵列位于射野的中心,源皮距(source skin distance,SSD)为95 cm,X 射线能量为6 MV,固定放疗加速器输出为200 MU 进行剂量计算。在单一电极贴片的研究中,分别分析有/无贴片和有/无伪影对剂量分布的影响。为了便于分析无伪影时电极贴片对剂量分布的影响,将分割得到的电极贴片转移到没有贴片的固体水模体表面建立模型并进行剂量计算。为了定量分析单一电极贴片对剂量计算结果的影响,共设置了15 处剂量参考点,横坐标分别为电极贴片中心、中心左侧0.5 cm(高密度材料的正下方)和中心右侧-0.89 cm(电极贴片边缘),纵坐标分别为表面以下不同深度(0、0.5、1.0、1.5、2.0、3.0和5.0 cm)。在电极贴片阵列的研究中,分析有/无电极贴片阵列对百分深度剂量(percentage depth dose,PDD)和不同深度剂量分布轮廓(profile)的影响。
1.3 IMRT 计划剂量学研究
影像数据来源于本院15 例经组织学诊断为GBM的患者,其中13 例为首次诊断病例、2 例为复发病例。15 例患者均符合TTFs 治疗的纳入标准(成人高级别幕上胶质瘤),并已接受TTFs 治疗。15 例患者的肿瘤位置、计划靶区(planning target volume,PTV)体积和处方剂量信息见表1。

表1 15 例患者的肿瘤位置、PTV 体积和处方剂量
在端对端立体定向验证头部模体(STEEV,CIRS 038 head phantom)上分别按照患者的肿瘤所在位置粘贴电极贴片阵列,扫描获取15 组sim-CT 图像。同时,单独扫描没有电极贴片的STEEV 模体。CT 扫描条件与前文所述相同。患者实际的PTV 和危及器官(organ at risk,OAR)由肿瘤医师通过sim-CT 图像结合MRI 进行勾画和外扩,随后将结构复制到STEEV模体的sim-CT 图像上建立患者模型。再由经验丰富的肿瘤放疗医师对PTV 和OAR 进行调整,以尽可能地贴近临床真实情况。在无电极贴片的患者模型的sim-CT 图像上进行共面IMRT 计划设计和优化,优化条件为在PTV 不包含OAR 的前提下95%的处方剂量覆盖100%的PTV。重要危及器官剂量限值:脑干<54 Gy,视神经<54 Gy,视交叉<54 Gy,晶体<8 Gy。优化后分别在有/无电极贴片的患者模型CT 图像上进行剂量计算,保持所有计算条件一致且均采用各向异性解析算法(anisotropic analytic algorithm,AAA)进行剂量计算。针对计划计算得到的剂量分布的定量分析,主要考察V98%(98%处方剂量覆盖的PTV 体积)、靶区剂量的均匀性指数(homogeneity index,HI)[计算公式为(D2%-D98%)/D50%]、D2%[除PTV 以外的脑组织(Brain-PTV)中2%最大暴露体积的最小剂量]和头皮Scalp 剂量。针对头皮毒性的分析,本研究中从Body 轮廓线开始,按照每2 mm 深度为一层直到表面以下1 cm 被分为5 层结构,分别命名为Scalp1、Scalp2、Scalp3、Scalp4 和Scalp5[12],第一层(Scalp1)按照1 mm 厚度再分为2 个亚层,分别命名为Scalp001和Scalp002。此外,将小脑幕上区域的颅骨以外的头皮组织单独作为一个结构进行分析与评价,将其命名为Scalp,并分析头皮组织的D20cc和D30cc的变化[10,13]。
1.4 统计学方法
采用IBA SPSS statistic 24 进行统计分析,对数据进行Shapiro-Wilk(S-W)正态性检验,数据不符合正态分布时显著性统计采用Wilcoxon 秩和检验。
2 结果
2.1 从sim-CT 图像中获取TTFs 电极贴片的结构
将不同阈值条件下自动分割获得的电极贴片的轮廓与电极贴片实际大小比较分析后,以2 800~3 071 HU 进行图像分割获得的电极贴片结构作为剂量学研究的基础,该结构的厚度为(0.33±0.08)cm,直径为(1.70±0.01)cm,如图1 所示。

图1 不同阈值条件下分割得到的TTFs 电极贴片轮廓
2.2 电极贴片和电极贴片形成的伪影对剂量分布的影响
将图2(a)、(b)与(c)进行比较,根据等剂量曲线的分布可以看出kV-CT 扫描下电极贴片产生的伪影对计算得到的剂量分布影响比较大,在剂量计算中应考虑去除伪影,以图2(a)和(c)中的模型进行剂量学计算的比较,用于剂量对比的参考点位置如图2(a)和(c)所示,计算得到的各参考点的剂量见表2~4。表2 中的数据显示,在水模体表面以下深度1.5 cm内,有电极贴片时参考点的剂量相对于没有电极贴片时有增加的趋势。在电极贴片与模体接触的表面剂量增加最为明显,电极贴片中心、高密度材料正下方和电极贴片边缘的剂量相对于没有电极贴片的计算结果分别增加了54.7%、222.8%和24.4%。表3 为水模体表面以下1.5 cm 处有/无电极贴片时的剂量对比,结果表明剂量变化没有固定趋势。表4 为有/无电极贴片时水模体表面下1.5 cm 深度以下参考点的剂量,该深度处电极贴片中心位置下方及高密度材料的正下方剂量相对于没有电极贴片时开始下降。到达水模体表面以下5 cm 处后,参考点处的剂量相比于没有电极贴片时分别降低了2.22%、2.65%和1.32%。由于水模体表面下1.5 cm 以内和以下的数据的趋势不同,将其分为2 组分别进行统计分析。结果显示,水模体表面下1.5 cm 以内剂量增加,差异具有统计学意义(Z=-2.547,P=0.011),而1.5 cm 以下剂量下降但差异没有统计学意义(Z=-1.599,P=0.109),详见表2、4。

表4 有/无电极贴片时水模体表面下1.5 cm 深度以下参考点剂量 单位:Gy

图2 电极贴片及其形成的伪影在单一固定照射野时水模体中的剂量分布

表2 有/无电极贴片时水模体表面下1.5 cm 深度以内参考点剂量 单位:Gy

表3 有/无电极贴片时水模体表面下1.5 cm 处参考点剂量 单位:Gy
2.3 电极贴片阵列对剂量分布的影响
由9 个电极贴片组成的电极贴片阵列对剂量分布的影响如图3~5 所示。图3 为有/无电极贴片阵列时剂量分布的剖面图。图4(a)显示高密度材料下方PDD 曲线建成区向左上方偏移,在水模体表面以下1.5 cm 附近与无电极贴片时的PDD 曲线交叉,随后开始衰减,同深度下百分剂量稳定低于无电极贴片时。图4(b)为2 个电极贴片之间的PDD 曲线,在水模体表面下深度2 cm 以内电极贴片阵列带来的散射使PDD 曲线向左上方偏移,但不明显,在2 cm 以下2 条曲线基本重合。通过观察水模体表面以下不同深度的剂量分布轮廓(profile)可以得到相同的结果。如图5(a)所示,在水模体表面电极贴片下的剂量被提高,电极贴片之间的剂量略有提高,而整个阵列的边缘剂量下降。在距水模体表面1.5 cm 深度以下,高密度材料正下方剂量衰减,而贴片之间剂量变化不明显,电极贴片阵列的边缘剂量与无电极贴片时一致,如图5(b)~(d)所示。

图3 有/无电极贴片阵列时剂量分布的剖面图
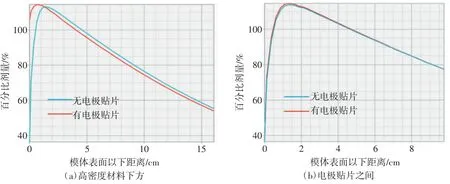
图4 电极贴片对PDD 的影响
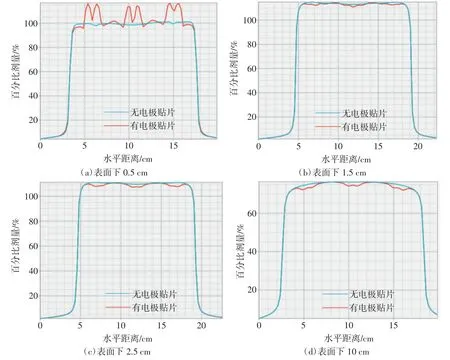
图5 电极贴片阵列对profile 的影响
2.4 基于STEEV 模体的患者模型共面IMRT 计划剂量计算和分析
STEEV 模体患者模型PTV 与Brain-PTV 在有/无电极贴片时剂量的对比结果见表5,在增加电极贴片阵列后的计算中,98%处方剂量覆盖的靶区体积变化很小,最大下降1.5%(Z=-2.810,P=0.005)。靶区剂量的均匀性(HI)基本没有变化(Z=-1.414,P=0.157)。增加电极贴片后,15 例患者模型的D2%均下降,最多下降0.8%(Z=-3.305,P=0.001)。
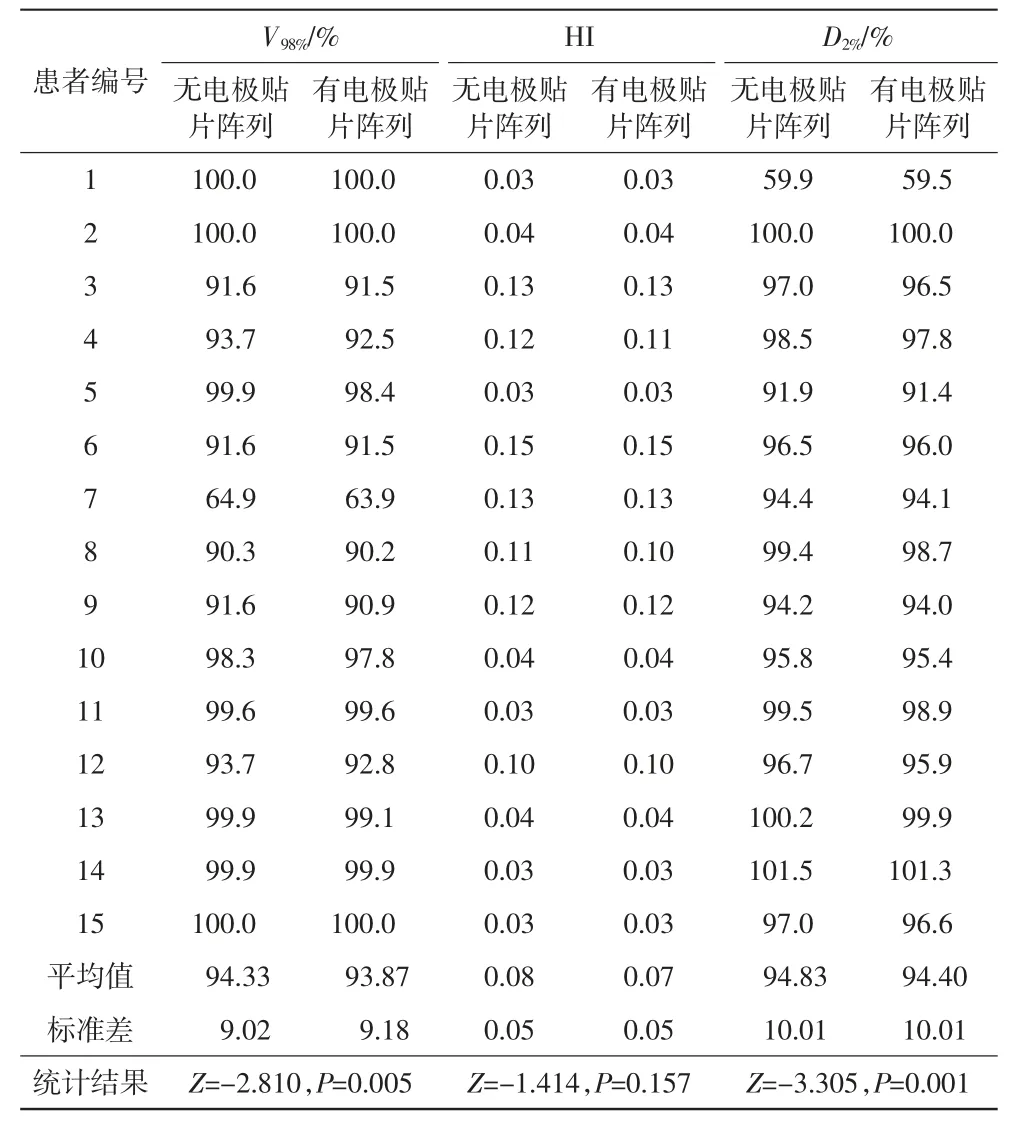
表5 PTV 与Brain-PTV 在有/无电极贴片时剂量的对比
图6 给出了在共面IMRT 计划剂量计算中电极贴片阵列对头皮剂量的影响。不同深度分层后计算得到的剂量变化相对最大的是Body 轮廓线以下1mm深度范围内,Dmax最多增加到无电极贴片时剂量的160.8%,按处方剂量归一后,该层的Dmax最大增加处方剂量的26.65%(范围从1.61%到26.65%),Dmean最大增加处方剂量的1.76%(范围从0.07%到1.76%)。表6 为各层头皮结构的Dmax和Dmean变化的统计结果。表6 结合图6 中的数据分布可以看出头皮的Scalp001 到Scalp3(皮肤表面下6 mm)内剂量增加且差异具有统计学意义,而6~10 mm 之间的剂量变化不明显,差异没有统计学意义。

表6 头皮各层结构在有/无电极贴片时剂量差异的统计结果

图6 有/无电极贴片阵列时不同深度下头皮剂量变化值占处方剂量的百分比
表7 中展示了小脑幕以上头皮结构作为一个整体在有/无电极贴片时D20cc和D30cc的变化量,数据为变化量按照各例患者处方剂量归一的结果。结果显示,小脑幕以上头皮的D20cc和D30cc均小幅度增加且差异具有统计学意义(D20cc:Z=-3.408,P=0.001;D30cc:Z=-0.348,P=0.001)。
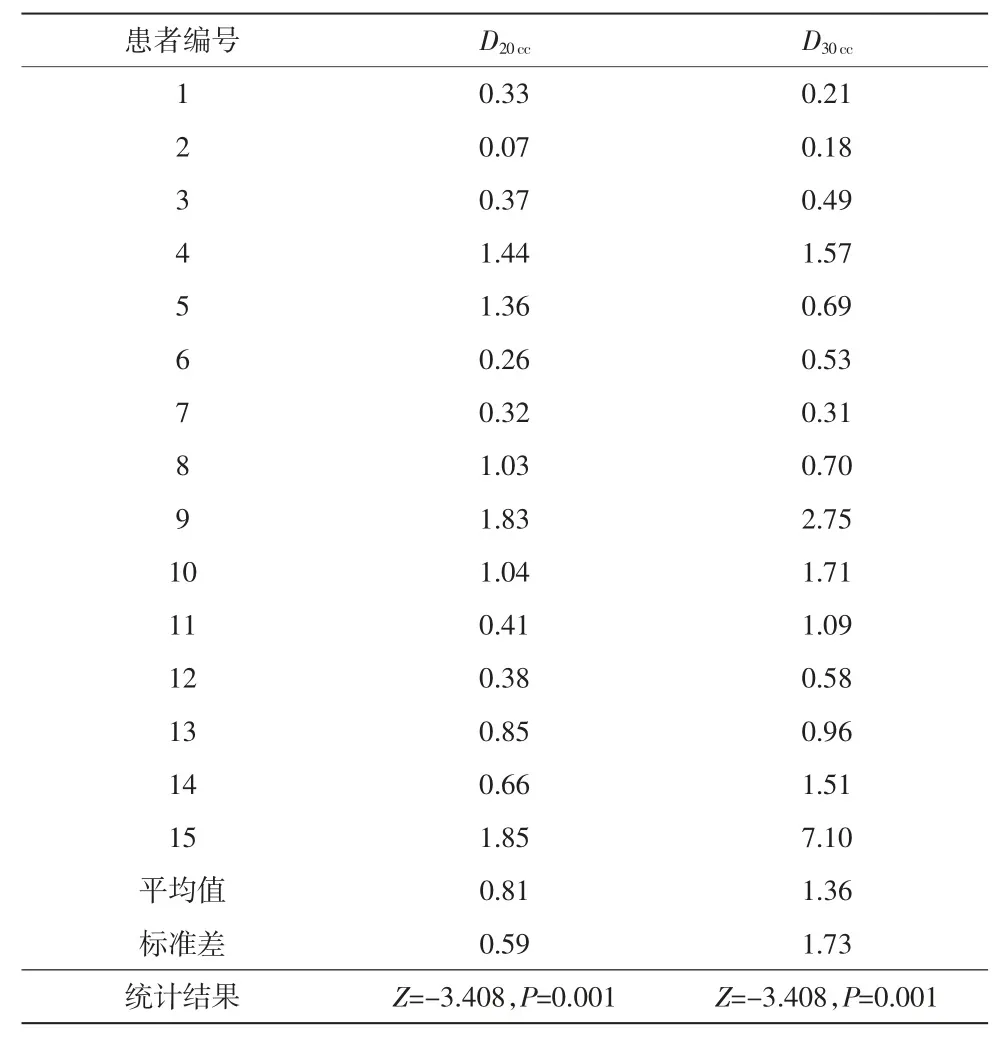
表7 有/无电极贴片时头皮Scalp 的D20cc 和D30cc 的变化量 单位:%
3 讨论
Stupp 等[14-16]的一系列临床研究证实了辅助TTFs 有效地延长了胶质瘤患者的无进展生存期和总生存期,奠定了FDA批准TTFs 用于胶质瘤治疗的基础。TTFs 作为辅助治疗方法,早期应用于手术后完成放疗的胶质瘤患者,并与序贯替莫唑胺(temozolomide,TMZ)化疗联合应用[14-16]。研究显示,TTFs 形成的电场可延迟辐射诱导的肿瘤细胞DNA 损伤的修复,与放疗结合能够更有效地抑制肿瘤细胞生长并促进细胞凋亡[6-7,17]。TTFs 与放化疗同步治疗胶质瘤正被临床接受和采用[13]。放疗同步TTFs进行治疗时,可以在照射时取下电极贴片,照射后更换新的电极贴片重新佩戴,而此方法存在以下问题:电极贴片造价高,频繁更换增加了治疗费用,从而降低了患者依从性;取下和重新佩戴电极贴片需要耗费时间,减少了患者佩戴时长。此外,放射治疗诱导DNA 损伤,而DNA 的修复在损伤形成后很快启动,放射治疗后尽快恢复电场环境有望提高治疗效果使患者受益。因此,在放射治疗时同时佩戴电极贴片成为研究的方向[6,13]。电极贴片作为高密度材料必然会对放射治疗的剂量分布产生影响,针对这一问题进行研究和分析是至关重要的。
探索电极贴片对剂量计算的影响的研究中,不同研究者分别使用 了kV-CT、CBCT 和MV-CT,其中kV-CT 在临床患者定位扫描和靶区、OAR 勾画中使用最普遍。共面IMRT 计划相对VMAT 计划计算时间短,对晶体散射剂量小。同时共面IMRT 技术在临床实施上相对于非共面IMRT 技术执行简单、快速,在一般性的治疗计划中普遍使用。本研究针对kV-CT 和共面IMRT 计划进行了探索和分析。首先建立并详细描述了一种从kV-CT 图像中获取TTFs电极贴片结构的方法,并给电极贴片赋予特定CT值。本研究中采用了Guberina 等[12]的研究结果,将3 832 HU 作为电极贴片结构的CT 值用于计算[10,12]。随后分别分析了单一电极贴片高密度材料下方、贴片中心和边缘剂量的变化情况,以及一组电极贴片阵列对PDD 和profile 的影响。结果显示,在水模体表面以下1.5 cm 内单一电极贴片使上述3 个位置的剂量不同程度的增加,最大增加了222.8%(原剂量的3.22 倍),接近于Bender 等[8]通过胶片测量得到的表面剂量增大倍数(3.5 倍),大于Li 等[10]通过平行板电离室测量的表面剂量最大增加幅度(110%);本研究中在垂直方向5 cm 深度剂量最大衰减2.6%,与Bender 等[8]使用胶片测量的结果近似(3%~5%),与Li 等[10]测量得出的深度剂量下降小于2.54%的结果一致。统计结果显示,剂量的增加具有差异显著性而深度剂量的降低无统计学差异。
针对共面IMRT 计划的剂量计算研究,本研究增加了病例数量并选取了靶区分布于不同位置的患者结构集。以本研究中描述的方法获取的电极贴片的结构进行剂量计算,结果显示98%处方剂量覆盖的PTV 体积和除PTV 外脑组织的D2%减少且差异具有统计学意义,而靶区的HI 和Brain-PTV 的D2%没有显著变化,头皮靠近射线源一侧剂量增加。研究结果中PTV 剂量的改变与Guberina 等[12]利用CBCT 和非共面IMRT 计划计算得到的结果(CTV D95%下降小于2%)以及Li 等[10]的VMAT 计划剂量计算结果[PTV 覆盖率下降(0.7±0.4)%的趋势]一致,而头皮剂量增加则大于Guberina 等[12]的计算结果(表皮2 mm 内剂量增加不超过处方剂量的8.5%)。头皮剂量变化最大值与Li 等[10]在VMAT 计划中的计算结果(头皮剂量增加130%~160%)一致,本研究结果为最大增加到原剂量的160.8%,处方剂量归一后最大剂量较原处方剂量增加了26.65%。本研究中建立的方法获取的电极贴片结构用于IMRT 计划剂量计算的结果接近于物理测量的值,可以为剂量研究和临床工作提供参考。
在放疗计划系统中高密度介质的计算受多种因素的影响[18]。综合分析,本文和以往其他学者的研究结果可以看出,不同的成像方式、电极贴片结构的提取和勾画方式、电极贴片被赋予的CT 值、治疗技术的选择会给剂量计算带来影响。但是研究的结论是一致的,电极贴片能够减少深部剂量,但不具有临床显著性,同时有增加头皮放射毒性的风险。建议在TTFs 同步照射时根据患者的具体情况选择合适的照射方式和计划设计,适当考虑头皮保护。本研究结果作为对其他学者研究结果的补充,能为基础研究和临床提供参考,使更多患者受益。
本研究受实际条件的限制没有对剂量进行实际测量,在后续研究中将扩大样本数量,增加剂量测量。

