L02肝脂肪变性细胞膜快速筛选大黄调血脂活性成分
武晓玉,段文达,夏鹏飞,王玉霞,边惠琴,赵 磊*
• 药理与临床 •
L02肝脂肪变性细胞膜快速筛选大黄调血脂活性成分
武晓玉1, 2, 3,段文达1,夏鹏飞1, 2, 3,王玉霞1,边惠琴1,赵 磊1, 2, 3*
1. 甘肃中医药大学药学院,甘肃 兰州 730000 2. 甘肃省高校中(藏)药化学与质量研究省级重点实验室,甘肃 兰州 730000 3. 甘肃省道地药材质量标准化研究与推广工程实验室,甘肃 兰州 730000
构建L02肝脂肪变性细胞膜固相色谱耦合脂肪变性模型,并将其应用于大黄调血脂活性成分的快速筛选。利用L02肝脂肪变性细胞膜作为固定相选择性地吸附大黄30%乙醇提取液中的活性成分,采用高效液相色谱(HPLC)测定吸附前后的化学成分;根据对照品的保留时间及紫外光谱信息,对比鉴定各亲和活性成分;并将筛选出的活性成分进一步作用于L02肝脂肪变性细胞模型,验证其调血脂作用。从大黄30%乙醇提取液中共筛选出11种活性成分,分别为芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚和6种未知成分。芦荟大黄素等蒽醌苷元能够显著降低L02肝脂肪变性细胞中三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)含量(<0.01),且可减少L02肝脂肪变性细胞中的脂肪粒。建立的L02肝脂肪变性细胞膜固相色谱耦合脂肪变性模型可用于快速筛选中药复杂体系中的活性成分,为进一步深入探究大黄调血脂活性成分群奠定了基础。
大黄;L02肝脂肪变性细胞;细胞膜固相色谱;活性成分;芦荟大黄素;大黄酸;大黄素;大黄酚;大黄素甲醚
大黄为甘肃道地药材,其药用历史悠久、资源丰富,为临床常用中药之一。《神农本草经》记载其“荡涤肠胃,推陈致新,通利水谷,调中化食,安和五脏”[1];临床主要用于大便干结、湿热泄泻、湿热黄疸、热邪血热、火眼充血、咽喉肿胀、牙龈炎痛、皮感疼痛、表皮烫伤、瘀血诸证[2]。现代药理学研究表明,大黄具有泻下、抗菌、抗肿瘤、抗炎、抗病毒、调血脂等作用[3]。目前大黄调血脂的研究主要旨在证明其调血脂能力[4-6],其具体调血脂活性成分尚不明确。本课题组前期利用高血脂大鼠模型对大黄水提液、30%乙醇提取液、醋酸乙酯提取液进行筛选,通过测定血清中三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)含量,对大黄不同部位调血脂效果进行综合评价,发现大黄30%乙醇提取液是其调血脂有效部位[7]。
细胞膜固相色谱法的原理为直接用生物靶点富集的细胞膜,选择性地结合中药提取液中的活性成分,洗去未结合成分后,再用解离液将细胞膜上的成分解离下来,利用色谱技术分离鉴定效应物质。细胞膜固相色谱具有快速、方便等优点,适用于中药复杂成分的高通量筛选[8-13]。为深入探究大黄调血脂活性成分群,本研究利用L02肝脂肪变性细胞膜固相色谱快速筛选大黄调血脂活性成分,并将其活性成分进一步作用于L02肝脂肪变性细胞模型,以验证其调血脂效果,为探明大黄调血脂的药效物质基础提供参考。
1 材料
1.1 细胞株
人L02肝细胞购自普诺赛生命科技有限公司。
1.2 药材
大黄购自甘肃陇脉药材有限公司,经甘肃中医药大学药学院林丽高级实验师鉴定为掌叶大黄L.的干燥根。
1.3 药品与试剂
PBS溶液(批号AQ29629583)、青链霉素混合液(批号20201116)、胰酶(批号20210629)、RPMI 1640培养液(批号AG29643109)、胎牛血清(批号21040702)、二甲基亚砜(DMSO,批号1121E0326)、Tris-HCl溶液(1 mol/L,批号20200821)、饱和油红O(批号20210616)、苏木素(批号21057999)、高效RIPA细胞裂解液(批号20200703)、油酸(批号SLBR187V)、Na+, K+-ATP酶活力测定试剂盒(批号20200629)、BCA蛋白定量试剂盒(批号20201022)、CCK-8试剂盒(批号PF724)购自北京索莱宝科技有限公司;TG测定试剂盒(批号20201118)、TC测定试剂盒(批号20201213)购自南京建成生物工程研究所;对照品芦荟大黄素(批号18121801)、大黄酸(批号20010901)、大黄素(批号20022605)、大黄酚(批号20011601)、大黄素甲醚(批号20110101)购自成都克洛玛生物科技有限公司,质量分数≥98%;甲醇、乙腈(色谱纯)购自德国Merck公司;超纯水由Milli-Q系统制备;其他试剂均为分析纯。
1.4 仪器
Waters Allince高效液相色谱仪(HPLC,美国Waters公司);BSA224S型电子天平(赛多利斯科学仪器有限公司);SW-CJ-2D型双人单面净化工作台(苏州净化设备有限公司);MCO-18AIC型CO2细胞培养箱(日本三洋株式会社);高速冷冻离心机(美国Beckman Coulter公司);JY92-ⅡDN型细胞破碎仪、XB-20型雪花制冰机(宁波新芝科技股份有限公司);IMARK型多功能酶标仪(美国Bio-Rad公司);AUTO X4全自动细胞荧光计数分析仪(美国Cellometer公司)。
2 方法
2.1 细胞培养
L02细胞用含10%胎牛血清、1%青链霉素混合液的RPMI 1640培养基,于37 ℃、5% CO2培养箱中培养。实验所用细胞代数为15~35代,均处于对数生长期。
2.2 L02肝脂肪变性细胞模型的建立[14]
采用不同浓度油酸刺激L02细胞,建立L02肝脂肪变性细胞模型;以细胞存活率及细胞内TG、TC含量评价造模是否成功。
2.2.1 细胞存活率的测定 取对数生长期L02细胞,以1×105/cm2接种于96孔板中,每孔100 μL,贴壁生长24 h。将细胞板分为加入培养基的正常组和加入油酸(0.25、0.50、1.00、1.50 mmol/L)的模型组及无细胞的空白组,培养24 h后,每孔加入10 μL CCK-8溶液,继续孵育1.5 h后终止培养,室温置于摇床10 min,采用酶标仪测定450 nm处各孔的吸光度()值,计算细胞存活率。
细胞存活率=(模型-空白)/(正常-空白)
2.2.2 细胞内TG、TC含量的测定 取对数生长期L02细胞,以2×105/cm2接种于6孔板,每孔1 mL,待贴壁后分为加入培养基的正常组和加入油酸(0.25、0.50、1.00、1.50 mmol/L)的模型组,培养24 h,吸去培养基,PBS溶液洗涤2次,加入350 μL细胞裂解液,低温下收集各组细胞,按试剂盒说明书测定细胞内TG及TC含量。
2.3 L02肝脂肪变性细胞膜固相色谱的制备[15-16]
取造模后的L02细胞,用1 mL PBS溶液洗涤2次,弃去PBS溶液,加入1 mL 0.25%胰酶消化4 min,轻轻吹打,镜下观察细胞全部脱落,加入1 mL PBS溶液终止消化,4 ℃、160×离心10 min,弃去胰酶,保留细胞沉淀。细胞沉淀加入5 mL PBS溶液,轻轻吹打均匀,4 ℃、160×离心10 min,洗涤2次。细胞在50 mmol/L Tris-HCL溶液中4 ℃条件下溶胀30 min,在破碎功率720 W、破碎时间2 s、冷却间隔2 s的冰浴条件下,破碎3 min。取细胞碎片混悬液,4 ℃、1000×离心10 min,保留上清液,弃去沉淀。取上清液,4 ℃、12 000×离心20 min,弃去上清液,保留细胞膜沉淀。平行制备3份,编号为B1~B3,按试剂盒说明书测定细胞膜蛋白含量及Na+, K+-ATP酶活力。
2.4 HPLC测定方法的建立[17]
2.4.1 色谱条件 C18色谱柱(150 mm×4.6 mm,5 μm);流动相为0.05%甲酸水溶液(A)-乙腈(B),梯度洗脱:0~10 min,5%~20% B;10~15 min,20% B;15~30 min,20%~30% B;30~50 min,30%~50% B;50~60 min,50%~85% B;60~65 min,85%~100% B;柱温为30 ℃;体积流量为1.0 mL/min;检测波长为254 nm;进样量为10 μL。
2.4.2 混合对照品溶液的制备 精密称取芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚对照品适量,分别置于10 mL量瓶中,用适量DMSO溶解,甲醇定容至刻度,即得对照品储备液。依次稀释成质量浓度为1.25、2.50、5.00、10.00、20.00、40.00、80.00、160.00 μg/mL的对照品溶液,0.22 μm滤膜滤过,备用。
2.4.3 供试品溶液的制备 称取大黄粉末(过4号筛)50 g,加入30%乙醇1 L,加热回流提取2次,减压浓缩至稠膏,40 ℃真空干燥。使用时,配制成质量浓度为1 mg/mL溶液。
2.4.4 线性关系的考察 取“2.4.2”项下的混合对照品溶液,按“2.4.1”项下色谱条件测定,以各成分质量浓度为横坐标(),色谱峰峰面积为纵坐标(),绘制标准曲线,得回归方程,结果见表1。
表1 线性关系考察结果
Table 1 Results of linear relationship investigation
成分回归方程线性范围/(μg·mL−1)R2 芦荟大黄素y=20.540 x-10.0931.28~164.000.999 8 大黄酸y=16.252 x+15.0141.25~160.000.999 7 大黄素y=14.679 x-17.7351.28~164.000.999 8 大黄酚y=18.250 x-3.7031.28~162.001.000 0 大黄素甲醚y=7.468 x+24.8131.41~180.000.999 7
2.4.5 方法学考察
(1)精密度试验:取供试品溶液,按“2.4.1”项下色谱条件重复测定6次,计算芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚质量分数的RSD值,结果见表2。
(2)稳定性试验:取供试品溶液,按“2.4.1”项下色谱条件分别在0、2、4、8、12、24 h测定,计算芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚量分数的RSD值,结果见表2。
表2 方法学考察结果
Table 2 Results of methodological investigation
成分RSD/% 精密度稳定性重复性 芦荟大黄素0.961.960.95 大黄酸0.292.910.30 大黄素1.361.361.28 大黄酚2.822.292.72 大黄素甲醚2.632.362.14
(3)重复性试验:精密称取大黄粉末6份,按“2.4.3”项下方法制备供试品溶液,按“2.4.1”项下色谱条件测定,计算芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚量分数RSD值,结果见表2。
由表2可知,方法学考察RSD值均小于3%,表明仪器的精密性良好,供试品溶液在24 h内稳定性良好,方法的重复性良好。
(4)加样回收试验:取已测定大黄粉末9份,精密称定,根据各指标成分质量分数的80%、100%、120%分别加入相应对照品,按“2.4.3”项下方法制备,“2.4.1”项下色谱条件测定,结果显示,芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚平均回收率分别为96.89%、97.29%、95.66%、95.94%、96.07%,RSD值分别为2.83%、1.39%、1.12%、2.17%、2.09%,表明本方法的加样回收率符合规定。
2.5 L02肝细胞膜固相色谱对大黄活性成分吸附、解吸附
2.5.1 共孵育残液的制备 L02肝脂肪变性细胞膜沉淀中加入1 mL大黄30%乙醇提取液,轻轻吹打,涡旋震荡3 min,置于37 ℃恒温水浴摇床孵育6 h。孵育结束后,孵育液于4 ℃、12 000×离心20 min,上清液过0.22 μm滤膜,即得共孵育残液。
2.5.2 洗涤液的制备 L02肝脂肪变性细胞膜沉淀中加入1 mL蒸馏水,轻轻吹打混合均匀,4 ℃、12 000×离心20 min,重复洗涤3次,合并上清液,上清液过0.22 μm滤膜,即得洗涤液。
2.5.3 解离液的制备 L02肝脂肪变性细胞膜沉淀中加入1 mL 30%乙醇,轻轻吹打,涡旋震荡3 min,置于37 ℃恒温水浴摇床孵育4 h。孵育结束后,孵育液于4 ℃、12 000×离心20 min,上清液过0.22 μm滤膜,即得解离液。
按照相同条件重复上述操作,制得6份共孵育残液、解离液。采用“2.4.1”项下色谱条件测定大黄30%乙醇提取液、共孵育残液、洗涤液及解离液。
2.6 大黄调血脂活性成分的体外验证
2.6.1 细胞存活率的测定 将5、10、20 μmol/L的芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚及阿托伐他汀(0.125、0.250、0.500 μmol/L)分别作用于L02肝细胞脂肪变性模型,按“2.2.1”项下方法检测细胞存活率。
2.6.2 细胞内TG、TC含量的测定 将10 μmol/L的芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚及阿托伐他汀(0.50 μmol/L)分别作用于L02肝细胞脂肪变性模型,按“2.2.2”项下方法测定细胞内TG、TC含量。
2.6.3 油红O染色 取处于对数生长期的L02细胞,以2×105/cm2接种于6孔板(已铺玻璃爬片),每孔1 mL,待贴壁后分为正常组、模型组和芦荟大黄素组,正常组加入培养基,模型组和芦荟大黄素组加入0.50 mmol/L油酸,芦荟大黄素组再加入10 μmol/L芦荟大黄素,培养24 h,吸去培养基,PBS洗涤2次,每孔加入1 mL 4%多聚甲醛,固定15 min,加入1 mL油红O工作液,室温避光、密封染色30 min,吸出染液,用10%异丙醇冲洗,每次3~5 s,吸出洗液,加苏木素染液复染1 min(用于染细胞核),纯水洗去蓝色染液,甘油明胶封片。于光镜下观察细胞内橘红色脂滴情况。
3 结果
3.1 L02肝脂肪变性细胞模型的建立
油酸刺激L02肝细胞建立脂肪变性模型,本方法较为简便、快速,常用于脂代谢研究;其原理为饥饿状态的肝细胞对油酸摄入增加,使细胞代谢发生障碍,肝细胞中的脂肪粒沉积加重及TG、TC含量增加。如图1-A所示,与正常组相比,当油酸浓度由0.25、0.50、1.00、1.50 mmol/L逐渐增加,细胞存活率逐渐下降,表明高浓度油酸对细胞有一定毒性;当油酸浓度为0.25、0.50 mmol/L时,细胞存活率大于85%。如图1-B所示,与正常组比较,模型组细胞内TG、TC含量上升,表明肝脂肪变性细胞模型造模成功;当油酸浓度由0.25、0.50、1.00、1.50 mmol/L逐渐增加,细胞中TG、TC含量先增加后减少;TG、TC含量减少原因在于:油酸浓度为1.00、1.50 mmol/L时,造成一定数量细胞死亡,所以其TG、TC含量下降。结合细胞存活率和TG、TC含量,选择0.5 mmol/L油酸为最佳造模浓度。
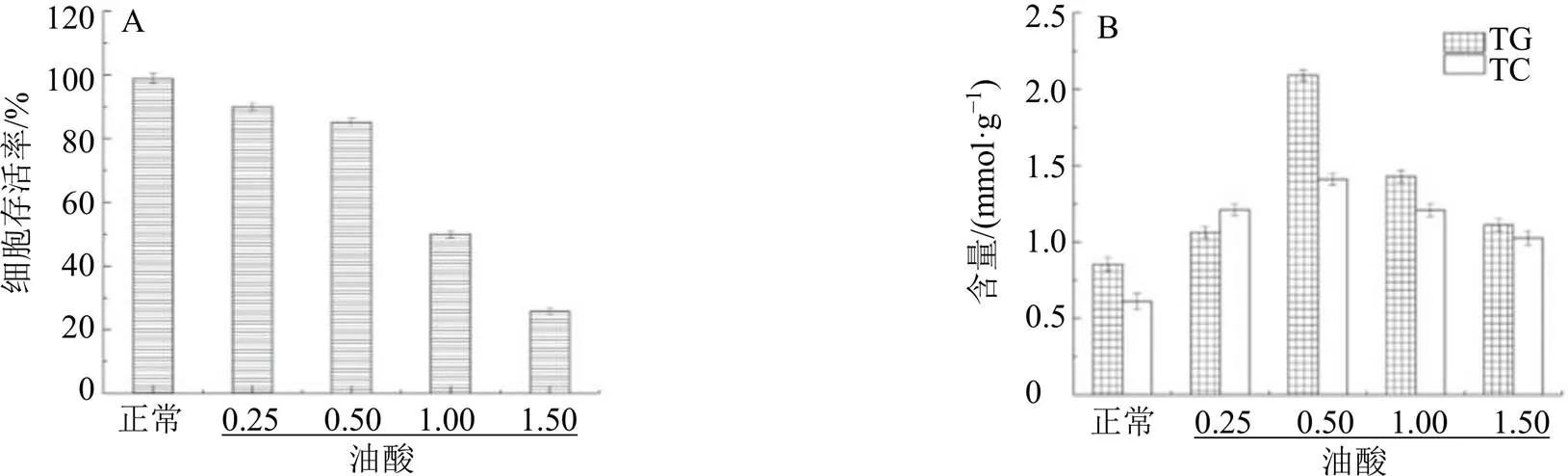
图1 细胞存活率(A) 及TG、TC含量(B)(, n = 6)
3.2 L02肝脂肪变性细胞膜固相色谱评价
对L02肝脂肪变性细胞膜进行膜蛋白含量和Na+, K+-ATP酶活性测定,结果见表3。L02肝脂肪变性细胞膜蛋白质量浓度为0.602 2 mg/mL,Na+, K+- ATP酶活力为11.38 U/mg,表明L02肝脂肪变性细胞膜沉淀具有活力。
表3 细胞膜蛋白含量和Na+, K+-ATP酶活力
Table 3 Membrane protein content of cells and Na+, K+- ATPase activity
编号细胞膜蛋白/(mg·mL−1)Na+, K+-ATP酶/(U·mg−1) B10.598 811.76 B20.602 811.03 B30.607 511.35 平均值0.602 211.38
3.3 HPLC吸附分析
大黄30%乙醇提取液、共孵育残液、混合对照品溶液、洗涤液、解离液色谱图见图2。
由图2-A可知,优化色谱条件下,多数成分色谱峰分离度良好,能够较全面地反映相关化学成分信息;对比大黄30%乙醇提取液和共孵育残液色谱峰的峰面积,部分共孵育残液色谱峰峰面积显著减小,表明部分化学成分被L02肝脂肪变性细胞膜吸附。由图2-B可知,通过混合对照品溶液保留时间(R)及紫外光谱图对比,初步确定7~11号色谱峰分别为芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚,1~6号色谱峰为未知成分。洗涤液中所含化学成分较少,表明活性成分与细胞膜结合牢固,不易洗涤下来。解离液中未检测到色谱峰,推测活性成分通过特定的靶点进入细胞膜内部发挥调血脂作用。
将6份大黄30%乙醇提取液、共孵育残液进样分析,对比其色谱峰峰面积变化,计算色谱峰峰面积RSD值,结果见表4、5。6份大黄30%乙醇提取液、共孵育残液色谱峰峰面积RSD均小于1%,表明在优化色谱条件下,该测定方法稳定可靠。
以大黄30%乙醇提取液和共孵育残液色谱峰峰面积差值大于15%为依据,筛选L02肝脂肪变性细胞膜固相色谱特异性吸附成分,结果见表6。大黄30%乙醇提取液中共有11种成分色谱峰峰面积的变化率大于15%;但由于对照品有限,仅初步确认7~11号色谱峰为蒽醌苷元;5种蒽醌苷元峰面积变化率大于32%,提示其与L02肝脂肪变性细胞膜上的靶点有较好的结合能力。
3.4 大黄调血脂活性体外验证
5种大黄蒽醌苷元作用于L02肝脂肪变性细胞模型,其细胞存活率结果见表7。5种蒽醌苷元浓度大于10 μmol/L时,细胞存活率小于85%,提示蒽醌苷元(20 μmol/L)对细胞具有一定的毒性作用,故选择10 μmol/L蒽醌苷元进行后续调血脂作用的验证。
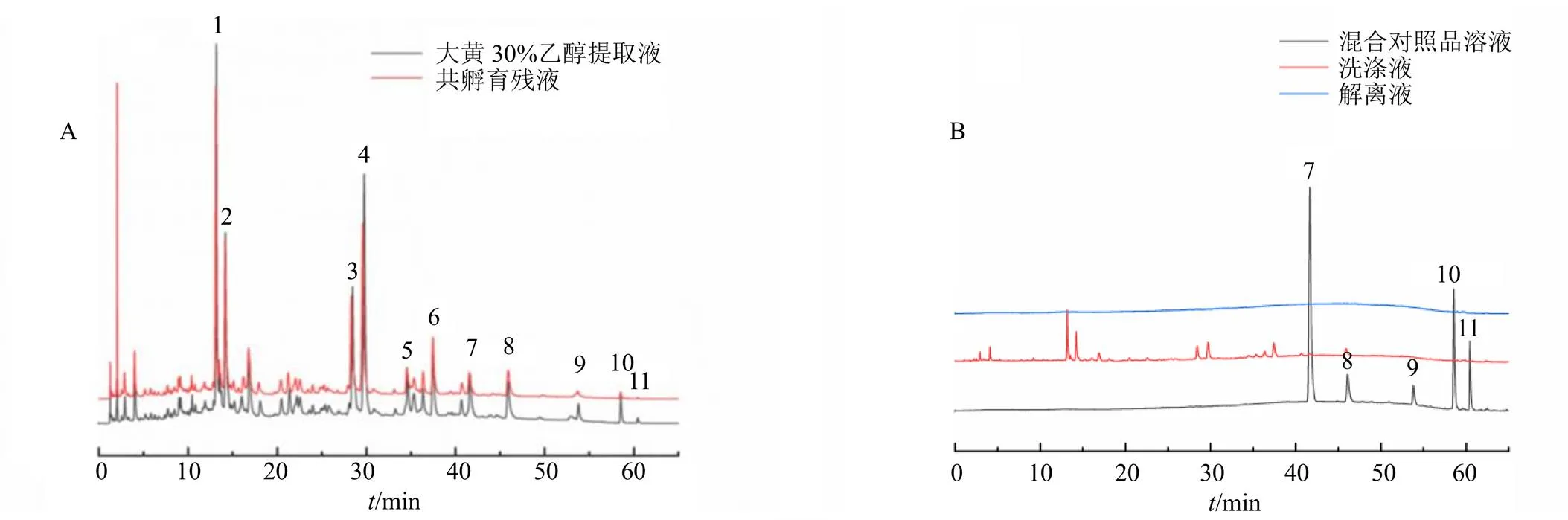
A-大黄30%乙醇提取液和共孵育残液色谱图 B-混合对照品溶液、洗涤液和解离液色谱图 1~6-未知成分 7-芦荟大黄素 8-大黄酸 9-大黄素 10-大黄酚 11-大黄素甲醚
表4 大黄30%乙醇提取液色谱峰峰面积变化(n = 6)
Table 4 Peak area change of 30% ethanol extract of Rhei Radix et Rhizoma(n = 6)
峰号tR/min峰面积 S1S2S3S4S5S6RSD/% 113.125 018 8445 067 7625 081 8235 089 8215 095 3905 054 8290.56 214.243 825 3553 864 7903 824 6733 833 5833 881 6163 840 6460.60 328.373 367 1053 393 1223 378 3893 392 5973 381 5763 337 6870.61 429.675 979 1256 031 8965 985 2896 017 7126 055 6886 080 5670.65 534.58765 629755 313767 195752 116754 214766 8990.93 637.631 673 7151 672 6811 695 7631 665 9971 662 2081 699 2160.93 741.611 216 3401 215 0021 215 9361 218 8441 203 9491 219 2260.46 846.091 210 1981 216 8731 227 3011 208 4881 220 3311 215 5720.57 953.79401 388407 512409 669405 375402 895405 2140.74 1058.55435 529441 594439 307446 090443 376440 8550.82 1160.4483 01082 30181 18482 36881 87681 3830.83
表5 共孵育残液色谱峰峰面积变化(n = 6)
Table 5 Peak area change of co-incubation residual solution (n = 6)
峰号tR/min峰面积 S1S2S3S4S5S6RSD/% 113.124 061 5794 057 8754 046 6554 034 5594 030 3684 053 9830.31 214.243 073 8623 070 5703 062 3343 057 7763 049 2133 075 4000.33 328.372 506 7052 491 1932 492 2752 479 5342 471 9412 467 9560.58 429.674 219 6154 206 1134 202 2614 196 5194 180 7554 175 8490.39 534.58558 850557 234555 456552 487552 043550 5370.59 637.631 377 2571 373 9351 369 2211 363 6511 359 6571 356 7850.59 741.61548 516546 598544 134544 273540 734540 6560.57 846.09838 137833 508830 540829 140823 955825 3800.63 953.7978 01978 39477 93278 93578 30078 0410.47 1058.55114 621114 865114 499116 250115 118114 6800.56 1160.4410 71910 85610 83710 78410 79510 6000.87
表6 L02肝脂肪变性细胞膜固相色谱吸附差异结果
Table 6 Results of adsorption difference of L02 hepatic steatosis membrane solid phase chromatography
峰号tR/min30%乙醇提取液色谱峰峰面积共孵育残液色谱峰峰面积峰面积变化/%成分 113.125 081 8234 057 87520.15未知 214.243 824 6733 070 57019.72未知 328.373 378 3892 491 19326.26未知 429.675 985 2894 206 11329.73未知 534.58767 195557 23427.37未知 637.631 695 7631 373 93518.98未知 741.611 215 936546 59855.05芦荟大黄素 846.091 227 301833 50832.09大黄酸 953.79409 66978 39480.86大黄素 1058.55439 307114 86573.85大黄酚 1160.4481 18410 85686.63大黄素甲醚
表7 大黄蒽醌苷元对L02肝脂肪变性细胞存活率的影响(n = 6)
Table 7 Effect of anthraquinone aglycone on survival rate of L02 hepatic steatosis cells (n = 6)
组别浓度/(μmol·L−1)细胞存活率/%组别浓度/(μmol·L−1)细胞存活率/% 芦荟大黄素590.2大黄酚591.5 1088.7 1089.3 2081.5 2081.0 大黄酸593.1大黄素甲醚591.8 1088.6 1088.6 2079.3 2080.4 大黄素595.4阿托伐他汀0.12592.5 1087.8 0.25090.7 2075.6 0.50090.1
将5种蒽醌苷元(10 μmol/L)和阿托伐他汀(0.5 μmol/L)作用于L02肝脂肪变性细胞模型,TG、TC含量测定结果见图3。与正常组比较,模型组细胞内TG、TC含量显著升高(<0.01),表明油酸诱导造模成功;与模型组比较,各给药组细胞内TG、TC含量均显著降低(<0.01),表明5种蒽醌苷元可以通过降低TG、TC含量而达到调血脂作用,其中大黄素甲醚下调TG效果最强,而芦荟大黄素下调TC效果最强。
油红O/苏木素染色L02肝脂肪变性细胞,细胞内脂肪滴情况见图4。油红O染色后,正常组细胞中蓝色为细胞核,细胞核周围无红色脂肪粒。模型组细胞形态不规则,细胞出现肿胀变大,部分细胞膜不完整和破损;细胞核周围有大量红色脂肪粒。芦荟大黄素作用于L02细胞肝脂肪变性模型,细胞核周围的脂肪粒明显减少,细胞形态有所改善,表明蒽醌苷元通过清除肝细胞脂质堆积,改善肝脏内脂质代谢,并保护肝细胞功能达到调血脂作用。

A-正常组 B-模型组 C-芦荟大黄素组 D-大黄酸组 E-大黄素组 F-大黄酚组 G-大黄素甲醚组 H-阿托伐他汀组 与正常组比较:##P<0.01;与模型组比较:**P<0.01
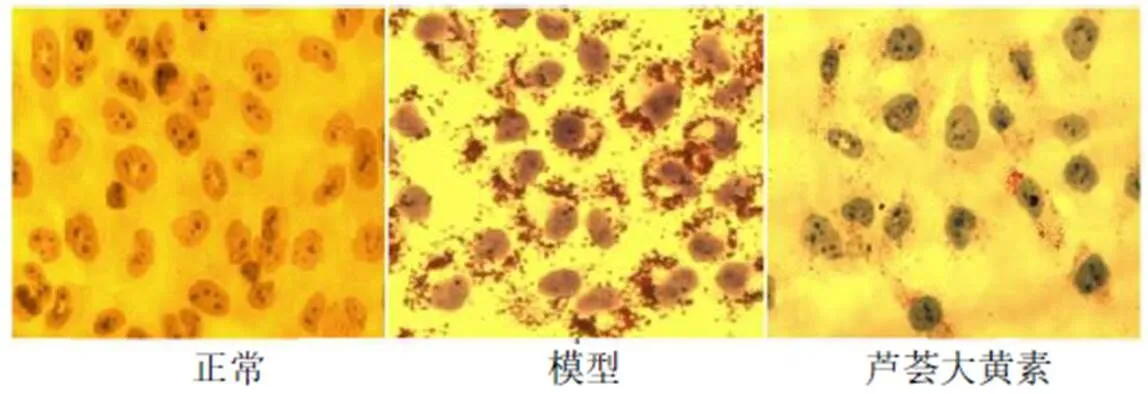
图4 油红O染色图片 (×400)
4 讨论
本研究构建L02肝脂肪变性细胞膜固相色谱耦合脂肪变性模型,利用L02肝脂肪变性细胞膜表面靶点选择性吸附大黄调血脂活性成分,以吸附前后化学成分色谱峰峰面积变化率大于15%为依据,从大黄30%乙醇提取液中共筛选出11种活性成分;将5种大黄蒽醌苷元作用于L02肝脂肪变性细胞模型,发现芦荟大黄素等蒽醌苷元能够显著降低L02肝脂肪变性细胞中TG、TC含量,并可显著减少细胞核周围的脂肪粒。本模型具有快速、方便的优势,可用于大黄调血脂活性成分的快速筛选,也可适用于其他中药调血脂活性成分的快速筛选及活性成分群关系的研究。
本方法将活性细胞膜作为固定相,具有细胞膜完整、膜受体立体结构、周围环境和靶点得以保持的优势,能够排除大量非作用杂质成分的干扰,是中药效应成分的有效筛选手段;但同时也存在细胞膜吸附1~2次后,细胞膜活性显著降低,使用寿命短及吸附成分不一定是入血成分等缺陷。
利益冲突 所有作者均声明不存在利益冲突
[1] 王亦君, 冯舒涵, 程锦堂, 等. 大黄蒽醌类化学成分和药理作用研究进展 [J]. 中国实验方剂学杂志, 2018, 24(13): 227-234.
[2] 张桥, 陈艳琰, 乐世俊, 等. 大黄炮制的历史沿革及对化学成分、传统药理作用影响的研究进展 [J]. 中国中药杂志, 2021, 46(3): 539-551.
[3] 金丽霞, 金丽军, 栾仲秋, 等. 大黄的化学成分和药理研究进展 [J]. 中医药信息, 2020, 37(1): 121-126.
[4] 王志旺, 郭玫, 马丹, 等. 不同产地大黄对高脂血症大鼠血脂及抗氧化作用的影响 [J]. 中国应用生理学杂志, 2015, 31(3): 278-281.
[5] 王成, 代旭阳, 龚莉虹, 等. 大黄素对高脂血症斑马鱼脂质代谢的作用研究 [J]. 天然产物研究与开发, 2019, 31(11): 1873-1879.
[6] 朱慧, 刘晓, 祝婷婷, 等. 熟大黄水煎液中化学成分含量测定及其药效学研究 [J]. 南京中医药大学学报, 2017, 33(5): 470-475.
[7] 顾家珲. 大黄治疗便秘、降血脂的有效物质研究[D]. 兰州: 甘肃中医学院, 2013.
[8] 朱荃. 细胞膜固相色谱及其在中药效应-物质基础研究中的应用 [J]. 南京中医药大学学报, 2006, 22(1): 8-10.
[9] 王晓宇, 陈啸飞, 顾妍秋, 等. 细胞膜色谱研究进展及其在中药活性成分筛选中的应用 [J]. 分析化学, 2018, 46(11): 1695-1702.
[10] 毕肖林, 马世堂, 狄留庆, 等. 中药药效物质筛选与辨识的研究思路及进展 [J]. 中草药, 2018, 49(22): 5229-5234.
[11] 焦姣姣, 杨园珍, 袁恩, 等. UPLC-Q-TOF-MS筛选穿心莲中亲和Caco-2细胞的活性成分 [J]. 中草药, 2018, 49(12): 2946-2952.
[12] 汤丹, 肖伟, 钱正明, 等. 活细胞固相色谱法联合高分辨质谱快速筛选龙血竭中镇痛活性成分 [J]. 中草药, 2019, 50(11): 2539-2544.
[13] 王成, 胡乃华, 余琳媛, 等. 降脂模型研究进展 [J]. 中国比较医学杂志, 2020, 30(4): 121-130.
[14] 吴灿, 许平翠, 姚伟宣, 等. 成骨细胞膜色谱/超高效液相色谱-飞行时间质谱法快速筛选六味地黄汤抗骨质疏松活性成分 [J]. 色谱, 2019, 37(3): 305-312.
[15] 樊宏伟, 朱荃, 洪敏, 等. 血小板细胞膜固相色谱法在脉络宁注射液效应物质分析中的应用 [J]. 中国药学杂志, 2006, 41(1): 63-66.
[16] 马晓伟, 于蒙蒙, 晋兴华, 等. 人参次苷H滴丸原料药中皂苷含量测定及细胞膜色谱技术对效应成分筛选 [J]. 中草药, 2018, 49(11): 2545-2550.
[17] 谭鹏, 张海珠, 张青, 等. UPLC法同时测定大黄中10个蒽醌衍生物的含量 [J]. 中草药, 2018, 49(4): 928-934.
Rapid screening of active components frometfor hypolipidemia by L02 hepatic steatosis cell membrane
WU Xiao-yu1, 2, 3,DUAN Wen-da1, XIA Peng-fei1, 2, 3, WANG Yu-xia1, BIAN Hui-qin1,ZHAO Lei1, 2, 3
1. Gansu University of Chinese Medicine, Lanzhou 730000, China 2. Key Laboratory of Chemistry and Quality for Traditional Chinese Medicine of Colleges of Gansu Province, Lanzhou 730000, China 3. Gansu Province Engineering Laboratory for Traditional Chinese Medicine Standardization Technology and Popularization, Lanzhou 730000, China
To rapid screening the active components from Dahuang (et) for hypolipidemia through L02 liver steatosis cell membrane solid phase chromatography coupled with steatosis model.The active compounds of 30% ethanol extracts frometwere combined with L02 cell membrane solid phase chromatography. The solution was detected before and after treating with L02 cell membrane by HPLC. The active compounds from 30% ethanol extracts ofetwere identified based on retention time and ultraviolet spectrum information of each chemical composition. The selected active ingredients were further applied to L02 hepatic steatosis cell model to verify the effect of hypolipidemia.A total of 11 compounds were detected from 30% ethanol extract ofet, and identified as aloe emodin, rhein, rheum emodin, chrysophanol, physcion and six unknown ingredients. Aloe emodin and other anthraquinone aglycones significantly reduced the contents of triglyceride (TG) and total cholesterol (TC) in L02 hepatic steatosis cell (< 0.01), and reduced the lipid granules in L02 hepatic steatosis cell.The established L02 liver steatosis cell membrane solid phase chromatography coupled with steatosis model can be used for rapid screening of active components in the complex system of traditional Chinese medicine, as well as to lay the foundation for further study of the active components in hypolipidemia ofet.
et; L02 hepatic steatosis cells; cell membrane solid phase chromatography; active components; aloe emodin; rhein; rheum emodin; chrysophanol; physcion
R285.5
A
0253 - 2670(2022)03 - 0735 - 08
10.7501/j.issn.0253-2670.2022.03.012
2021-09-30
国家自然科学基金资助项目(82160457);甘肃省教育厅:青年博士基金项目(2021QB-079);甘肃中医药大学引进人才科研启动基金(2018YJRC-02);甘肃中医药大学科研发展基金项目(81660577)
武晓玉(1983—),女,副教授,从事中药药效物质基础研究。E-mail: wxypzw@163.com
赵 磊,女,教授,博士生导师,从事中药药效物质基础及质量控制研究。Tel: (0931)8762539 E-mail: zzyhx@gszy.edu.cn
[责任编辑 李亚楠]

