基于Wnt信号通路研究表没食子酸儿茶素没食子酸酯对肝星状细胞活化的作用及机制
石明亮,王晓磊,李江琳,段文飞
基于Wnt信号通路研究表没食子酸儿茶素没食子酸酯对肝星状细胞活化的作用及机制
石明亮,王晓磊,李江琳,段文飞
河南大学第一附属医院 普外一科,河南 开封 475000
基于Wnt信号通路探究表没食子酸儿茶素没食子酸酯(epigallocatechin gallate,EGCG)对人肝星状细胞LX-2活化的影响及其作用机制。体外培养LX-2细胞,CCK-8法筛选EGCG的实验浓度;取对数生长期的LX-2细胞,设置对照组(正常培养)、模型组[10 ng/mL 转化生长因子-β1(transforming growth factor-β1,TGF-β1)]、EGCG低剂量组(12.5 μmol/L EGCG+10 ng/mL TGF-β1)、EGCG高剂量组(25.0 μmol/L EGCG+10 ng/mL TGF-β1)、EGCG+siRNA-NC组[小窝蛋白-1(Caveolin-1,)-siRNA阴性对照+25.0 μmol/L EGCG+TGF-β1]和EGCG+-siRNA组(-siRNA+25.0 μmol/L EGCG+TGF-β1),CCK-8法检测各组细胞存活率;流式细胞术检测细胞凋亡率和细胞周期分布情况;吖啶橙/溴乙锭(AO/EB)染色法观察细胞凋亡形态;qRT-PCR法检测细胞α-平滑肌肌动蛋白(α-smooth muscle actin,)、I型胶原蛋白()和基质金属蛋白酶组织抑制剂-1(tissue inhibitors of matrix metalloproteinase-1,)mRNA表达情况;Western blotting检测细胞Cav-1和Wnt信号通路相关蛋白表达情况。EGCG降低LX-2细胞存活率,呈剂量相关性。与对照组相比,模型组LX-2细胞存活率、S期和G2/M期的细胞比例、细胞、、mRNA表达和Wnt1、Wnt5a、β-连环蛋白(β-catenin)、细胞周期蛋白Cyclin D1、原癌基因c-Myc蛋白表达水平均显著升高(<0.05),细胞凋亡率、G0/G1期的细胞比例、凋亡细胞比例、Cav-1蛋白表达水平均显著降低(<0.05);与模型组相比,EGCG低、高剂量组LX-2细胞存活率、S期和G2/M期的细胞比例、细胞‐、、mRNA表达和Wnt1、Wnt5a、β-catenin、Cyclin D1、c-Myc蛋白表达水平均显著降低(<0.05),细胞凋亡率、G0/G1期的细胞比例、凋亡细胞比例、Cav-1蛋白表达水平均显著升高(<0.05);且在EGCG干预的基础上,沉默的表达可显著上调Wnt1、Wnt5a蛋白表达,减弱EGCG对Wnt信号通路的抑制作用。EGCG可能通过上调Cav-1表达,抑制Wnt信号通路激活,进而抑制LX-2细胞活化。
表没食子酸儿茶素没食子酸酯;肝星状细胞;凋亡;Wnt信号通路;小窝蛋白-1
肝纤维化(liver fibrosis,LF)是肝损伤的组织学标志,其特征是细胞外基质(extracellular matrix,ECM)过度沉积,可发展为肝硬化、肝癌和(或)肝功能衰竭[1]。肝星状细胞(hepatic stellate cells,HSC)是LF的主要来源[2]。在生理条件下,HSC保持静止;当肝细胞受损时,受损的细胞和免疫细胞会释放出炎性细胞因子和趋化因子,包括肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和转化生长因子-β1(transforming growth factor-β1,TGF-β1),TGF-β1激活HSC,导致大量ECM的合成和分泌,启动纤维化发生[3-4]。目前治疗方法主要集中在抑制HSC活化和(或)促进ECM降解。许多药物治疗效果有限,并且可能加剧肝损伤[5]。因此,迫切需要延迟或预防LF进展的新策略。
LF属于中医“肋痛”“积聚”范畴,病因病机复杂,多因外感毒邪、痰瘀阻络、湿热蕴结所致。中医药因其辨证论治和多渠道、多层次、多靶点的综合药理作用,在治疗LF方面具有独特的优势。目前,中医药抗LF的机制主要包括抑制HSC的激活、抑制ECM合成、抗氧化、抑制炎症等。儿茶素是一类植物多酚,存在于食品和药用植物中,在体内外均具有抗氧化、抗炎和抗增殖的作用,表没食子酸儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是儿茶素的主要成分,具有广泛的生物学特性,包括抗纤维化活性[6]。研究发现,EGCG可抑制大鼠HSC中I型胶原(Collagen I)的生成和胶原酶的活性[7],还可通过诱导细胞凋亡,抑制人HSC株LX-2细胞的增殖和活化[8],表明EGCG可能具有治疗LF的潜力,但其作用机制尚不明确。
Wnt途径是细胞生长和增殖的重要调节剂,对正常的肝脏发育非常重要。研究表明,该途径与HSC的活化和LF密切相关[9]。小窝蛋白-1(Caveolin-1,Cav-1)是质膜小窝的主要成分,负调控许多细胞信号事件,包括经典的Wnt信号[10]。Cav-1在纤维化肝组织和激活的HSC中呈低表达,且在活化的HSC中,沉默可上调纤维化基因如平滑肌肌动蛋白α2(smooth muscle actin α2,ACTα2)和Collagen I表达,并伴有抗纤维化基因基质金属蛋白酶组织抑制剂-1(tissue inhibitors of matrix metalloproteinase-1,TIMP-1)的增加,表明Cav-1在HSC活化和胶原蛋白的产生中起着至关重要的作用[11]。EGCG能刺激Cav-1位移,用Cav-1特异性siRNA转染细胞沉默,可显著降低细胞对EGCG的摄取[12];在H2O2诱导的H9c2细胞损伤中,Cav-1的激活参与EGCG介导的心脏保护;表明Cav-1在EGCG的摄取和运输以及机制中发挥作用[13]。EGCG能否通过影响Cav-1的表达介导HSC活化还未可知,因此本研究初步探究EGCG对LX-2细胞活化的影响及其作用机制,以期为LF的诊断和治疗提供实验依据。
1 材料
1.1 细胞
LX-2细胞购自武汉普诺赛生命科技有限公司。
1.2 药品与试剂
EGCG(质量分数为95%,批号200-659-6)购自美国Sigma-Aldrich公司;Lipofectamine 3000转染试剂(批号L3000-015)购自美国Invitrogen公司;重组人TGF-β1蛋白(批号TG1-H4212)购自北京百普赛斯生物科技股份有限公司;胎牛血清、DMEM培养基、胰蛋白酶均购自美国Gbico公司,批号分别为10099141C、1676916、25300-054;- siRNA及其阴性对照(siRNA-NC)、qRT-PCR引物均由上海GenePharma合成;CCK-8试剂盒、细胞周期与细胞凋亡检测试剂盒、RIPA裂解液和BCA试剂盒购自碧云天生物科技公司,批号分别为20200908、20201027、20201003、20201019;TRIzol试剂、PrimeScript™ RT试剂盒、SYBR®Premix Ex Taq™ II试剂盒购自日本Takara公司,批号分别为AI80436A、AJ60593、AJ91432A;Cav-1小鼠源抗体(批号GR435324-11)、Wnt1兔源抗体(批号GR312453-6)、Wnt5a兔源抗体(批号GR326874-5)、β-连环蛋白(β-catenin)兔源抗体(批号GR415239-13)、细胞周期蛋白Cyclin D1兔源抗体(批号GR345242-4)、原癌基因c-Myc兔源抗体(批号GR298716-12)、β-actin兔源抗体(批号GR25827)、HRP标记的山羊抗小鼠IgG抗体(批号GR31635)、HRP标记的山羊抗兔IgG抗体(批号GR32354)购自英国Abcam公司。
1.3 仪器
细胞培养箱、NanoDrop 2000分光光度计(美国Thermo Fisher Scientific公司);ABI Prism®7300型qRT-PCR仪(美国ABI公司);BD FACSCanto II流式细胞仪(美国BD公司);IX73型倒置荧光显微镜(日本Olympus公司);iMark680型多功能酶标仪、蛋白转膜装置(美国Bio-Rad公司)。
2 方法
2.1 细胞培养
LX-2细胞用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基,于37 ℃、5% CO2细胞培养箱中培养,每2天换液1次,3~4 d传代1次,待细胞处于对数生长期进行实验。
2.2 CCK-8法筛选EGCG的实验浓度
取对数生长期的LX-2细胞,胰蛋白酶消化后以1×103/孔接种到96孔板中。待细胞贴壁后,弃去原培养基,分别加入终浓度为0、12.5、25.0、50.0、100.0、200.0 μmol/L的含EGCG的培养基,于培养箱中培养24 h,然后再换成含TGF-β1(终质量浓度为10 ng/mL)的DMEM培养基,继续培养48 h,最后每孔中加入10 µL的CCK-8溶液,于培养箱中继续孵育2 h,测定450 nm处各孔吸光度()值,以培养基为空白孔调零,计算细胞存活率。
细胞存活率=(实验-空白)/(对照-空白)
2.3 实验分组和处理
取对数生长期的LX-2细胞,胰蛋白酶消化后制成单细胞混悬液,以2×105/孔接种到24孔板中,设置对照组(正常培养的LX-2细胞)、模型组(TGF-β1诱导LX-2细胞)、EGCG低剂量组(LX-2细胞用浓度为12.5 μmol/L的EGCG处理12 h后再进行TGF-β1诱导)、EGCG高剂量组(LX-2细胞用浓度为25.0 μmol/L的EGCG处理12 h后再进行TGF-β1诱导)及EGCG+siRNA-NC组(- siRNA阴性对照转染LX-2细胞48 h,然后用浓度为25.0 μmol/L的EGCG处理12 h后再进行TGF-β1诱导)和EGCG+-siRNA组(-siRNA转染LX-2细胞48 h,浓度为25.0 μmol/L的EGCG处理LX-2细胞12 h后再进行TGF-β1诱导)。TGF-β1诱导后继续培养48 h,然后收集细胞。
2.4 CCK-8法检测各组细胞存活率
取对数生长期的LX-2细胞,胰蛋白酶消化后制备成单细胞悬液,以1×103/孔接种到96孔板中,将细胞按照“2.3”项下方法进行分组及处理,培养48 h后,根据“2.2”项下方法测定各孔值,计算细胞存活率。
2.5 流式细胞术检测各组细胞凋亡
LX-2细胞以2×105/孔接种至6孔板中,按照“2.3”项下方法进行分组及处理,培养48 h后,将各组细胞用胰蛋白酶消化,PBS溶液洗涤后将其悬浮在400 µL 1×Annexin结合溶液中。取100 μL细胞悬浮液,将5 µL Annexin V-FITC染色溶液添加到悬浮液中,孵育15 min;加入5 μL碘化丙啶(PI),于4 ℃避光孵育5 min,采用流式细胞仪检测各组细胞凋亡率。
2.6 吖啶橙/溴乙锭(AO/EB)染色法观察细胞凋亡形态
取对数生长期的LX-2细胞,按照“2.3”项下方法进行分组及处理,培养48 h后,弃去上清液,用PBS溶液洗涤细胞2次,胰蛋白酶消化并重悬细胞,取25 μL悬浮液至载玻片上,将AO(100 μg/mL)和EB(100 μg/mL)按1∶1预混合,并将所得溶液添加到载玻片上,避光放置5 min,于荧光显微镜下观察凋亡细胞形态并拍照,使用Image J软件处理照片并计数。正常细胞的细胞核呈强绿色荧光,圆形细胞核均匀分布于细胞中心;早期凋亡细胞的细胞核呈黄绿色荧光,集中分布于细胞一侧,呈新月形或圆珠状;晚期凋亡细胞的细胞核呈橙色荧光,集中聚集,偏向定位;坏死细胞的体积增加,呈不均匀的橙红色荧光,轮廓不明显,正在溶解或接近崩解。
2.7 流式细胞术检测各组细胞周期分布
按“2.3”项下方法进行分组并处理细胞,通过离心收集TGF-β1处理后培养48 h的各组细胞,于4 ℃用冷乙醇固定过夜,然后离心并洗涤;再将细胞在37 ℃下于500 μL冷PBS溶液(含20 μL RNase A)中悬浮30 min,用400目网筛滤过后,将细胞重悬于400 µL PI中,并于4 ℃避光孵育30 min,采用流式细胞仪分析细胞周期分布情况。
2.8 qRT-PCR检测细胞中α‐SMA、Collagen I和TIMP-1 mRNA的表达
按“2.3”项下方法进行分组并处理细胞,按照试剂盒说明书提取细胞总RNA并合成cDNA,进行qRT-PCR分析,引物序列见表1。
表1 引物序列
Table 1 Primer sequences
引物序列 (5’-3’)产物大小/bp α‐SMAF: ATCAAGGAGAAACTGTGTTATGTAGR: GATGAAGGATGGCTGGAACAGGGTC182 Collagen IF: TCTAGACATGTTCAGCTTTGTGGAC149 R: TCTGTACGCAGGTGATTGGTG TIMP-1F: CTTCTGCAATTCCGACCTCGT142 R: ACGCTGGTATAAGGTGGTCTG β-actinF: GCCAACACAGTGCTGTCTGG145 R: CTCAGGAGGAGCAATGATCTTG
2.9 Western blotting检测细胞中Cav-1和Wnt信号通路相关蛋白的表达
按“2.3”项下方法进行分组并处理细胞,使用RIPA裂解液提取蛋白,用BCA试剂盒测定上清液中的总蛋白质量浓度。取等量蛋白样品与SDS样品缓冲液混合,加热至95 ℃ 10 min变性,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5%脱脂牛奶中封闭,分别加入Cav-1、Wnt1、Wnt5a、β-catenin、Cyclin D1、c-Myc和β-actin抗体(1∶1000),于4 ℃孵育过夜;洗涤后加入HRP标记的山羊抗小鼠/兔IgG抗体(1∶2000),室温孵育2 h,加入ECL发光试剂显色,以β-actin为内参蛋白,分析结果。
2.10 统计学分析
以上所有实验均重复3次。使用SPSS 22.0和Image-Pro Plus软件对实验数据进行分析,结果以表示,两组间比较采用检验,多组间比较采用单因素方差分析(One-way ANOVA),组间有差异进一步两两比较采用SNK-检验。
3 结果
3.1 EGCG对LX-2细胞存活率的影响
为确定EGCG对LX-2细胞的细胞毒性,使用不同剂量的EGCG处理后,发现低浓度(12.5、25.0 μmol/L)的EGCG对LX-2细胞存活率未出现明显影响,而当EGCG浓度≥50.0 μmol/L时可显著降低LX-2细胞存活率(<0.05),其半数抑制浓度(half inhibitory concentration,IC50)值为127.61 μmol/L(表2)。故选择浓度为12.5、25.0 μmol/L的EGCG用于后续实验。
表2 EGCG对LX-2细胞存活率的影响(, n = 3)
Table 2 Effect of EGCG on survival rate of LX-2 cells (, n = 3)
组别剂量/(μmol·L−1)细胞存活率/% 对照—100.00±0.00 EGCG12.595.49±10.17 25.086.82±9.05 50.065.45±6.63* 100.051.71±7.58* 200.040.21±6.11*
与对照组比较:*<0.05
*< 0.05control group
3.2 各组LX-2细胞存活率与凋亡率
如图1和表3所示,与对照组相比,模型组LX-2细胞存活率显著升高,凋亡率显著降低(<0.05);与模型组相比,EGCG低、高剂量组细胞存活率显著降低,凋亡率显著升高(<0.05);与EGCG高剂量组相比,EGCG+-siRNA组细胞存活率显著升高,凋亡率显著降低(<0.05)。

图1 流式细胞术检测各组LX-2细胞凋亡情况
表3 各组LX-2细胞存活率与凋亡率(, n = 3)
Table 3 Survival rate and apoptosis rate of LX-2 cells in each group(, n = 3)
组别剂量/(μmol·L−1)细胞存活率/%细胞凋亡率/% 对照—100.00±0.008.67±1.05 模型—124.37±14.56*3.49±0.41* EGCG12.592.65±10.74#10.26±1.68*# 25.081.24±9.86*#14.50±1.72*# EGCG+siRNA-NC25.083.07±9.05*#13.81±1.56*# EGCG+Cav-1-siRNA25.0105.43±11.23#&9.46±1.29#&
与对照组比较:*<0.05;与模型组比较:#<0.05;与EGCG高剂量组比较:&<0.05
*< 0.05control group;#< 0.05model group;&< 0.05high-dose EGCG group
3.3 各组LX-2细胞周期分布
如图2、3所示,与对照组相比,模型组LX-2细胞在G0/G1期的比例显著减少,S期和G2/M期的细胞比例显著增加(<0.05);与模型组相比,EGCG低、高剂量组细胞在G0/G1期的比例显著增加,S期和G2/M期的细胞比例显著减少(<0.05);与EGCG高剂量组相比,EGCG+-siRNA组细胞在G0/G1期的比例显著减少,S期的细胞比例显著增加(<0.05)。
3.4 各组LX-2细胞凋亡形态
如图4、5所示,与对照组相比,模型组LX-2细胞生长密度增加,未见明显呈黄绿色和橙色荧光的凋亡细胞,凋亡细胞比例显著降低(<0.05);与模型组相比,EGCG低、高剂量组细胞生长密度降低,呈黄绿色和橙色荧光的凋亡细胞增多,凋亡细胞比例显著增加(<0.05);与EGCG高剂量组相比,EGCG+-siRNA组细胞生长密度增加,凋亡细胞比例显著降低(<0.05)。
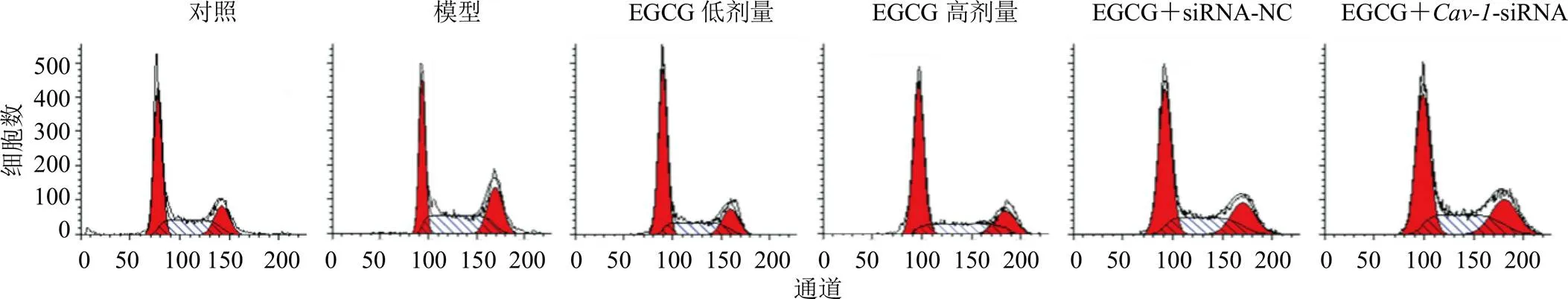
图2 流式细胞术分析各组LX-2细胞周期分布情况
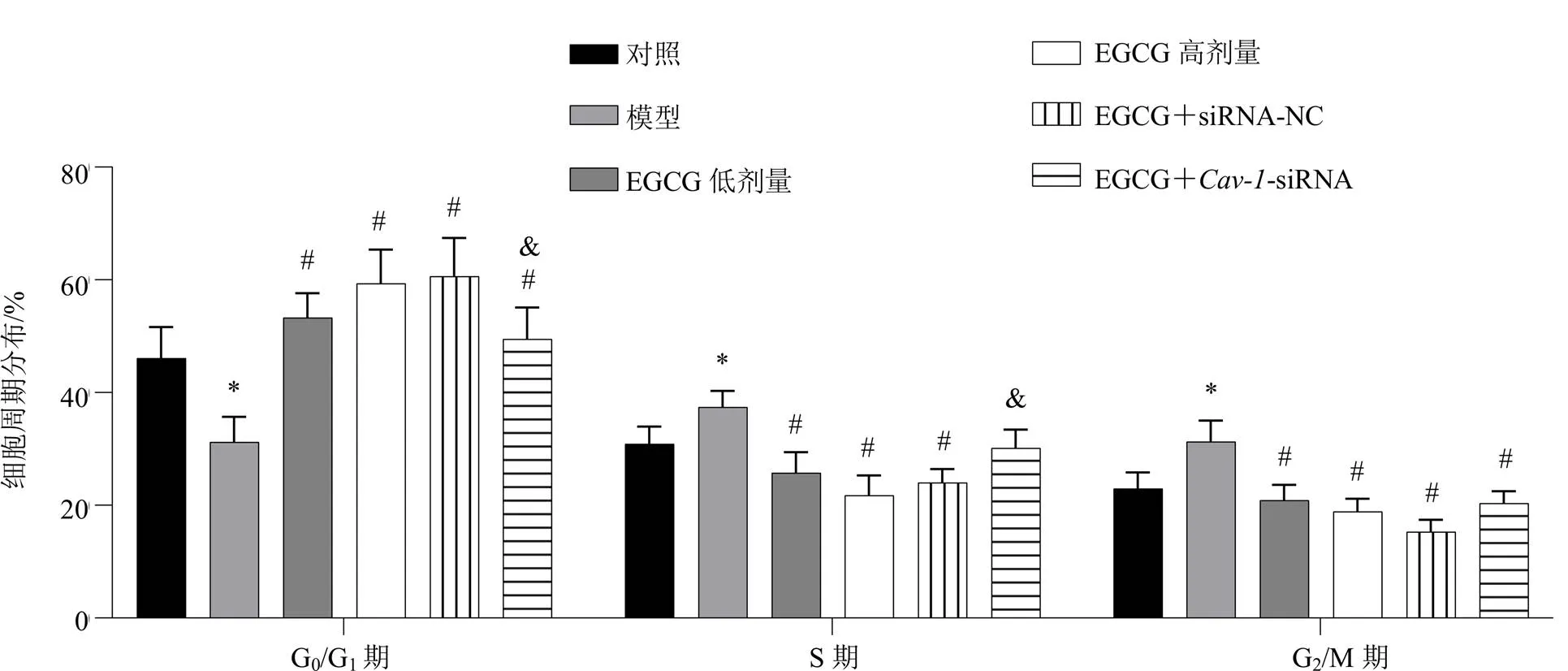
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与EGCG高剂量组比较:&P<0.05,下图同
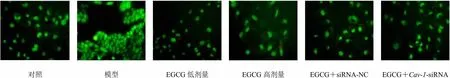
对照模型EGCG低剂量EGCG高剂量EGCG+siRNA-NCEGCG+Cav-1-siRNA
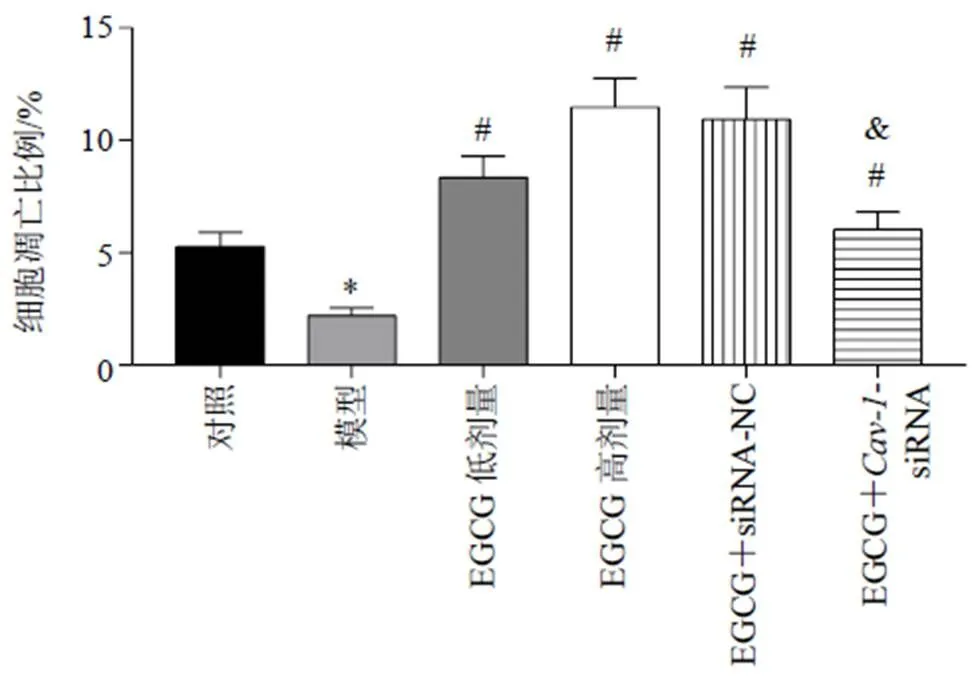
图5 各组LX-2细胞凋亡比例(, n = 3)
3.5 各组LX-2细胞α‐SMA、Collagen I和TIMP-1 mRNA的表达
如图6所示,与对照组相比,模型组LX-2细胞、和mRNA表达水平显著升高(<0.05);与模型组相比,EGCG低、高剂量组细胞、和mRNA表达水平显著降低(<0.05);与EGCG高剂量组相比,EGCG+-siRNA组细胞、和mRNA表达水平显著升高(<0.05)。
3.6 各组LX-2细胞Cav-1、Wnt1、Wnt5a、β-catenin、Cyclin D1和c-Myc蛋白表达
如图7所示,与对照组相比,模型组LX-2细胞Cav-1蛋白表达水平显著降低,Wnt1、Wnt5a、β-catenin、Cyclin D1和c-Myc蛋白表达水平显著升高(<0.05);与模型组相比,EGCG低、高剂量组细胞Cav-1蛋白表达水平显著升高,Wnt1、Wnt5a、β-catenin、Cyclin D1和c-Myc蛋白表达水平显著降低(<0.05);与EGCG高剂量组相比,EGCG+-siRNA组细胞Cav-1蛋白表达水平显著降低,Wnt1、Wnt5a、β-catenin、Cyclin D1、c-Myc蛋白表达水平显著升高(<0.05)。
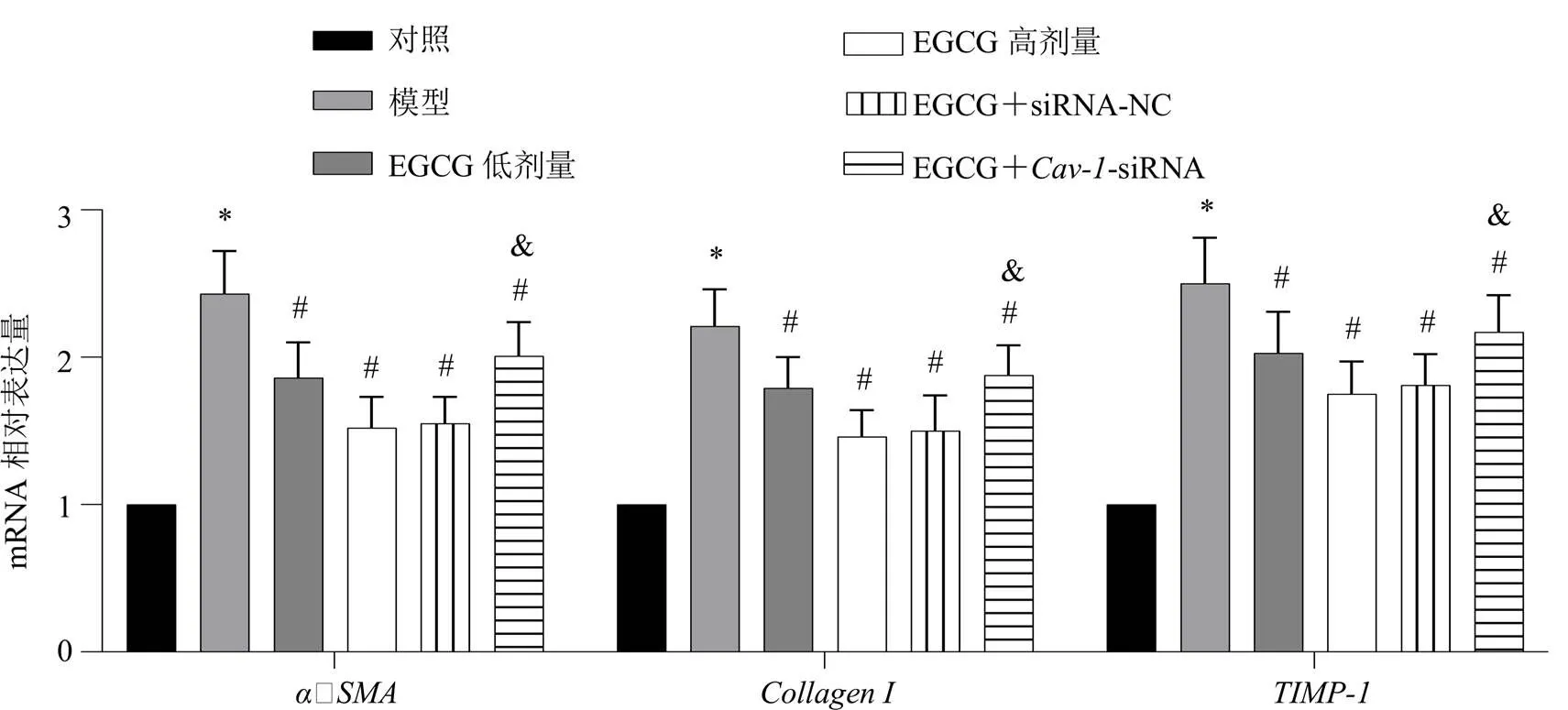
图6 各组LX-2细胞α‐SMA、Collagen I和TIMP-1 mRNA表达情况(, n = 3)
4 讨论
HSC是LF的主要靶标,HSC可以通过病毒感染、非酒精性脂肪肝、酒精性脂肪性肝炎、药物毒素以及自身免疫性和胆道疾病等多种条件激活。活化后,静止的HSC迁移至损伤部位,分化为成肌纤维细胞,并分泌大量的ECM以及促炎性细胞因子。TGF-β1是LF最关键的细胞因子,其与TGF-β1受体结合,调节Collagen I的合成[14]。Zhang等[15]发现TGF-β1可诱导LX-2细胞活化,并在LX-2细胞中显著上调Collagen I、纤连蛋白和α-SMA的表达。本研究结果显示,用TGF-β1处理LX-2细胞48 h后,细胞、和mRNA表达水平显著升高,与以往研究结果一致,表明成功建立了体外LF模型。

图7 各组LX-2细胞Cav-1、Wnt1、Wnt5a、β-catenin、Cyclin D1和c-Myc蛋白表达情况(, n = 3)
EGCG是绿茶中提取的主要活性成分,已证明EGCG在疾病的治疗和预防中具有重要作用,其作用主要归因于其抗氧化和抗炎活性[6]。EGCG对非酒精性脂肪肝[16]、肝癌[17]、化学药物诱发的肝损伤[18]等各种肝脏相关疾病均具有显著的保护作用。此外,已有多项研究发现EGCG可以抑制动物模型中的肝脏炎症和纤维化[19]。Sojoodi等[20]发现EGCG可抑制HSC活化;王琦等[8]发现EGCG可诱导LX-2细胞凋亡,并抑制其增殖和活化。但由于实验条件、环境、细胞来源等因素的不同,不能将以往实验浓度直接用于本研究,因此,在进行正式实验前,本研究在以往实验的基础上采用含不同浓度EGCG(终浓度为0、12.5、25、50、100、200 μmol/L)的培养基处理LX-2细胞以筛选合适的浓度进行后续实验。结果显示,当EGCG浓度为12.5、25.0 μmol/L时对LX-2细胞存活率未出现明显影响,而当EGCG浓度≥50.0 μmol/L时可显著抑制LX-2细胞存活率;故选择EGCG(12.5、25.0 μmol/L)用于后续实验。转染后结果显示,TGF-β1处理LX-2细胞48 h可增加LX-2细胞存活率,降低细胞凋亡率,而经25.0 μmol/L EGCG干预的LX-2细胞,其存活率降低,细胞凋亡率增加,且细胞、和mRNA表达水平降低;细胞周期结果显示,EGCG干预的LX-2细胞停滞在G0/G1期,而S期细胞比例减少;AO/EB染色结果也显示,EGCG干预后凋亡细胞比例增加。进一步说明EGCG具有显著抑制LX-2细胞活化和增殖的作用,并促进其凋亡。
β-catenin是经典Wnt信号途径的主要下游效应物,在胞质中Wnt蛋白通过与细胞膜表面的跨膜受体结合,使β-catenin降解减少,导致β-catenin在胞质积累,当胞质中达到一定浓度时可转入胞核,与核内的转录因子相互作用,可激活与增殖和分化相关的靶基因(如c-Myc、cyclin、survivin)的表达[21]。Rong等[22]发现抑制Wnt/β-catenin信号途径可抑制HSC活化,降低Cyclin D1、α-SMA和Collagen Ⅰ的表达,减轻LF。而EGCG可抑制Wnt/β-catenin的激活[23],下调CyclinD1、c-Myc的表达,抑制肝癌的发展[24]。因此推测EGCG对LX-2细胞活化的抑制作用可能与Wnt途径有关。故在本研究中,通过Western blotting检测了LX-2细胞Wnt途径相关蛋白的表达,结果显示,EGCG可显著降低Wnt1、Wnt5a、β-catenin的表达,抑制TGF-β1诱导的LX-2细胞中Wnt途径的激活,证实EGCG可能通过抑制Wnt/β-catenin途径,进而抑制HSC的活化,参与LF。
Cav-1是胞膜上的一种整合膜蛋白,在许多细胞内高表达,对物质的转运、内皮的渗透和肿瘤的发生起重要的调节作用。Cav-1是肝脏功能的调节剂,可调节几种分子途径,从而调节肝脂质蓄积、脂质和葡萄糖代谢、线粒体生物学和肝细胞增殖;与胆汁瘀积、肝炎、肝硬化和肝癌的发生有关[25]。因此,Cav-1在维持肝生理功能中起着至关重要的作用。研究发现,在纤维化肝组织和激活的HSC中,Cav-1呈低表达;沉默可上调Collagen I表达,升高TIMP-1表达[11]。此外,有研究显示Cav-1可负调控经典的Wnt信号通路[10]。而本研究也检测到,在TGF-β1诱导的LX-2细胞中Cav-1的表达降低,并伴随着和以及Wnt1、Wnt5a、β-catenin表达的升高。由此,猜测EGCG对Wnt/β-catenin信号途径的调控机制可能与Cav-1有关。
研究表明,在激活的HSC中Wnt1和Wnt5a的表达上调[26]。Wnt1是经典的依赖β-catenin的Wnt信号通路蛋白,在纤维化肝组织和TGF-β1刺激的LX-2细胞中Wnt1、β-catenin的表达显著升高[27-28]。而Cav-1可通过调节β-catenin的细胞内定位来调节Wnt/β-catenin信号传导[29]。Guan等[30]发现Cav-1可通过抑制Wnt1/β-catenin信号通路改善慢性阻塞性肺疾病大鼠的肺损伤。本研究发现,经EGCG干预的LX-2细胞中,Cav-1的表达增加,而Wnt1、β-catenin的表达降低,且Wnt5a的表达也下调,Wnt5a是一种具有代表性的非经典Wnt蛋白,Li等[31]发现Wnt5a可增强LX-2细胞中α-SMA和Collagen I的蛋白和mRNA表达,促进HSC活化。本研究在EGCG干预的基础上采用小分子干扰技术沉默的表达,发现Wnt1、Wnt5a的表达上调,表明EGCG对Wnt信号通路的抑制作用被减弱。提示,Cav-1不仅可负调控经典的Wnt信号通路,还可负调控Wnt5a介导的非经典Wnt信号通路;EGCG对Wnt信号通路的抑制作用可能与其上调Cav-1的表达有关。
综上所述,EGCG可能通过上调Cav-1,抑制Wnt信号通路激活,进而抑制HSC活化。本研究仅从细胞水平初步探究了EGCG对HSC活化的分子机制,由于体内环境存在较大差异,EGCG在体内能否发挥相同的调控作用,进而影响LF,有待深入研究。
利益冲突 所有作者均声明不存在利益冲突
[1] Roehlen N, Crouchet E, Baumert T F. Liver fibrosis: Mechanistic concepts and therapeutic perspectives [J]., 2020, 9(4): E875.
[2] 龙翠珍, 舒远辉, 何萍, 等. 大麻素受体2激动剂AM1241对TGF-β1诱导的HSC-T6增殖、活化及凋亡的影响 [J]. 天津医药, 2020, 48(7): 606-610.
[3] Chen H X, Cai J Y, Wang J C,. Targeting Nestin+hepatic stellate cells ameliorates liver fibrosis by facilitating TβRI degradation [J]., 2021, 74(5): 1176-1187.
[4] 李静, 郑雪, 丁新, 等. 骨髓间充质干细胞旁分泌HGF体外调控肝星状细胞 [J]. 天津医药, 2019, 47(1): 1-5.
[5] Lambrecht J, van Grunsven L A, Tacke F. Current and emerging pharmacotherapeutic interventions for the treatment of liver fibrosis [J]., 2020, 21(13): 1637-1650.
[6] Almatroodi S A, Almatroudi A, Khan A A,. Potential therapeutic targets of epigallocatechin gallate (EGCG), the most abundant catechin in green tea, and its role in the therapy of various types of cancer [J]., 2020, 25(14): E3146.
[7] Nakamuta M, Higashi N, Kohjima M,. Epigallocatechin-3-gallate, a polyphenol component of green tea, suppresses both collagen production and collagenase activity in hepatic stellate cells [J]., 2005, 16(4): 677-681.
[8] 王琦, 赵佳, 陈大方, 等. EGCG对人肝星状细胞的生长状态及活化表型的影响 [J]. 浙江医学, 2019, 41(8): 747-750.
[9] Chen Y, Chen X, Ji Y R,. PLK1 regulates hepatic stellate cell activation and liver fibrosis through Wnt/β-catenin signalling pathway [J]., 2020, 24(13): 7405-7416.
[10] Mo S J, Wang L, Li Q,. Caveolin-1 regulates dorsoventral patterning through direct interaction with beta-catenin in zebrafish [J]., 2010, 344(1): 210-223.
[11] Yao Y, Xia Z, Cheng F,. Human placental mesenchymal stem cells ameliorate liver fibrosis in mice by upregulation of Caveolin1 in hepatic stellate cells [J]., 2021, 12(1): 294.
[12] Zheng Y Y, Morris A, Sunkara M,. Epigallocatechin-gallate stimulates NF-E2-related factor and heme oxygenase-1 via caveolin-1 displacement [J]., 2012, 23(2): 163-168.
[13] Hsieh S R, Hsu C S, Lu C H,. Epigallocatechin-3- gallate-mediated cardioprotection by Akt/GSK-3β/ caveolin signalling in H9c2 rat cardiomyoblasts [J]., 2013, 20: 86.
[14] Chen Z J, Jain A, Liu H,. Targeted drug delivery to hepatic stellate cells for the treatment of liver fibrosis [J]., 2019, 370(3): 695-702.
[15] Zhang J, Jiang N, Ping J,. TGF‑β1‑induced autophagy activates hepatic stellate cells via the ERK and JNK signaling pathways [J]., 2021, 47(1): 256-266.
[16] Naito Y, Ushiroda C, Mizushima K,. Epigallocatechin-3-gallate (EGCG) attenuates non- alcoholic fatty liver disease via modulating the interaction between gut microbiota and bile acids [J]., 2020, 67(1): 2-9.
[17] Tang Y P, Cao J, Cai Z M,. Epigallocatechin gallate induces chemopreventive effects on rats with diethylnitrosamine‑induced liver cancer via inhibition of cell division cycle 25A [J]., 2020, 22(5): 3873-3885.
[18] Inoue H, Arakawa K, Tanaka M,. Upregulation and stabilization of senescence marker protein-30 by epigallocatechin gallate against-butyl hydroperoxide- induced liver injuryand[J]., 2021, 68(1): 51-57.
[19] Al-Basher G I. Green tea activity and iron overload induced molecular fibrogenesis of rat liver [J]., 2019, 26(3): 531-540.
[20] Sojoodi M, Wei L, Erstad D J,. Epigallocatechin gallate induces hepatic stellate cell senescence and attenuates development of hepatocellular carcinoma [J].(Phila), 2020, 13(6): 497-508.
[21] Mao X M, Li H, Zhang X Y,. Retinoic acid receptor α knockdown suppresses the tumorigenicity of esophageal carcinoma via Wnt/β-catenin pathway [J]., 2018, 63(12): 3348-3358.
[22] Rong X L, Liu J Z, Yao X,. Human bone marrow mesenchymal stem cells-derived exosomes alleviate liver fibrosis through the Wnt/β-catenin pathway [J]., 2019, 10(1): 98.
[23] Zhu J Y, Jiang Y, Yang X,. Wnt/β-catenin pathway mediates (−)-epigallocatechin-3-gallate (EGCG) inhibition of lung cancer stem cells [J]., 2017, 482(1): 15-21.
[24] Sur S, Pal D, Mandal S,. Tea polyphenols epigallocatechin gallete and theaflavin restrict mouse liver carcinogenesis through modulation of self-renewal Wnt and hedgehog pathways [J]., 2016, 27: 32-42.
[25] Fernandez-Rojo M A, Ramm G A. Caveolin-1 function in liver physiology and disease [J]., 2016, 22(10): 889-904.
[26] Du J H, Niu X M, Wang Y,. MiR-146a-5p suppresses activation and proliferation of hepatic stellate cells in nonalcoholic fibrosing steatohepatitis through directly targeting Wnt1 and Wnt5a [J]., 2015, 5: 16163.
[27] 李璨, 陆爽, 吴君. 丹防胶囊对免疫性肝纤维化大鼠肝组织wnt1、β-catenin、DKK1表达的影响 [J]. 天津医药, 2019, 47(8): 804-809.
[28] Sierra R, Gómez Bustillo S, Kameneva P,. Contribution of neural crest and GLAST+Wnt1+bone marrow pericytes with liver fibrogenesis and/or regeneration [J]., 2020, 40(4): 977-987.
[29] Galbiati F, Volonte D, Brown A M,. Caveolin-1 expression inhibits Wnt/beta-catenin/Lef-1 signaling by recruiting beta-catenin to caveolae membrane domains [J]., 2000, 275(30): 23368-23377.
[30] Guan P, Cai W T, Jiang F,. Caveolin-1 improves lung injury in rats with chronic obstructive pulmonary disease partially through Wnt/β-catenin signaling pathway [J]., 2020, 34(2): 457-465.
[31] Li W T, Yu X L, Zhu C L,. Notum attenuates HBV-related liver fibrosis through inhibiting Wnt 5a mediated non-canonical pathways [J]., 2019, 52(1): 10.
Effect and mechanism of epigallocatechin gallate on activation of hepatic stellate cells based on Wnt signaling pathway
SHI Ming-liang, WANG Xiao-lei, LI Jiang-lin, DUAN Wen-fei
Department of General Surgery, The First Affiliated Hospital of Henan University, Kaifeng 475000, China
To explore the effect and mechanism of epigallocatechin gallate (EGCG) on the activation of hepatic stellate cells LX-2 based on Wnt pathway.LX-2 cells were cultured, and the experimental concentration of EGCG was screened by CCK-8 method. LX-2 cells in the logarithmic growth phase were divided into control group (normally cultured), model group [10 ng/mL transforming growth factor-β1 (TGF-β1)], low-dose EGCG group (12.5 μmol/L EGCG + 10 ng/mL TGF-β1), high-dose EGCG group (25.0 μmol/L EGCG + 10 ng/mL TGF-β1), EGCG + siRNA-NC group [Caveolin-1 ()-siRNA negative control + 25.0 μmol/L EGCG + TGF-β1] and EGCG +-siRNA group (-siRNA + 25.0 μmol/L EGCG + TGF-β1), CCK-8 method was used to detect cell survival rate of each group; Flow cytometry was used to detect cell apoptosis and cell cycle distribution; Acridine orange/ethidium bromide (AO/EB) staining method was used to observe the morphology of cell apoptosis; qRT-PCR was used to detect α-smooth muscle actin (),and tissue inhibitor of matrix metalloproteinase-1 () mRNA expressions of cells; Western blotting was used to detect the expressions of Cav-1 and Wnt signaling pathway related proteins of cells.EGCG reduced survival rate of LX-2 cells in a concentration-dependent manner. Compared with control group, LX-2 cells survival rate, ratios of S phase and G2/M phase cells, mRNA expressions of,and, and protein expressions of Wnt1, Wnt5a, β-catenin, Cyclin D1, c-Myc were significantly increased in model group (< 0.05), apoptosis rate, ratio of G0/G1phase cells, ratio of apoptotic cells, and Cav-1 protein expression were significantly reduced (< 0.05). Compared with model group, LX-2 cells survival rate, ratios of S phase and G2/M phase cells, mRNA expression of,,, and protein expressions of Wnt1, Wnt5a, β-catenin, Cyclin D1, c-Myc in low-, high-dose EGCG groups were significantly decreased (< 0.05), apoptosis rate, ratio of G0/G1phase cells, ratio of apoptotic cells, and Cav-1 protein expression were significantly increased (< 0.05); On the basis of EGCG intervention, silencing the expression ofsignificantly up-regulated Wnt1 and Wnt5a protein expressions, and weakened the inhibitory effect of EGCG on Wnt signaling pathway.EGCG may inhibit the activation of Wnt signaling pathway by up-regulating the expression of Cav-1, thereby inhibiting the activation of LX-2 cells.
epigallocatechin gallate; hepatic stellate cells; apoptosis; Wnt signaling pathway; Caveolin-1
R285.5
A
0253 - 2670(2022)03 - 0758 - 09
10.7501/j.issn.0253-2670.2022.03.015
2021-10-27
河南省2017年科技发展计划项目(172102310284)
石明亮(1987—),男,硕士,主治医师,从事肝胆胰腺疾病的基础研究。E-mail: shiml87@163.com
[责任编辑 李亚楠]

