广灵驴FTO基因克隆、序列分析及组织差异表达
邱丽霞,关家伟,李 丽,李武峰,杜 敏
(1.山西农业大学生命科学学院,太谷 030801;2.美国华盛顿州立大学动物科学系,普尔曼 99164-6310)
多年来,市场上一直以鸡肉、猪肉、牛肉等作为主要的肉类产品满足消费者的需求,但随着生活水平的提高,人们的消费选择性越来越强。驴肉具有低脂率、高蛋白营养的特点[1],且肉质鲜美,符合大众群体的口感要求,是一种很好的滋补类肉产品,因此,对驴肉的肉品质研究和肉质性状的改良优化有助于将驴肉产品推向更大的市场。肉的食用口感和优良性状很大程度上得利于肌内脂肪(intramuscular fat,IMF)发挥作用,肌内脂肪沉积是一个受多基因调控和代谢机制影响的过程,其沉积量影响着嫩度、风味、大理石花纹等其他肉质性状的好坏[2]。与此同时,过度喂养牲畜导致的脂肪沉积过多会影响其健康状况与食用口感,进而影响其经济价值,因此,从分子生物学角度开展脂肪沉积的研究很有必要。
脂肪和肥胖相关基因(fat mass and obesity-associated gene,FTO)是1999年Peters等[3]通过克隆患有脚趾融合的野生型小鼠发现的,是能够显著影响脂肪代谢和沉积的关联基因,现阶段的研究主要集中在人和小鼠上。研究发现,携带有FTO基因的小鼠会表现出体长更长、体重更高和骨密度更高的特点,说明FTO基因的表达与脂肪沉积之间具有密切联系,同时在生长发育方面发挥着关键作用[4]。FTO基因属于非二价铁离子血红素加双氧酶超家族(ALKB)成员之一,也被称为ALKBH9,拥有铁结合基因与α-酮戊二酸相互作用的结构域[5],在DNA/RNA的去甲基化中起重要作用[6]。FTO基因在绝大多数生物中广泛表达,Hu等[7]研究发现,在克隆猪FTO基因序列后的6号染色体片段中存在相应的SNPs位点,该区域拥有许多调控脂肪性状的数量性状位点,推测这些SNPs位点可能与猪的肌内脂肪沉积相关。研究表明,FTO基因在不同动物组织中均有表达,且表达量存在显著差异,Frayling等[8]分别在胎儿和成人的各组织中检测FTO基因的表达情况,结果发现无论是在胎儿还是成人的大脑中其表达量都是最高的,这与大鼠、小鼠的组织表达结果一致[9]。Gerken等[5]利用原位杂交技术发现,FTO基因在下丘脑控制能量平衡的核团中广泛表达,说明FTO基因与肥胖的相关性可以通过能量摄取来实现。Mizuno等[10]通过对小鼠禁食来观察FTO基因与肝脏代谢水平之间的联系,发现通过饥饿行为处理之后,FTO基因及过氧化物酶体相关辅助因子可影响肝脏的代谢水平变化,FTO基因与血糖、葡萄糖-6-磷酸酶(glucose-6-phosphate,G-6-PC)等mRNA水平呈显著正相关,说明FTO基因mRNA的表达受能量摄入的影响,并与代谢物的代谢水平波动有关。目前,关于FTO基因组织特异性表达的研究主要集中在鼠和猪等少数哺乳动物中[11],对驴FTO基因的遗传研究鲜见报道。鉴于此,本试验以广灵驴为试验动物,扩增并克隆FTO基因,分析其核苷酸和蛋白质序列与功能,并检测FTO基因在广灵驴7种不同组织中的表达情况,以期为进一步探究FTO基因的表达调控与基因功能、脂肪沉积和物质代谢提供理论基础。
1 材料与方法
1.1 材料
1.1.1 样品采集 试验动物由山西省忻州市繁峙县田园毛驴养殖公司提供,在保证规范管理、自由采食和充足饮水的前提下选取10头3岁体重相同、体态健康的雌性母驴,进行放血处理确保动物已经死亡后屠宰。在无菌条件下采集心脏、肝脏、脾脏、肺脏、肾脏、背最长肌及皮下脂肪组织,剔除样品中的结缔组织后盛装到2 mL冻存管留样保存,然后使用液氮进行冷冻处理,带回实验室后-80 ℃保存备用。
1.1.2 主要试剂 普通DNA凝胶回收试剂盒、pGM-T Fast克隆试剂盒、大肠杆菌DH5α感受态细胞均购自天根生化科技(北京)有限公司;Trans2K DNA Marker购自北京全式金生物技术有限公司;2×TaqPCR MasterMix购自中科瑞泰(北京)生物科技有限公司;反转录及荧光定量试剂盒均购自北京聚和美有限公司;Trizol试剂盒、SYBR Green Ⅰ核酸染料(10 000×)及氨苄青霉素均购自北京索莱宝科技有限公司。
1.2 方法
1.2.1 引物设计及合成 参照GenBank中马(登录号:XM_023636997.1)、羊驼(登录号:XM_006207838.3)、山羊(登录号:NM_001319276.1)等物种的FTO基因序列,运用Primer Premier 3.0及GenScript Primer Design在线软件分别设计3对用于广灵驴FTO基因CDS序列的克隆引物和1对实时荧光定量PCR引物,内参基因选用β-actin,引物信息见表1。引物均由生工生物工程(上海)股份有限公司合成。

表1 引物信息
1.2.2 总RNA提取及cDNA合成 利用Trizol试剂盒提取驴7种不同组织总RNA,利用核酸测定仪及凝胶电泳鉴定RNA的浓度和完整性,符合质量要求后参照M5 Super qPCR RT Kit with gDNA Remove反转录试剂盒说明书合成cDNA,-20 ℃保存备用。
1.2.3 克隆及测序分析 以cDNA为模板,运用PCR技术扩增FTO基因CDS区完整序列。PCR扩增体系10 μL:模板cDNA 1 μL,2×TaqPCR MasterMix 5 μL,上、下游引物各0.4 μL,ddH2O 3.2 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,共34个循环;72 ℃延伸5 min;12 ℃保存。利用1.0%琼脂糖凝胶电泳检测其特异性,鉴定正确后进行回收和纯化,将其与pGM-T载体过夜连接,转化大肠杆菌DH5α感受态细胞,在抗氨苄青霉素的培养基中接种培养扩大体系,挑选阳性克隆菌送生工生物工程(上海)股份有限公司测序。
1.2.4 相似性比对及系统进化树构建 利用DNAMAN 9.0软件对测序结果进行拼接,利用BLAST将所获序列与输入NCBI中进行比对得到完整CDS区。通过ORF Finder工具预测FTO基因开放阅读框(open reading frame,ORF),并由此得到完整氨基酸序列。使用ClustalX和DNAStar 11.0中的MegAlign软件将广灵驴与马(登录号:XM_023636997.1)、牛(登录号:NM_001098142.1)、人(登录号:NM_001080432.3)、猪(登录号:NM_001112692.1)、绵羊(登录号:NM_001104931.1)、山羊(登录号:NM_001319276.1)和羊驼(登录号:XM_006207838.3)的FTO基因序列进行相似性比对,利用Mega 11.0软件构建系统发育树。
1.2.5 生物信息学分析 使用ExPASy中ProtParam和ProtScale在线软件对FTO蛋白进行理化性质、亲/疏水性预测;利用PSORT Ⅱ Prediction、TMHMM 2.0、NetPhos 3.1、NetNGlyc 1.0和NetOGlyc 4.0在线软件对FTO蛋白的亚细胞定位、跨膜区域、磷酸化位点及糖基化位点进行预测;利用SOPMA、SWISS-MODEL及NCBI中CDD网站预测FTO蛋白的二级结构、三级结构和结构域等,详细信息见表2。

表2 预测FTO氨基酸功能的生物信息学分析网站
1.2.6 组织差异表达 以广灵驴7种组织cDNA为模板,以β-actin为内参基因,使用实时荧光定量PCR检测FTO基因表达水平。PCR反应体系10 μL:模板1 μL,2×Real-time PCR Super Mix 5 μL,上、下游引物各0.25 μL,ddH2O 3.5 μL。PCR反应条件:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,72 ℃ 20 s,共40个循环。每组样品3个重复。以肝脏组织为对照,利用2-ΔΔCt法计算FTO基因相对表达量,运用GraphPad Prism 8.0工具选择单因素方差分析(One-Way ANOVA)方法处理试验数据,绘图呈现出不同组织的基因表达差异,以P<0.05为差异显著性判断标准。
2 结 果
2.1 FTO基因CDS区克隆与测序
PCR扩增产物经1.0%琼脂糖凝胶电泳鉴定,结果见图1。由图1可知,扩增序列长度分别为724、861和515 bp,与预期片段大小一致。对鉴定正确的PCR产物进行克隆测序,对所获序列进行拼接,得出长为1 518 bp的广灵驴FTO基因CDS区序列,序列提交至NCBI,登录号:MZ169553。通过ORF Finder工具进行开放阅读框预测分析,结果表明,FTO基因开放阅读框长1 518 bp,编码505个氨基酸残基。
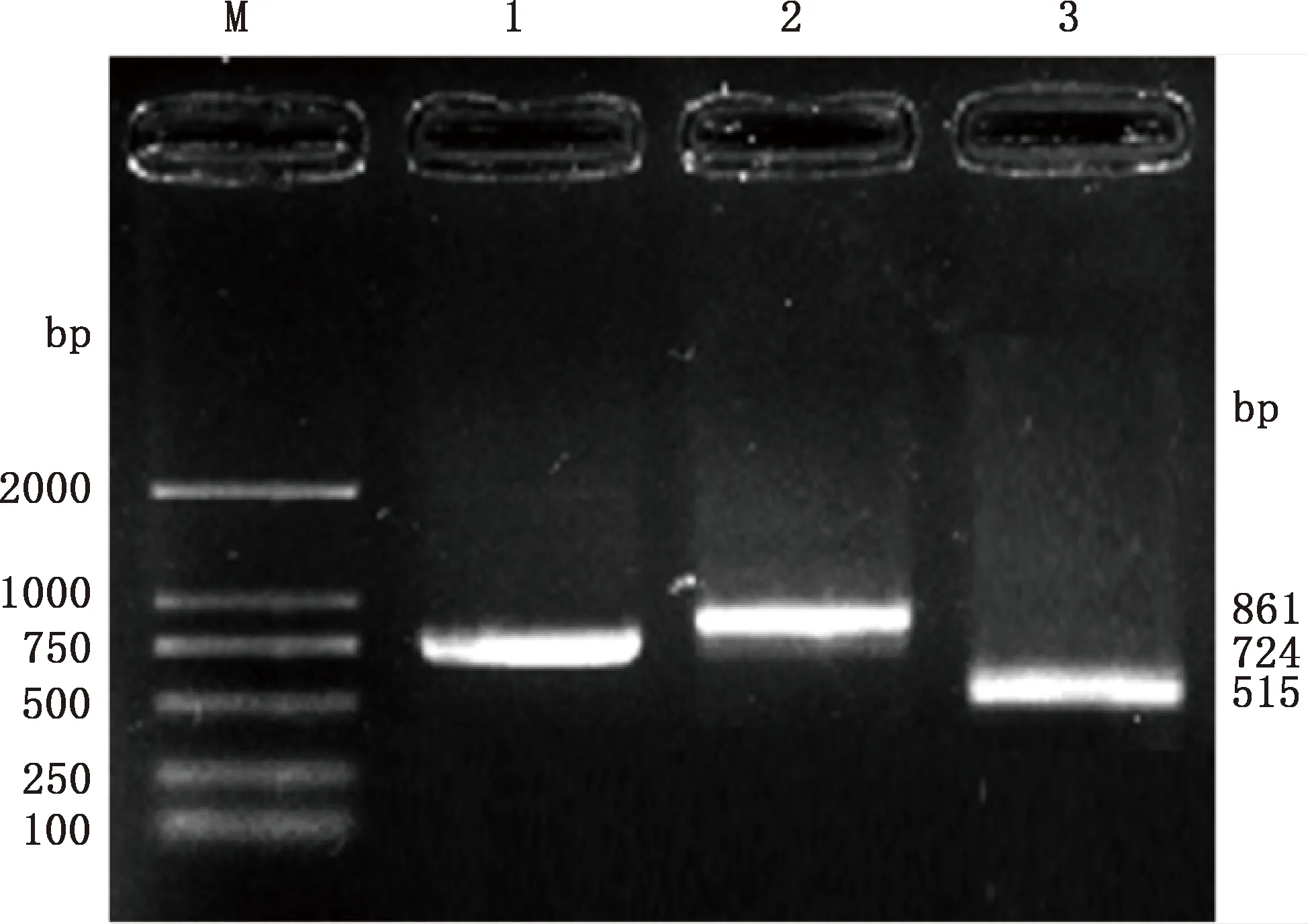
M,Trans2K DNA Marker;1~3,引物FTO-1、FTO-2、FTO-3的PCR扩增产物M,Trans2K DNA Marker;1-3,PCR amplification products of primers FTO-1,FTO-2 and FTO-3,respectively图1 广灵驴FTO基因的PCR扩增结果Fig.1 PCR amplification results of FTO gene in Guangling donkey
2.2 广灵驴FTO基因核苷酸及氨基酸序列的相似性比对
运用MegAlign在线软件进行序列的相似性比对,结果显示,广灵驴FTO基因与马、人、羊驼、猪、牛、绵羊和山羊的核苷酸序列相似性分别为99.3%、90.8%、90.7%、90.3%、89.5%、89.2%和89.2%(图2);氨基酸序列相似性分别为98.9%、87.1%、94.7%、92.8%、91.4%、91.3%和91.3%(图3)。

图2 广灵驴FTO基因核苷酸序列相似性比对Fig.2 The similarity alignment of nucleotide sequences of FTO gene in Guangling donkey
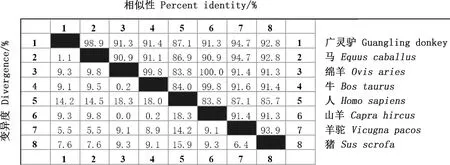
图3 广灵驴FTO基因氨基酸序列相似性比对Fig.3 The similarity alignment of amino acid sequences of FTO gene in Guangling donkey
2.3 系统进化树构建
通过Mega 11.0软件利用NJ(Neighbor-Jioning)法构建广灵驴FTO基因与其他物种的系统进化树,结果见图4。由图4可知,与广灵驴亲缘性最近的是马,其次与人聚为一类;再与羊驼和猪汇聚成一类;最后与牛、山羊、绵羊汇聚成一大类,说明广灵驴与山羊、绵羊的亲缘性最远,与相似性比对结果相一致。

图4 广灵驴FTO基因系统进化树Fig.4 Phylogenetic tree of FTO gene in Guangling donkey
2.4 生物信息学分析
2.4.1 理化性质 FTO蛋白分子式为C2597H4021N705O775S26,分子质量为58.35 ku,脂肪系数为80.36,理论等电点为5.07,表明FTO极可能是酸性蛋白。FTO蛋白编码的505个氨基酸中亮氨酸数量最多(11.1%),甲硫氨酸数量最少(2.4%),带负电的氨基酸残基数量多于带正电的(表3)。FTO蛋白稳定系数为48.82,说明该蛋白性质不稳定。

表3 广灵驴FTO蛋白的氨基酸组成
2.4.2 亲/疏水性 通过ProtScale在线软件对广灵驴FTO蛋白进行亲/疏水性分析,在第483异亮氨酸(I)处疏水性最大(2.500);在第12位精氨酸(R)处疏水性最小(-3.222),FTO蛋白的平均疏水指数为-0.550,证明该蛋白为亲水性蛋白(图5)。
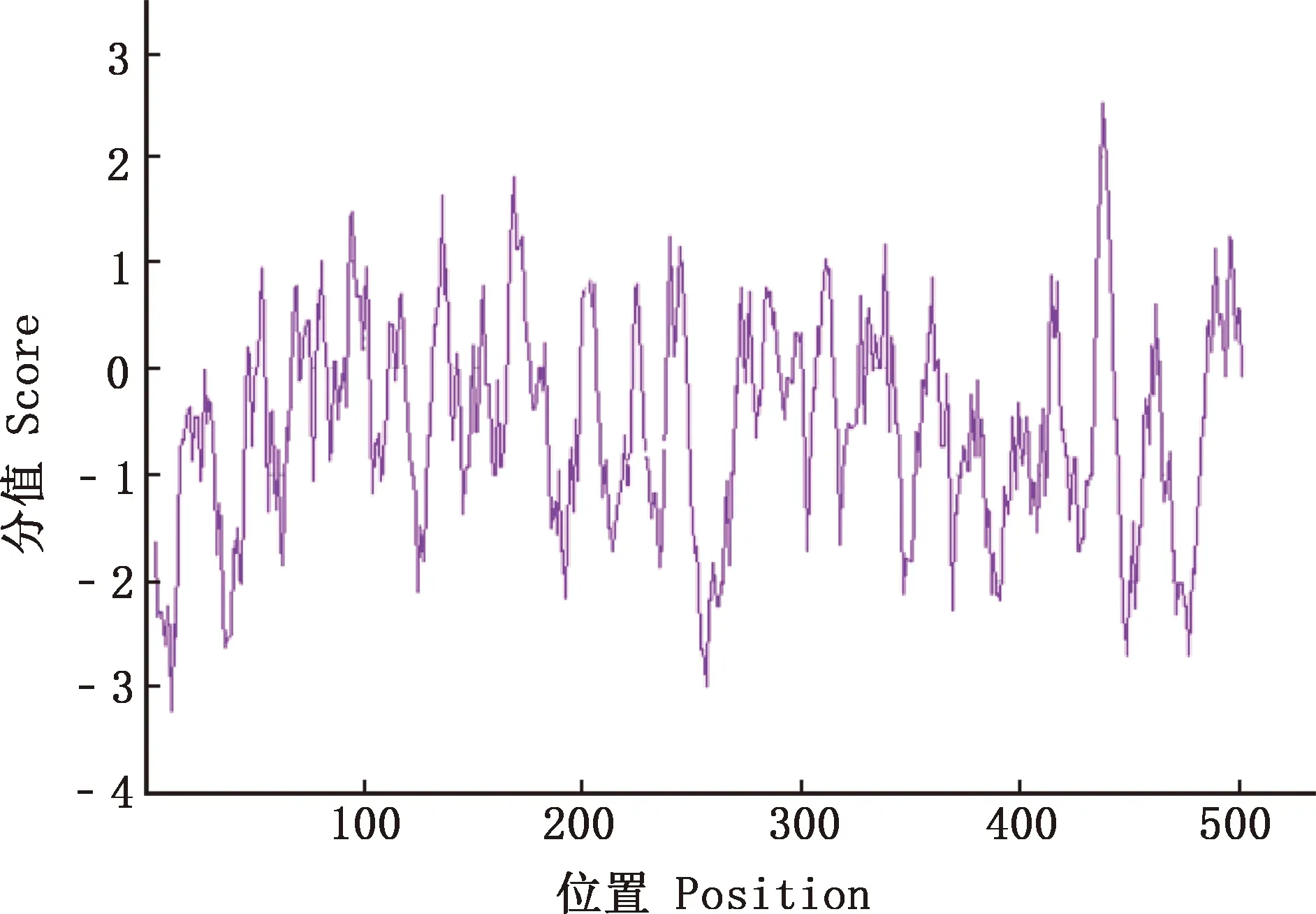
图5 广灵驴FTO蛋白的亲/疏水性预测Fig.5 Hydrophilicity/hydrophobicity prediction of FTO protein in Guangling donkey
2.4.3 跨膜区和亚细胞定位 使用TMHMM 2.0在线软件分析FTO蛋白跨膜区,结果显示,广灵驴FTO蛋白没有明显的跨膜区域,且主要分布于膜外(图6),说明该蛋白为膜外蛋白。使用PSORT Ⅱ Prediction在线工具对蛋白亚细胞定位进行预测,结果显示,FTO蛋白位于细胞质中的可能性大于细胞核,可能性分别为73.9%和26.1%,可信度显示76.7%,表明该蛋白存在于细胞质中的可能性较大。
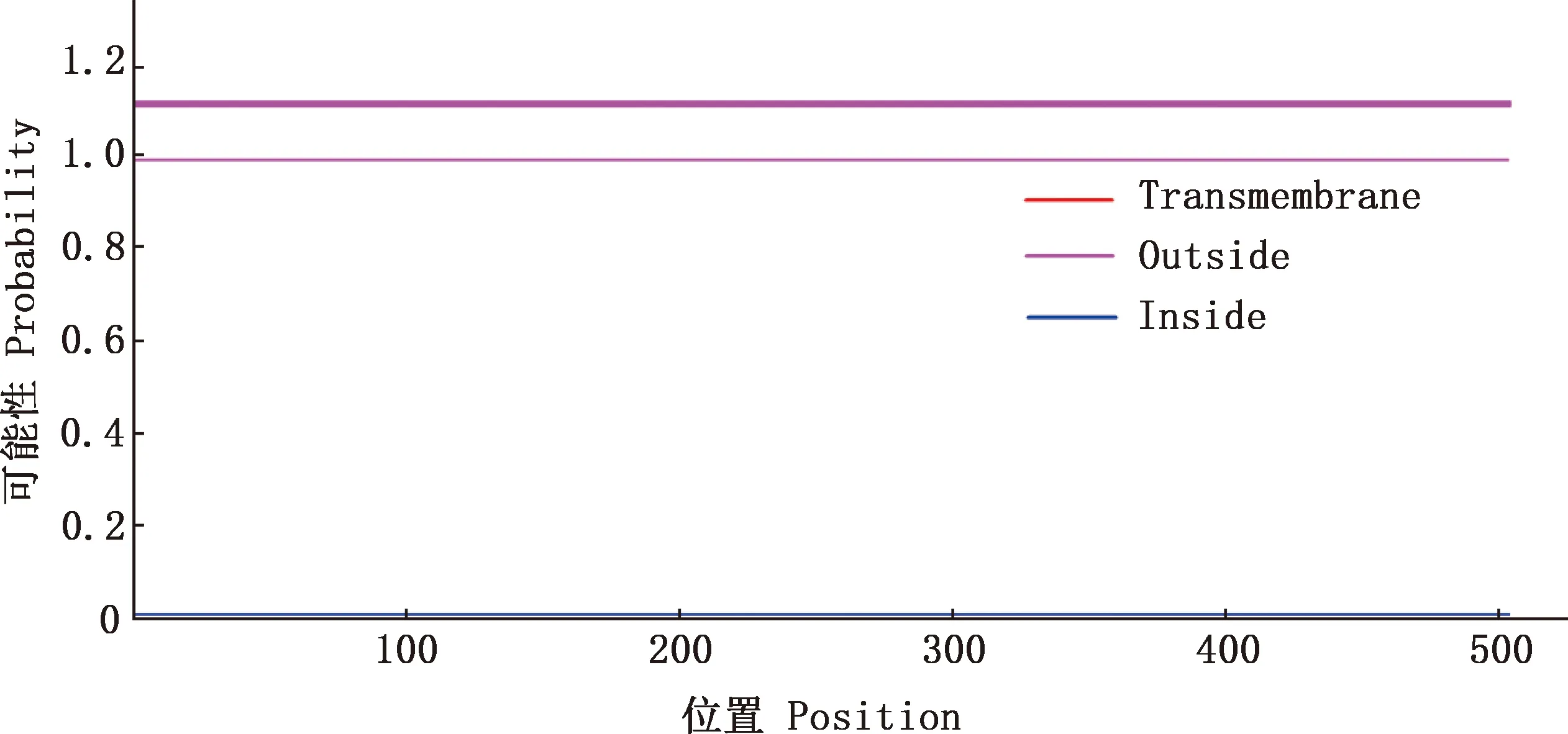
图6 广灵驴FTO蛋白的跨膜区预测Fig.6 Transmembrane prediction of FTO protein in Guangling donkey
2.4.4 磷酸化位点与糖基化位点预测 运用NetPhos 3.1、NetNGlyc 1.0及NetOGlyc 4.0在线软件预测FTO蛋白的修饰情况,结果显示,共预测到34个磷酸化位点,其中丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Tyr)磷酸化位点分别为17、13和4个(图7A);2个N-糖基化位点,分别位于第200及302位氨基酸处(图7B),3个O-糖基化位点。

图7 广灵驴FTO蛋白磷酸化位点(A)与N-糖基化位点(B)预测Fig.7 Phosphorylation (A) and N-glycosylation (B) site prediction of FTO protein in Guangling donkey
2.4.5 二级结构与三级结构 利用SOPMA在线软件预测FTO蛋白二级结构,结果显示,α-螺旋、无规则卷曲、延伸链和β-转角分别占43.96%、37.82%、11.49%和6.73%(图8)。利用SWISS-MODEL在线软件预测FTO蛋白三级结构模型,其预测结果与二级结构预测结果相符(图9)。
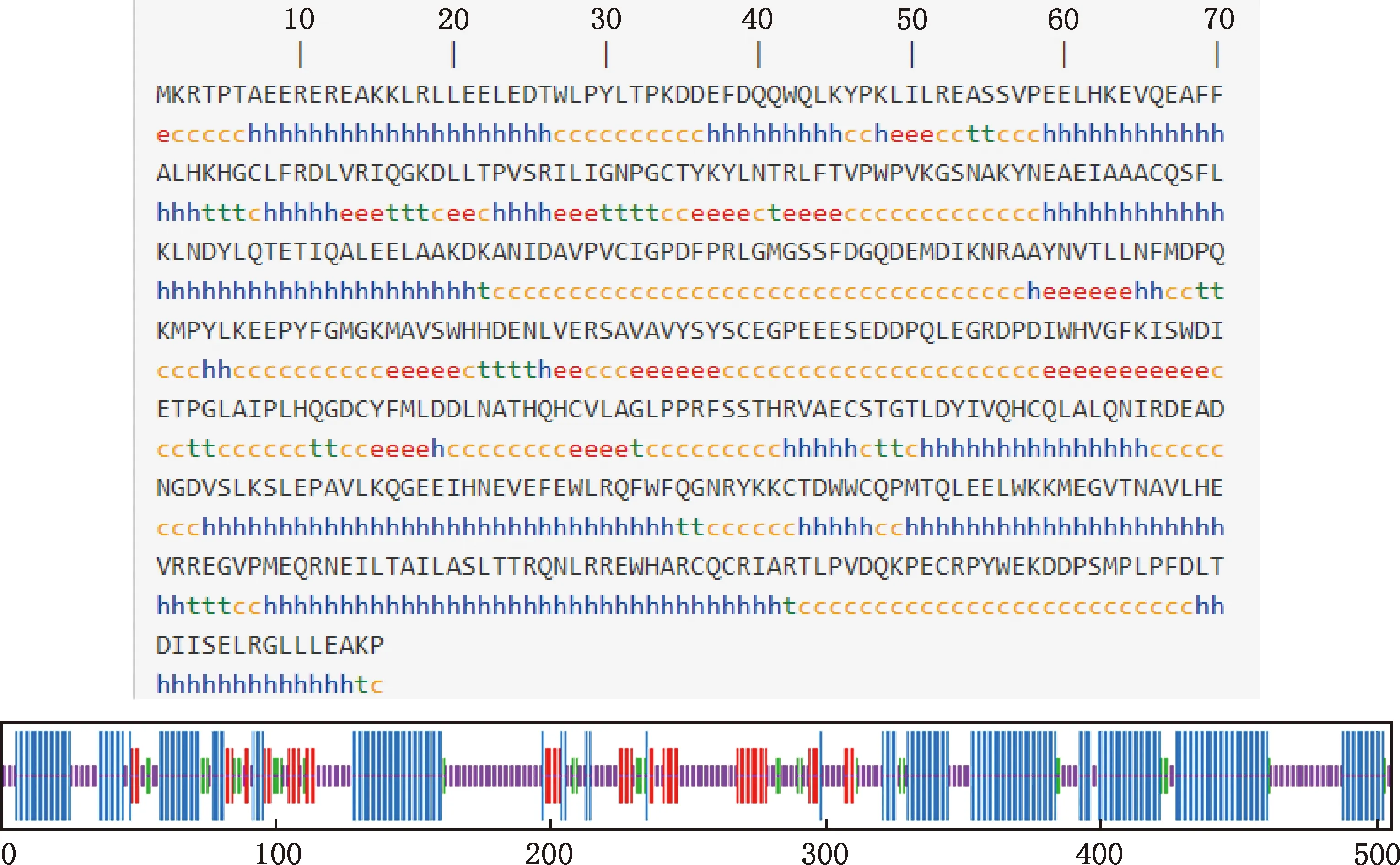
①h,α-螺旋;e,延伸链;t,β-转角;c,无规则卷曲。②线条由长到短分别为α-螺旋、延伸链、β-转角和无规则卷曲①h,Alpha helix;e,Expended strand;t,Beta turn;c,Random coil.②The lines form long to short represent alpha helix,expended strand,beta turn and random coil,respectively图8 广灵驴FTO蛋白二级结构预测Fig.8 Secondary structure prediction of FTO protein in Guangling donkey
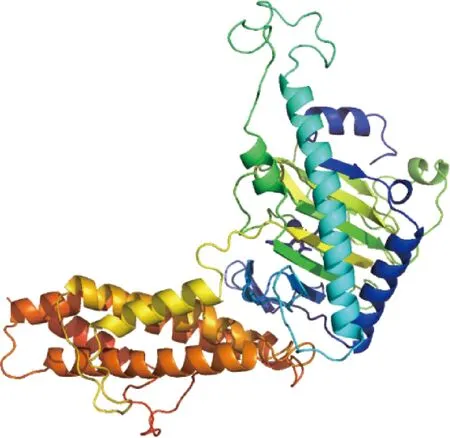
图9 广灵驴FTO蛋白三级结构预测Fig.9 Tertiary structure prediction of FTO protein in Guangling donkey
2.4.6 结构域 通过NCBI的CDD进行结构域预测发现,FTO蛋白存在2个结构域(图10), 在第36-325位氨基酸处存在FTO N-端催化结构域,具有催化脱甲基化酶活性,来自于FTO蛋白的催化类AlkB超家族;在第329-498位氨基酸处存在FTO C-端结构域,该结构域已被证明与人类体重指数(body mass index,BMI)和肥胖风险增加有关。

图10 广灵驴FTO蛋白结构域预测Fig.10 Domain prediction of FTO protein in Guangling donkey
2.5 广灵驴FTO基因组织差异分析
由图11可知,FTO基因在广灵驴7种组织中均有表达,且呈现出明显的表达差异,其中FTO基因表达最丰富的组织为皮下脂肪和肺脏,且两者间差异不显著(P>0.05),但与肝脏、脾脏、肾脏、心脏和背最长肌的表达量存在极显著差异(P<0.01);FTO基因在肝脏中的表达量极显著高于心脏、脾脏、肾脏和背最长肌(P<0.01);在心脏和脾脏中的表达量较少,极显著低于肾脏(P<0.01),显著高于背最长肌(P<0.05)。

肩标不同小写字母表示差异显著(P<0.05);肩标不同大写字母表示差异极显著(P<0.01);肩标相同字母表示差异不显著(P>0.05)Values with different small letter superscripts mean significant difference (P<0.05);And with different capital letter superscripts mean extremely significant difference (P<0.01);While with the same letter superscripts mean no significant difference (P>0.05)图11 广灵驴7种组织FTO基因表达差异Fig.11 Expression difference of FTO gene in 7 tissues of Guangling donkey
3 讨 论
研究证明,除营养调控外,脂肪沉积很大程度上受分子遗传水平层面的调控影响,肌内脂肪沉积不仅影响动物的体型与健康状况,还能调控改善肉类品质,如肉色、嫩度、风味、大理石花纹等[12]。随着全基因组关联性分析、候选基因筛选和遗传克隆等分子生物技术的成熟,与脂肪沉积相关的一些候选基因相继被发现。脂肪沉积是一个动态平衡的过程,主要以甘油三酯(triglyceride,TG)的形式储存和发挥生理作用[13], 像过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma,PPARγ)[14]、 激素敏感酯酶(hormone sensitive lipase,HSL)[15]、二酰基甘油酰基转移酶(diacylglycerolacyl-transferase,DGAT)[16]等都是脂肪沉积过程中的转录因子或脂肪分泌因子,对脂肪级联调控发挥一定作用[17]。研究显示,FTO基因可通过颉颃脂肪分解的相关基因或上调脂肪合成的相关基因来帮助TG的聚集,从而使脂肪沉积量增加[18]。目前,广灵驴FTO基因的肉质性状关联和遗传调控的研究在国内外鲜见报道,本试验通过克隆FTO基因的完整CDS区序列,并预测FTO蛋白的相关功能,来探究其在动物脂肪沉积与能量平衡过程中的作用。
本研究克隆获得广灵驴FTO基因CDS区序列,与其他物种相比具有较高的保守性。研究发现,FTO基因内含子1中的SNP是与体重指数和体脂相关的常见变异体,其主要与食物摄入和能量平衡有关[19-20]。Karra等[21]证实,FTO基因上的SNP位点rs9939609可以通过食欲肽的表达水平影响食欲并影响摄食量,以达到脂肪含量的沉积与能量消耗代谢。因此,推测FTO基因突变位点可能会通过同样的方式对广灵驴的脂肪沉积产生影响,为深入探究广灵驴FTO基因功能提供了新的思路。 本试验结果发现,广灵驴FTO基因开放阅读框长1 518 bp,可编码505个氨基酸, 分析结果与猪[22]和山羊[23]一致。在猪中,FTO基因会随着体重的增加而增加, 并与肌内脂肪组织呈显著相关,表明FTO很有可能是脂肪沉积性状的重要候选基因[24]。
FTO蛋白质分子式为C2597H4021N705O775S26,属于酸性亲水蛋白且性质不稳定,通过对蛋白序列比对和理化性质预测得知,FTO蛋白与其他物种间高度保守一致。RNA结合蛋白SFPQ能够与FTO相互作用,FTO的亚细胞定位直接影响其接近不同RNA底物的能力[25]。亚细胞定位结果显示,FTO蛋白可能定位于细胞质中,而RNA主要存在于细胞核,与FTO不处于同一空间,这个现象可能与其去甲基化能力的强弱有直接关联,进而影响脂肪沉积含量。FTO具有34个磷酸化位点和5个糖基化位点,磷酸化和糖基化作为蛋白质翻译后修饰作用可决定蛋白质的功能,FTO蛋白作为一种重要的去甲基化酶,能够通过调节6-甲基腺嘌呤(N6-methyladenosine,m6A)的去甲基化来调控脂肪沉积过程。Wu等[26]揭示了FTO依赖的m6A甲基化的去甲基化作用通过磷酸腺苷蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)信号通路参与骨骼肌脂质积累的调节,同时,FTO基因作用于m6A的去甲基化还与肥胖、心血管疾病和肿瘤的发生有关[27]。蛋白质二级结构预测发现,α-螺旋及无规则卷曲是广灵驴FTO蛋白最主要的结构形式,进一步证实了FTO蛋白性质不稳定的结果,易于改变其空间构象。结构域预测分析显示,FTO第36-325位氨基酸处存在N-端催化结构域(NTD),第329-498位氨基酸处存在β-折叠的C-端结构域(CTD),NTD决定着FTO的去甲基化酶活性,使其在脂质积累过程中发挥作用,CTD则与人类肥胖风险有关。
FTO基因广泛表达于与能量稳态相关的外周区域,包括肝脏、脂肪组织和骨骼肌。 广灵驴不同组织FTO基因表达差异结果发现,在皮下脂肪、肺脏、肝脏和肾脏中的表达量极显著高于心脏、脾脏和背最长肌,这与Chen等[28]试验结果基本一致。皮下脂肪组织是肌内脂肪沉积的主要位置,而肺脏是启动免疫保护功能的重要组织器官,FTO基因在肺脏中的高表达指示其可能在保护免疫中发挥作用,肝脏和肾脏则主要影响着机体的能量积累与代谢。已有研究认为,免疫能力取决于营养状况,也可能会受到包括肥胖在内的相关疾病的负面影响,FTO基因可以从遗传碱基多态性上诱导Ⅱ型糖尿病的发生、损害免疫功能,从而引起相关传染病的发生[29]。另外,背最长肌中FTO基因表达量最低的原因可能是受肌肉纤维类型的影响,Gan等[30]通过研究杂交鸭腿肌和胸肌的肉质性状影响发现,2个不同肌肉部位的肌内脂肪含量存在显著差异,肌内脂肪含量与红色肌纤维含量呈正相关,与白色肌纤维含量呈负相关。因此,FTO基因并不局限于单一部位的表达,可在机体多个组织中表达,对脂肪沉积调控和免疫功能等方面发挥关键作用,并与控制能量支出平衡有关。
4 结 论
本研究成功克隆了广灵驴FTO基因CDS序列,提交到NCBI,登录号:MZ169553,序列长度为1 518 bp,可编码505个氨基酸,其与马亲缘关系最近,与绵羊和山羊亲缘关系最远。FTO蛋白是不稳定的酸性蛋白,包含34个磷酸化位点和5个糖基化位点,具有属于AlkB超家族的C-端结构域及N-端催化结构域,不存在信号肽剪切位点和跨膜结构,高级结构以α-螺旋和无规则卷曲为主。FTO基因在广灵驴7种组织中均有不同程度的表达,其中表达水平最丰富的组织为皮下脂肪和肺脏,但在背最长肌中的表达丰度最低,推测FTO基因对脂肪沉积发挥作用,为将来提高脂肪沉积含量及改善肉品质量提供参考依据。

