蔓荆子黄素通过上调miR-1193表达调控胃癌细胞的增殖和凋亡①
邓明 邓芳 陈志坚
(广州中医药大学第一临床医学院,广州 510405)
尽管胃癌的治疗取得了重大进展,但其仍是全球最致命的癌症之一。胃癌是一种局部性疾病,淋巴结转移和血源性转移是其易位的重要途径[1-2]。化疗是防止胃癌细胞侵袭和转移的重要手段,然而由于严重的毒副作用、不良反应及耐药性,胃癌患者生活质量较差、复发率高、五年存活率较低。近年来,从天然产物中寻找有效、安全的抗肿瘤药物已成为研究的热点。蔓荆子黄素(vitexicarpin)是从马鞭草科植物单叶蔓荆果实中提取的一种多甲氧基黄酮,是蔓荆子的主要活性成分,一直被用于抗炎和癌症治疗[3]。现有研究表明,蔓荆子黄素通过抑制增殖、诱导周期阻滞和凋亡、抑制侵袭转移在乳腺癌、结肠癌、食管癌等多种恶性肿瘤中发挥广泛的抗癌药理活性[4-6]。然而,蔓荆子黄素在胃癌中的作用和潜在分子机制并未完全阐明。微小RNA(miR)-1193是近年发现的抑癌基因,乳腺癌中miR-1193表达降低,上调miR-1193表达能够降低癌细胞的增殖和迁移能力[7]。然而,miR-1193在胃癌中是否具有抑癌作用、蔓荆子黄素如何调控miR-1193发挥作用尚不明确。本研究通过探讨蔓荆子黄素对胃癌细胞增殖、凋亡及miR-1193表达的影响,分析其可能的作用机制,以期为蔓荆子黄素用于防治胃癌提供科学依据。
1 材料与方法
1.1 材料胃癌细胞AGS购自美国模式培养物保藏所;胎牛血清、青链霉素双抗、RPMI1640培养基购自美国Hyclone公司;蔓荆子黄素(纯度≥98%,批号:20190215)购自四川维克奇生物科技有限公司;miR-1193模拟物(miR-1193 mimics)、模拟物阴性对照(miR-NC)、miR-1193抑制物(anti-miR-1193)、抑制物阴性对照(anti-miR-NC)、PCR引物由广州锐博生物公司提供;膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)凋亡检测试剂盒购自上海贝博生物公司;miRNA提取试剂盒、反转录试剂盒、通用PCR Master Mix购自北京天根生化科技有限公司;细胞计数试剂盒(CCK-8)、细胞周期素D1(CyclinD1)兔单克隆抗体(批号:20190411)、p21兔单克隆抗体(批号:20190302)、B细胞淋巴瘤-2(Bcl-2)兔单克隆抗体(批号:20190111)、Bcl相关X蛋白(Bax)兔多克隆抗体(批号:20190408)、磷酸甘油醛脱氢酶(GAPDH)兔多克隆抗体(批号:20190322)、羊抗兔IgG二抗(批号:20190228)购自上海碧云天生物科技研究所。
1.2 方法
1.2.1 细胞培养和分组AGS细胞采用补充10%胎牛血清、1%青链霉素双抗的RPMI1640培养基在37℃、5%CO2、湿度97%的培养箱中培养。当细胞70%融合时,胰酶消化,按照1∶3比例传代,2 d换液1次。收集第3代对数期AGS细胞进行实验。蔓荆子黄素用二甲基亚砜溶解,初始浓度为1.0×104μmol/L,-20℃保存备用,实验时稀释至所需浓度。用终浓度分别为10、20、40 μmol/L的蔓荆子黄素培养液孵育AGS细胞48 h,分别命名为蔓荆子黄素-低组、蔓荆子黄素-中组和蔓荆子黄素-高组。对照组用含同等浓度的二甲基亚砜孵育48 h。利用脂质体转染法将miR-NC、miR-1193 mimics分别转染至AGS细胞,分别命名为miR-NC组、miR-1193组。将anti-miR-NC、anti-miR-1193分 别转 染 至AGS细胞,用终浓度为40 μmol/L的蔓荆子黄素培养液转染细胞48 h,分别命名为蔓荆子黄素+anti-miR-NC组、蔓荆子黄素+anti-miR-1193组。
1.2.2 CCK-8法测定细胞活力将未转染的AGS细胞接种于96孔板,贴壁后用含10、20、40 μmol/L蔓荆子黄素的培养液(100 μl/孔)培养箱孵育48 h[8];将转染miR-NC或miR-1193 mimics的AGS细胞接种于96孔板,培养48 h。将转染anti-miR-NC或antimiR-1193的AGS细胞接于种96孔板,贴壁后用含40 μmol/L蔓荆子黄素的培养液(100 μl/孔)培养箱孵育48 h,设置3个复孔。每孔加入10 μl的CCK-8溶液,再培养2 h。酶标仪在450 nm处测量吸光度(A)值。增殖抑制率(%)=(1-A实验组/A对照组)×100%。
1.2.3 流式细胞术检测细胞凋亡收集各组AGS细胞,PBS洗涤1次。1 500 r/min离心5 min。将细胞重悬于500 μl 1×结合缓冲液中,加入5 μl Annexin VFITC和PI在室温孵育30 min。流式细胞术检测细胞总凋亡率。
1.2.4 Western blot检测CyclinD1、p21、Bcl-2和Bax蛋白表达放射缓冲液冰上裂解细胞,收集上清即为细胞蛋白。测定蛋白浓度后,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白质,并转移至聚偏二氟乙烯膜。5%脱脂牛奶室温封闭膜30 min,加入针对CyclinD1、p21、Bcl-2、Bax和GAPDH的特异性一抗4℃孵育过夜。室温下将膜与二抗孵育1 h。化学发光试剂盒检测条带信号,Image J软件通过检测各条带光密度值分析目的蛋白表达水平。
1.2.5 实时荧光定量PCR(RT-qPCR)检测miR-1193表达试剂盒提取miRNA,反转录为cDNA后,采用通用PCR Master Mix和相应引物进行RT-qPCR,2-ΔΔCt法分 析miR-1193表 达水 平。miR-1193 F:5'-GCCGAGGCACTTCATTTA-3',R:5'-CTCAACTGGT⁃GTCGTGGA-3';U6 F:5'-CTCGCTTCGGCAGCACA-3',R:5'-AACGCTTCACGAATTTGCGT-3'。
1.3 统计学分析采用SPSS22.0软件进行统计分析。数据以±s表示。采用独立样本t检验比较两组间差异;采用单因素方差法比较多组间差异,进一步组内两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 蔓荆子黄素对胃癌AGS细胞增殖的影响与对照组相比,蔓荆子黄素-低、中、高组AGS细胞增殖抑制率、p21蛋白表达显著升高,CyclinD1蛋白表达显著降低(P<0.05)。蔓荆子黄素-低、中、高3组间以上指标差异均有统计学意义(P<0.05)。见图1、表1。
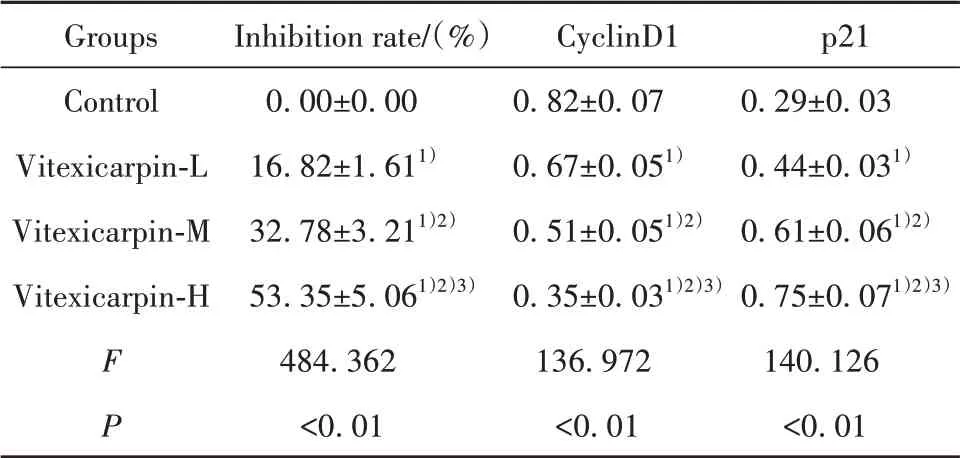
表1 蔓荆子黄素对胃癌AGS细胞增殖的影响(xˉ±s,n=9)Tab.1 Effect of vitexicarpin on proliferation of gastric cancer AGS cells(xˉ±s,n=9)

图1 增殖相关蛋白表达Fig.1 Expressions of proliferation-related proteins
2.2 蔓荆子黄素对胃癌AGS细胞凋亡的影响与对照组相比,蔓荆子黄素-低、中、高组AGS细胞凋亡率、Bax蛋白表达显著升高,Bcl-2蛋白表达显著降低(P<0.05)。蔓荆子黄素-低、中、高3组间以上指标差异均有统计学意义(P<0.05)。见图2、表2。
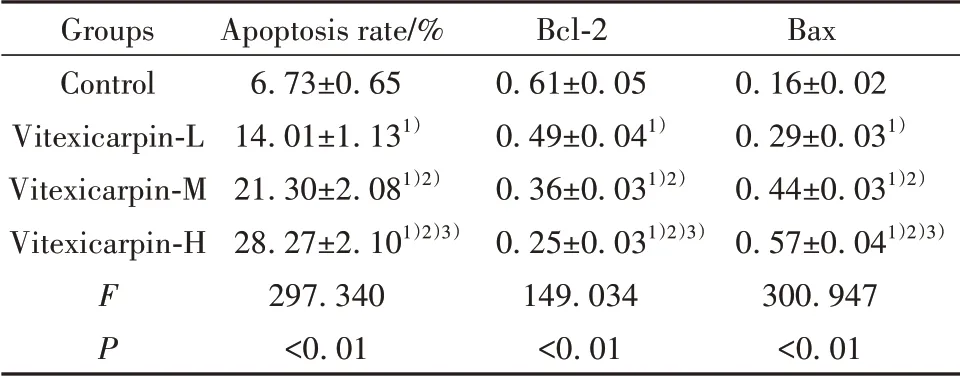
表2 蔓荆子黄素对胃癌AGS细胞凋亡和凋亡相关蛋白表达的影响(xˉ±s,n=9)Tab.2 Effect of vitexicarpin on apoptosis and apoptosis related protein expressions of gastric cancer AGS cells(xˉ±s,n=9)

图2 蔓荆子黄素对胃癌AGS细胞凋亡的影响Fig.2 Effect of vitexicarpin on apoptosis of gastric cancer AGS cells
2.3 蔓荆子黄素对胃癌AGS细胞中miR-1193表达的影响与对照组相比,蔓荆子黄素-低、中、高组AGS细胞miR-1193表达显著升高(P<0.05)。蔓荆子黄素-低、中、高3组间miR-1193表达差异均有统计学意义(P<0.05)。见表3。
表3 蔓荆子黄素对胃癌AGS细胞中miR-1193表达的影响(±s)Tab.3 Effect of vitexicarpin on expression of miR-1193 in gastric cancer AGS cells(±s)

表3 蔓荆子黄素对胃癌AGS细胞中miR-1193表达的影响(±s)Tab.3 Effect of vitexicarpin on expression of miR-1193 in gastric cancer AGS cells(±s)
Note:Compared with Control group,1)P<0.05;compared with Vitexi⁃carpin-L group,2)P<0.05;compared with Vitexicarpin-M group,3)P<0.05.
Groups Control Vitexicarpin-L Vitexicarpin-M Vitexicarpin-H F P n9 9 9 9 miR-1193 1.00±0.08 1.75±0.161)2.56±0.221)2)3.24±0.281)2)3)214.464<0.01
2.4 上调miR-1193对胃癌AGS细胞增殖和凋亡的影响与miR-NC组相比,miR-1193组AGS细 胞miR-1193表达、增殖抑制率、凋亡率、Bax和p21蛋白表达显著升高,CyclinD1和Bcl-2蛋白表达显著降低(P<0.05)。见图3、表4。

表4 miR-1193过表达对胃癌AGS细胞增殖和凋亡的影响(xˉ±s,n=9)Tab.4 Effect of miR-1193 overexpression on proliferation and apoptosis of gastric cancer AGS cells(xˉ±s,n=9)

图3 上调miR-1193对胃癌AGS细胞增殖和凋亡的影响Fig.3 Effect of miR-1193 up-regulation on proliferation and apoptosis of gastric cancer AGS cells
2.5 下调miR-1193逆转了蔓荆子黄素(40 μmol/L)对胃癌AGS细胞增殖和凋亡的作用与蔓荆子黄素+anti-miR-NC组相比,蔓荆子黄素+anti-miR-1193组AGS细 胞miR-1193组AGS细胞miR-1193表达、细胞增殖抑制率、凋亡率、Bax和p21蛋白表达显著降低,CyclinD1和Bcl-2蛋白表达显著升高(P<0.05)。见表5、图4。
表5 下调miR-1193逆转了蔓荆子黄素对胃癌AGS细胞增殖和凋亡的作用(±s,n=9)Tab.5 Down-regulation of miR-1193 reversed the effect of vitexicarpin on proliferation and apoptosis of gastric cancer AGS cells(±s,n=9)

表5 下调miR-1193逆转了蔓荆子黄素对胃癌AGS细胞增殖和凋亡的作用(±s,n=9)Tab.5 Down-regulation of miR-1193 reversed the effect of vitexicarpin on proliferation and apoptosis of gastric cancer AGS cells(±s,n=9)
Note:Compared with Vitexicarpin+anti-miR-NC group,1)P<0.05.
Groups Vitexicarpin+anti-miR-NC Vitexicarpin+anti-miR-1193 t P miR-1193 1.00±0.07 0.57±0.041)16.000<0.01 Inhibition rate/%54.03±4.66 17.58±1.641)22.135<0.01 Apoptosis rate/%29.13±2.86 11.73±1.101)17.035<0.01 CyclinD1 protein 0.34±0.03 0.71±0.061)16.547<0.01 p21 protein 0.77±0.05 0.41±0.041)16.867<0.01 Bcl-2 protein 0.24±0.02 0.49±0.041)16.771<0.01 Bax protein 0.59±0.05 0.27±0.031)16.464<0.01

图4 下调miR-1193逆转了蔓荆子黄素对胃癌AGS细胞增殖和凋亡的作用Fig.4 Down-regulation of miR-1193 reversed the effect of vitexine on proliferation and apoptosis of gastric cancer AGS cells
3 讨论
几千年来,中草药已被广泛应用于各种疾病的治疗,包括癌症。蔓荆子黄素作为蔓荆子中主要黄酮类化学成分,具有明确的抗肿瘤特性,其通过调节原癌基因、抑癌基因表达和细胞内信号通路抑制癌细胞生长、侵袭和转移,诱导细胞凋亡,具有肿瘤治疗替代品潜力[9]。研究显示,蔓荆子黄素可引起口腔癌、肺癌细胞形态学改变、DNA聚集和损伤,影响DNA修复进而抑制细胞存活并诱导细胞凋亡[10-11]。蔓荆子黄素通过抑制磷酸肌醇3激酶(PI3K)激活还可抑制鼻咽癌的进展[12]。此外,蔓荆子黄素还可抑制DNMT1活性、增加miR-148a-3p表达进而抑制肝癌细胞的干细胞特性[13]。本研究探讨蔓荆子黄素在胃癌中的抗肿瘤作用显示,蔓荆子黄素可显著抑制AGS增殖,诱导细胞凋亡,并呈一定的量效关系,与XIE等[14]报道其在口腔鳞癌中抗增殖作用一致。p21是细胞周期调控过程中一种负性调节因子,其通过抑制CyclinD1/细胞周期素依赖激酶(CDK4)复合体的活性在阻碍细胞周期从G1到S期中发挥关键作用,是重要的抗增殖因子[15]。细胞凋亡是一个受多种因素调控的复杂过程,Bcl-2位于线粒体外膜,其通过抑制细胞色素C从线粒体的释放来阻止细胞凋亡,而Bax具有相反作用,蔓荆子黄素通过下调CyclinD1、Bcl-2表达,上调Bax表达对胆管癌细胞具有显著的增殖抑制和凋亡诱导作用[16]。本研究显示,蔓荆子黄素呈剂量依赖效应降低CyclinD1、Bcl-2表达水平,升高p21和Bax表达水平,进一步证实蔓荆子黄素在胃癌中的抗增殖和促凋亡作用。
miRNA是一类长度为18~22个核苷酸的新型非编码RNA分子,其通过负性调控下游基因表达在细胞生长、发育、代谢等多种生物学过程中发挥重要作用,其表达失衡与胃癌等肿瘤的发生有关[17]。miR-1193参与调控细胞增殖和迁移,其表达降低对皮肤鳞状细胞癌、T细胞白血病发生具有促进作用[18-19]。本研究显示,蔓荆子黄素可显著升高AGS细胞中miR-1193的表达水平,提示蔓荆子黄素在胃癌中的抗肿瘤作用可能与上调miR-1193有关。分析miR-1193在AGS细胞中的作用发现,上调miR-1193可显著降低AGS细胞的增殖能力,促进细胞凋亡。此外,下调miR-1193表达还可逆转蔓荆子黄素对AGS细胞增殖和凋亡的影响。提示蔓荆子黄素对AGS细胞的增殖抑制和凋亡促进作用与上调miR-1193表达有关。
综上所述,蔓荆子黄素能够抑制胃癌细胞增殖,诱导细胞凋亡,其机制与上调miR-1193表达有关,这丰富了蔓荆子黄素的抗肿瘤机制,为蔓荆子黄素在胃癌防治中的应用提供了科学依据。

