植物生长调节剂对米槁愈伤组织诱导、组培苗生根的影响
刘济明,张 兰,武梦瑶a,彭 靓,吴婷婷,田 秀,廖小锋
(1.贵州大学 a.林学院;b.森林生态研究中心,贵州 贵阳 550025;2.贵州科学院 山地资源研究所,贵州 贵阳 550025)
米槁Cinnamomum migaoH.W.Li 系樟科Lauraceae 樟属植物,其干燥成熟果实大果木姜子是贵州特色药材[1-2],贵州民间常用于治疗腹胀、腹痛、晕车呕吐等疾病。米槁果实能够和其他药材制成理气活血滴丸,在临床上对冠心病、心绞痛患者有明显的缓解作用[3-4]。但目前米槁资源稀缺,主要分布于滇黔桂交界地区[5],长期以来对米槁进行不合理的乱砍滥伐,长期只收不种、不保护的恶性做法,导致米槁果实资源匮乏,药源紧缺[6]。由于米槁果实的药用价值使它在市场上的需求量极大,野生资源却极其稀缺,所以人工栽培是解决供需矛盾的关键手段。无性繁殖对于快速繁殖苗木具有很好的应用前景,能够快速获得遗传基因一致的苗木,是优良种源繁殖的关键手段,目前扦插和组培技术最为成熟。本课题组之前对米槁扦插繁殖技术进行了研究,米槁属难生根树种,在米槁扦插繁殖过程中仍存在难生根的现象,且扦插成功需要插穗快速形成不定根,否则插穗就会因长时间暴露在恶劣环境中或者遭遇病虫害而导致组织坏死;对米槁进行扦插发现在插穗生根过程中存在对生根起抑制作用的物质[7-8]。组培技术是否能够克服上述障碍,快速获得大量米槁优良苗木,值得探索。植物组织培养的研究,始于1920年德国植物学家Haberlandt 首次提出细胞具有全能性的概念,从20 世纪60年代至今一直处于迅速发展的阶段[9]。目前,已经制定了人参、三七、柴胡、甘草、丹参、雷公藤和许多种药用植物的不定根培养体系,且已经成功地应用于大规模培养[10]。植物生长调节剂是指人工合成的具有与植物激素类似生理效应的化学物质,比天然植物激素有更高的活性。促进植物生根的植物生长调节剂有IAA、IBA、NAA、2,4-D等[11],但不同植物所需要的种类与质量浓度和处理时间都存在一定差异,没有固定的用法和用量[12]。不同植物生长调节剂对墨脱花椒扦插生根的研究发现,NAA 有利于其插穗不定根的形成,IBA 有利于不定根的伸长,二者混合使用效果更佳[13]。本研究通过组织培养研究不同植物生长调节剂质量浓度组合对米槁愈伤组织诱导、组培苗生根的影响,探究米槁愈伤组织诱导、组培苗生根的最佳植物生长调节剂和质量浓度配比选择,筛选出米槁愈伤组织诱导、组培苗生根的最佳培养基,提高米槁的幼苗成活率,有效地保护米槁资源[7],为米槁工厂化育苗提供理论依据,丰富米槁的无性繁殖体系,加速米槁苗木的生产,满足市场的需求。
1 材料与方法
1.1 试验材料
愈伤组织诱导材料采自贵州大学林学院播种栽培的2年生优质米槁植株,选取当年生生长健壮、未木质化或半木质化的叶片为外植体;组培苗生根材料选用米槁带芽茎段诱导的不定芽。
1.2 试验方法
1.2.1 培养条件
参考樟科樟属其他树种组织培养的培养基配方,本试验诱导培养和增殖选用MS 培养基为基本培养基,生根培养选用1/2MS 培养基为基本培养基。分别加入30 g/L 蔗糖、6.5~7.0 g/L 琼脂、不同种类和不同质量浓度的生长调节剂和不同质量浓度的AC 进行培养基的配制,培养基pH 值为5.8。生根培养条件为:温度25±2℃,每日光照时间为12~14 h,日光灯光源,100%光照强度1 500~2 000 lx。愈伤组织诱导培养的培养条件为:温度25±2℃,暗培养。
1.2.2 消毒剂与植物生长调节剂种类
75%酒精+0.1% HgCl2+7 min为最佳消毒方式,其外植体污染率最低。植物生长调节剂种类选择6-BA、IBA、NAA 及2,4-D。
1.3 试验设计
1.3.1 米槁愈伤组织诱导试验设计
米槁在2,4-D 与6-BA、NAA 组合处理下愈伤组织诱导效果较好,2,4-D 质量浓度为1.0、3.0、5.0 mg/L,6-BA 质量浓度为1.0、2.0、3.0 mg/L,NAA 质量浓度为0.1、0.3、0.5 mg/L,采用3 因素3 水平随机设计,具体见表1。将米槁叶片消毒好后接种至不同植物生长调节剂质量浓度组合的MS培养基中,每个处理接种20 瓶,每瓶1~2 个叶片,重复3 次,30 d 后统计结果。
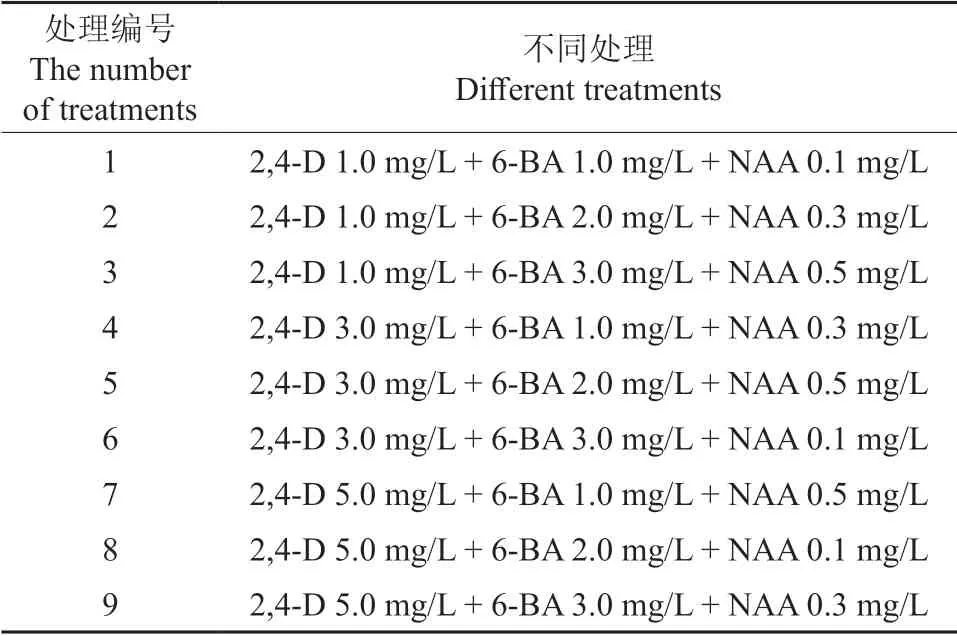
表1 米槁愈伤组织诱导试验设计Table 1 Experimental design of C.migao callus induction
1.3.2 米槁组培苗生根培养试验设计
参考其他樟科樟属植物的组织培养生根培养基配方,选用NAA 与IBA 对米槁不定芽进行生根培养,同时在培养基中添加不同质量浓度的AC。NAA 质量浓度为0.1、0.5、1.0 mg/L,IBA 质量浓度为0.1、1.0、3.0 mg/L,AC 质量浓度为0、0.2、0.5 g/L,采用3 因素3 水平随机设计,试验设计见表2。将米槁不定芽消毒好后接种至不同植物生长调节剂质量浓度组合的1/2MS 培养基中,每个处理接种20 瓶,每瓶1~2 个不定芽,重复3 次。

表2 米槁组培苗生根试验设计Table 2 Experimental design of C.migao culture seedling rooting
1.4 数据处理
用Microsoft Excel 2016 软件对数据进行初期统计与汇总,应用SPSS 25 软件对数据进行统计分析,显著性水平设定为α=0.05 和α=0.01,采用Duncan’s 法进行多重比较;采用单因素方差分析、多因素方差分析不同种类及质量浓度植物生长调节剂对米槁愈伤组织诱导率、组培苗生根率的影响。
2 结果与分析
2.1 不同种类及质量浓度植物生长调节剂对米槁愈伤组织诱导的影响
不同种类及质量浓度植物生长调节剂对米槁叶片愈伤组织诱导结果见表3。由表3可知,处理6、8 无显著差异,处理2 除与1、5、7、9 处理有显著差异之外,其余处理均无显著差异;除处理7和9 与处理2 有极显著差别外,其他处理下愈伤组织诱导率并无极显著差别。其中平均诱导率最高的组合为处理2,诱导率达到了81.25%,其次诱导率较高的为处理3,诱导率达到了80.00%。进一步对不同质量浓度的2,4-D、6-BA、NAA 做方差分析,结果见表4。由表4可知,不同质量浓度的2,4-D 对愈伤组织诱导率的影响均呈现出显著差异(P<0.05),说明不同质量浓度的2,4-D 对愈伤组织诱导均存在差异性,随着2,4-D 质量浓度的升高,其诱导率降低,且质量浓度越大对愈伤组织诱导的抑制作用越明显。而不同质量浓度的6-BA和NAA 对愈伤组织诱导率无明显差异,6-BA 和NAA 随着质量浓度的升高呈现出诱导率升高再降低的情况,当6-BA 质量浓度为3.0 mg/L 和NAA质量浓度为0.3 mg/L 时,其诱导率最高,所以中质量浓度的6-BA 和NAA 适合米槁叶片愈伤组织诱导培养。综上可知,采用此正交试验设计,不同质量浓度的2,4-D 对米槁叶片愈伤组织诱导影响最大,最适合米槁叶片愈伤组织生长的培养基组合为MS+2,4-D 1.0 mg/L+6-BA 2.0 mg/L+NAA 0.3 mg/L,在此植物生长调节剂组合质量浓度下诱导率最高,达到了81.25%,且在此组合培养基中诱导的愈伤组织颜色稍偏浅绿色,容易松散,不紧密,细胞排列疏松,脱分化程度较高(图1)。

图1 米槁叶片愈伤组织诱导Fig.1 The callus induction of C.migao leaves
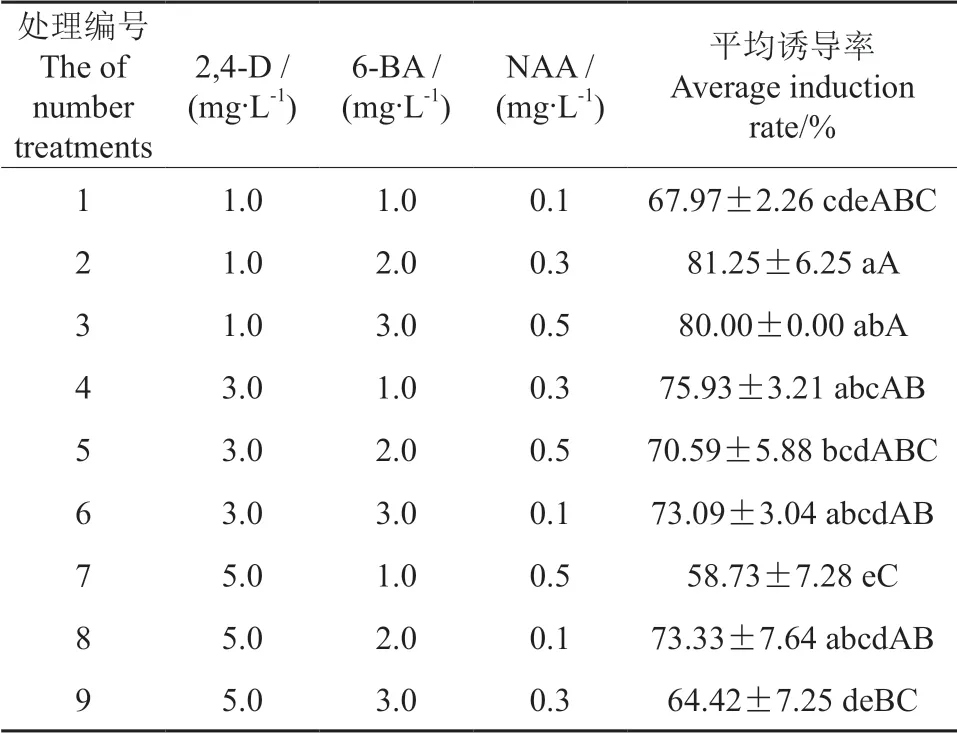
表3 不同种类及质量浓度植物生长调节剂对米槁愈伤组织诱导的试验结果†Table 3 The test results of the callus induction of C.migao with different kinds and concentrations of plant growth regulators
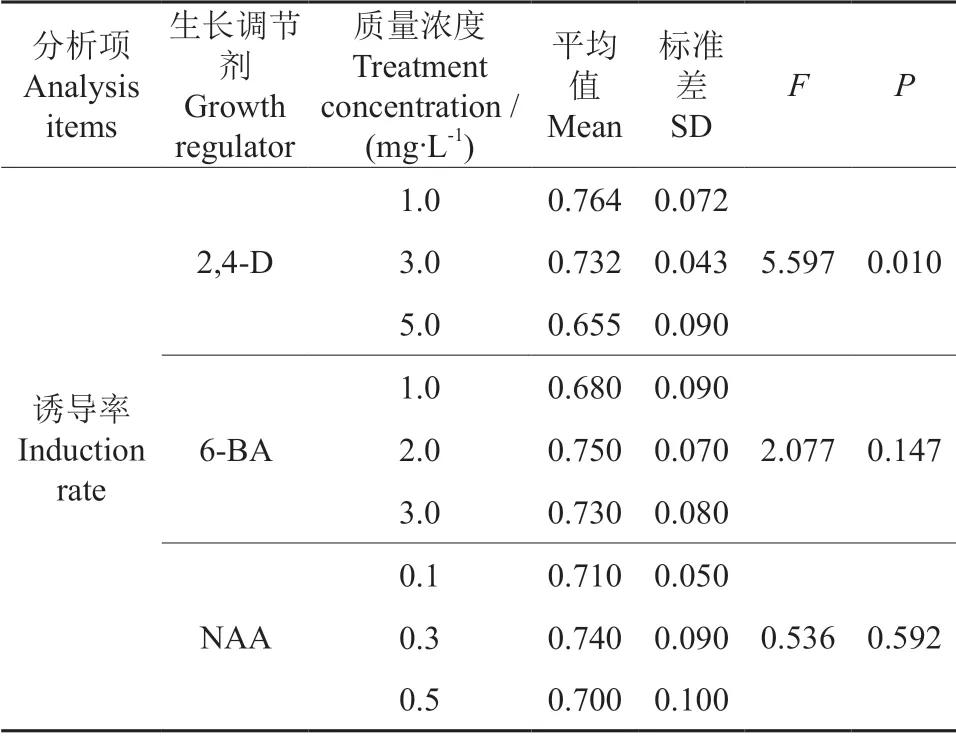
表4 不同质量浓度的2,4-D、6-BA、NAA 对米槁愈伤组织诱导影响的方差分析Table 4 The variance analysis of effects of different 2,4-D,6-BA,NAA concentrations on the callus induction of C.migao
为了解不同种类的植物生长调节剂之间对米槁叶片愈伤组织的交互作用,对其做多因素方差分析,结果见表5。由表5可知,2,4-D 对米槁叶片愈伤组织的诱导存在极显著差异(P<0.01),6-BA 对愈伤组织的诱导存在显著差异(P<0.05),NAA 对愈伤组织诱导无明显差异,说明2,4-D 和6-BA 是影响米槁愈伤组织诱导的两个主要因素。2,4-D 和NAA,NAA 和6-BA、2,4-D,6-BA 和NAA的交互作用存在极显著差异,而2,4-D和6-BA的交互作用存在显著差异。
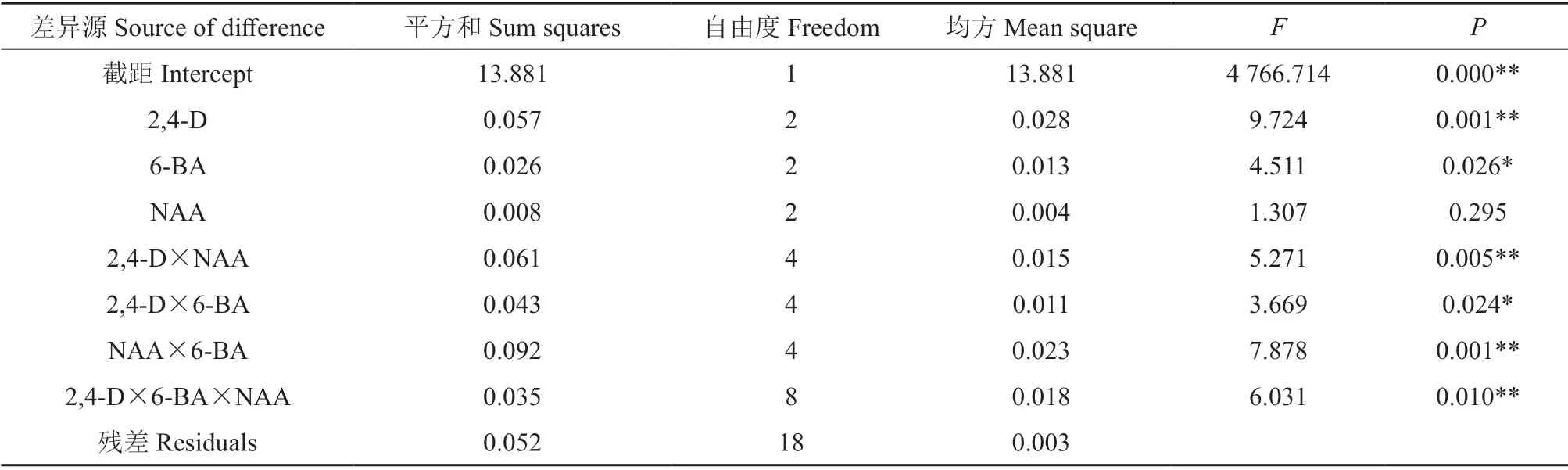
表5 不同种类植物生长调节剂对米槁愈伤组织诱导影响的方差分析†Table 5 The variance analysis of effects of different plant growth regulators on the callus induction of C.migao
2.2 不同种类及质量浓度植物生长调节剂对米槁组培苗生根的影响
组培苗生根材料为米槁带芽茎段诱导的不定芽,其增殖情况见图2。将消毒好的米槁不定芽外植体接种于不同植物生长调节剂质量浓度组合的1/2MS 培养基上培养,大概40 d 后长出根系,观察并记录根系生长情况,结果见表6。由表6可知,处理1、3、5、7、9 米槁不定芽生根率无明显差异,处理4 与所有组别处理都存在显著差异,处理2、6、8 之间无显著差异。处理1、2、3、5、6、7、9 之间无极显著差异,处理4 与处理2、6、8、9 存在极显著差异,其余均无显著差异。其中平均生根率最高的组合为处理4,达到了72.38%。为进一步了解不同种类及质量浓度的植物生长调节剂对米槁不定芽组培苗生根的影响,对不同质量浓度的NAA、IBA、AC 做方差分析,结果见表7。由表7可知,不同质量浓度的IBA 和AC 对米槁不定芽组培苗生根均有显著差异(P<0.05),不同质量浓度NAA 处理对米槁组培苗生根无显著性差异,说明IBA 和AC 是米槁组培苗生根的重要因素。随着IBA 质量浓度的升高,生根率呈现先降低后升高的情况,但并没有超过质量浓度为0.1 mg/L的生根率;NAA 和AC 对米槁组培苗生根的影响均为先上升再下降,因此NAA 质量浓度为0.5 mg/L、IBA 为0.1 mg/L、AC 为0.2 g/L 时,米槁不定芽组培苗的生根率最高。综上所述,采用此正交试验设计,最适合米槁不定芽组培苗生根的培养基组合是1/2 MS + NAA 0.5 mg/L + IBA 0.1 mg/L + AC 0.2 g/L,在此组合条件下平均生根率最高,达到了72.38%;且在此组合处理下组培苗根系生长状况最好,生根较早,根系繁密,有须根,根长较长;而其他处理下生根较晚,根系数量稀少,根系粗短、粗壮(图3)。

图3 米槁组培生根苗Fig.3 Rooting of tissue culture seedlings of C.migao
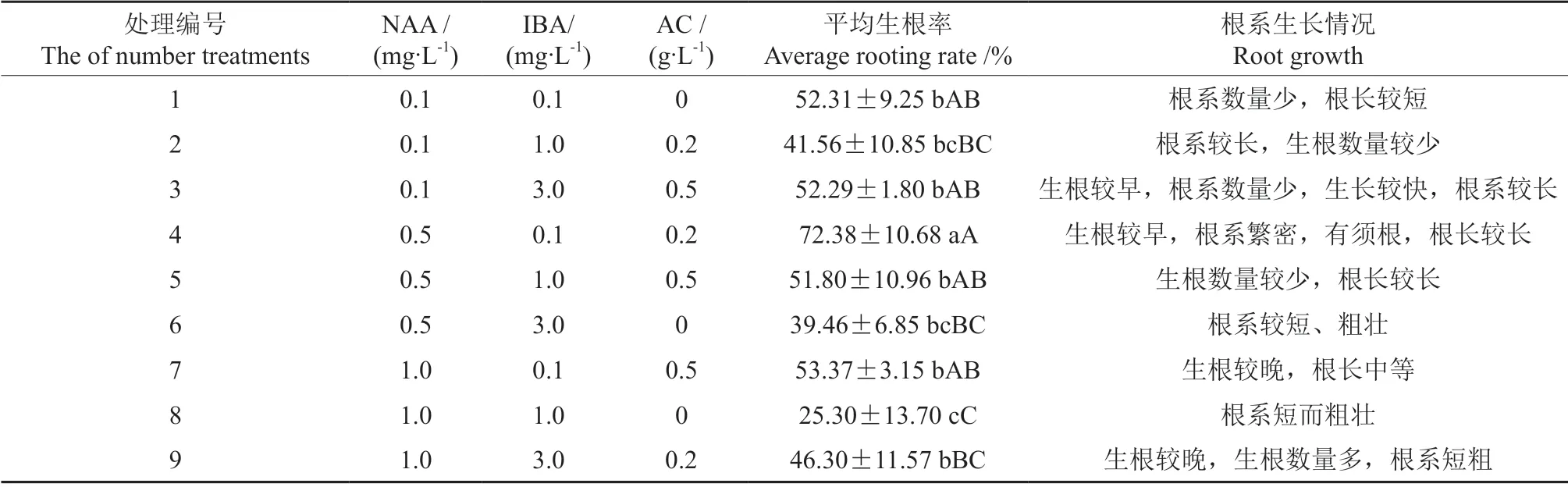
表6 不同种类及质量浓度植物生长调节剂对米槁组培苗生根的影响Table 6 Effects of treatment with different kinds and concentrations of plant growth regulators on the rooting of C.migao

表7 不同质量浓度NAA、IBA、AC 对米槁组培苗生根影响的方差分析Table 7 The variance analysis of effects of different NAA,IBA,AC concentrations on the rooting of C.migao

图2 米槁不定芽增殖Fig.2 Adventitious bud proliferation of C.migao
3 讨论与结论
米槁是我国特有的药用木本植物,主要分布于我国西南部,在我国已经被《中国生物多样性红色物种名录▪高等植物卷》列为近危物种,而苗木的缺乏被认为是种群退化的重要原因[2],其药用价值使得米槁在市场上供不应求,而野生资源又极其匮乏,现已有的米槁扦插繁殖相关研究能够一定程度上解决米槁快速繁殖的技术问题,组织培养能够缩短植物繁殖周期,提高苗木产量,保护其遗传稳定性[14]。愈伤组织诱导分化不定芽是组织培养中的一个难点,而生根培养是组织培养中的一个重要环节,组培生根苗的质量直接会影响到移栽苗的成活率,进而决定种苗培育的成本,因此为了提高最后移栽成苗的存活率,其愈伤组织诱导和组培苗生根的培养基、植物生长调节剂种类及其质量浓度配比、外植体的选择都至关重要[15]。本研究报道了不同种类及质量浓度植物生长调节剂对米槁叶片愈伤组织诱导、组培苗生根的影响,2,4-D 和6-BA 是影响愈伤组织诱导的两个主要因素,其配比和质量浓度变化影响着愈伤组织的诱导率;IBA 和AC 是影响组培苗生根的重要因素,其配比和质量浓度变化也影响着组培苗的生根率。
每种植物都有独特的最佳诱导培养基,外植体的类型以及植物的生长调节剂在一定程度上都会影响愈伤组织的形成[16],而外植体的选择对愈伤组织的诱导起决定性作用,在以杉木Cunninghamia lanceolata的叶片、茎段、子叶、下胚轴为外植体在MS 培养基上进行愈伤组织的诱导时,其外植体诱导形成愈伤组织的能力为叶片>茎段>子叶>下胚轴,且2,4-D 和6-BA 配比直接影响愈伤组织的生长速度和特性[17]。以油茶Camellia oleifera花药为外植体,植物生长调节剂NAA、2,4-D 和6-BA 配合使用可有效诱导愈伤组织的形成,2,4-D 与6-BA 质量浓度组合为2.0、0.5 mg/L时诱导效果最佳,且2.0 mg/L 2,4-D 具有明显的抑菌作用[18]。以樟树Cinnamonum camphora未成熟的合子胚为外植体,分别在添加了2,4-D 和6-BA、2,4-D 和NAA 的MS 培养基上进行愈伤组织诱导,在添加了2,4-D 和6-BA 的培养基上愈伤组织诱导效果更好[19];以樟树叶片为外植体时最佳诱导生长调节剂组合为NAA 和6-BA[20]。以山东抗寒香樟叶片为外植体,在MS 培养基上添加6-BA 与2,4-D质量浓度配比为1∶4的植物生长调节剂组合,能够提高诱导率,并且愈伤组织的颜色较浅,表面更湿润、疏松[21]。植物组织培养中的愈伤组织分化成为不定芽是一个难点,本研究未成功将愈伤组织分化形成不定芽,可能是由于选用的生长调节剂6-BA 与NAA 并不适宜愈伤组织分化成芽,也可能是并未找到适宜的质量浓度配比。本试验中选用的植物生长调节剂种类有限,后期研究中可进一步扩大其种类的选择范围,探究其他植物生长调节剂种类对米槁叶片愈伤组织诱导的影响。同时,还可研究米槁带芽茎段、叶柄、根等其他外植体诱导形成愈伤组织的能力。本研究仅局限于研究愈伤组织的诱导率,没有做质量评价,这也有可能是愈伤组织没有分化成为不定芽的一个原因。愈伤组织的质量是其分化为不定芽的一个重要原因,下一步的研究方向不仅是研究不同植物生长调节剂、不同外植体对愈伤组织的影响,还应该注重愈伤组织的质量评价。
生根培养是米槁成功进行组织培养的决定性环节,是不定芽成功炼苗并栽种至基质中的关键一步,诱导的植物生根数量及根系质量一定程度上决定着移栽成活率[14]。在生根培养中,植物生长调节剂的质量浓度配比、组培苗材料的质量都对生根培养起着关键作用,本研究选择米槁带芽茎段诱导的不定芽为生根培养材料,在1/2 MS 培养基上添加不同质量浓度的IBA、NAA 和AC,结果发现IBA 和AC 是影响生根的两个主要因素。银白杨Populus alba不定芽诱导生根1/2 MS培养基的生根率明显高于MS 和WPM 培养基,不同质量浓度的IBA 和NAA 都能使银白杨不定芽生根,且低质量浓度更容易生根,IBA 处理生根率高于NAA[12]。在构树Broussonetia papyrifera的组培苗生根培养中不同培养基生根效果表现为1/2 MS>1/4 MS> MS,NAA 的生根效果优于IAA 和IBA,IBA 质量浓度增大将会抑制构树的生根,且有落叶及愈伤组织增多的现象[22]。NAA和IBA 均对诱导‘紫玉’紫薇生根有显著影响,但NAA 处理生根率更高,生根数更多,根长更长[23]。本研究发现IBA 是诱导米槁不定芽生根的重要因素,且较低质量浓度的IBA 更容易促进生根,这与欧洲花楸Sorbus aucuparia、海南冬青Ilex hainanensisMerr.、桃Prunus persica等植物的研究结果相似,较高质量浓度的IBA 会对组培苗生根起抑制作用,使生根率降低且容易诱导愈伤组织生长[24-26]。AC 在组织培养中可提供黑暗环境,利于根的诱导和根系生长,防止褐变。在秋子梨Pyrus ussuriensis的生根培养基中加入AC,其组培苗生根率、生根数和根长都高于未添加AC 的培养基[27]。在对抗风桐Pisonia grandis的研究发现,在培养基中添加AC,获得的组培苗移栽成活率更高[28]。本研究发现,AC 质量浓度的增加可以提高米槁的生根率。可继续增加米槁生根培养中AC 的质量浓度,对于米槁生根率的变化情况、AC 能否缩短组培苗时间和移栽苗木等做进一步研究;也可研究单一的植物生长调节剂对米槁生根的影响、组培苗生根的移栽成活率,为大量繁殖米槁苗木、丰富无菌苗提供技术支持。
综上所述,本研究发现2,4-D 与6-BA 是影响米槁叶片愈伤组织诱导的两个主要因素,其配比和质量浓度变化影响米槁叶片愈伤组织的诱导率。低质量浓度的2,4-D 更适宜米槁叶片愈伤组织的诱导;质量浓度越高,愈伤组织的抑制率越大。IBA和AC 是影响米槁生根率的主要因素,低质量浓度IBA、中质量浓度NAA 和AC 适合生根培养。采用此正交试验设计得出的米槁叶片愈伤组织最适培养基为MS 培养基+2,4-D 1.0 mg/L+6-BA 2.0 mg/L+NAA 0.3 mg/L+琼脂6.5 g/L +蔗糖30 g/L,米槁不定芽最佳生根培养基为1/2 MS + NAA 0.5 mg/L+IBA 0.1 mg/L+AC 0.2 g/L+琼脂7 g/L+蔗糖30 g/L。

