地诺单抗生物类似药的N-糖型优化
殷龙 贾艳丽 姚月琴 张俭 谭小钉
摘 要 目的:使用糖型调节试剂优化地诺单抗(denosumab)生物类似药的N-糖基化修饰,使其主要糖型G0F和G1F的比例与地诺单抗高度类似。方法:利用单因素和DOE试验方法,考察不同浓度氯化锰、半乳糖及尿苷对地诺单抗生物类似药糖基化修饰的影响。结果:经过单因素试验、DOE分析及200 L细胞培养工艺放大,确定糖型调节剂氯化锰和半乳糖的最佳用量分别是150 mmol/L和35.56 mmol/L。结论:使用糖型调节剂氯化锰和半乳糖能有效调节地诺单抗生物类似药的糖基化修饰比例,可为其他单抗生物类似药生产工艺的优化提供借鉴。
关键词 生物类似药 糖基化 细胞培养
中图分类号:TQ460.62; TQ464.7 文献标志码:A 文章编号:1006-1533(2022)03-0077-05
N-glycosylation optimization for biosimilar denosumab
YIN Long, JIA Yanli, YAO Yueqin, ZHANG Jian, TAN Xiaoding
(Jiangsu Mabwell Health Pharmaceutical R&D Co., Ltd., Taizhou 225300, China)
ABSTRACT Objective: To optimize the N-glycosylation of denosumab biosimilar using some glycosylation reagents so as to make the proportion of G0F and G1F be highly similar to denosumab. Methods: The effects of the different concentrations of manganese chloride、galactose and uridine on the glycosylation of denosumab biosimilar were studied by single factor and DOE assays. Results: A preferred combination including manganese chloride 150 mmol/L, galactose 35.56 mmol/L was obtained by single factor test, DOE analysis and 200 L cell cultivation. Conclusion: The use of manganese chloride and galactose can effectively regulate the glycosylation modification ratio of denosumab biosimilar, which can provide a reference for the optimization of production process of the other mono-cloning antibody biosimilars.
KEy wORDS biosimilar; glycosylation; cell culture
抗体药物属于生物大分子药物,其生物功能的发挥离不开复杂的翻译后修饰。糖基化(glycosylation)作为抗体最重要的翻译后修饰,是指蛋白质或脂质在酶的作用下连接上糖链的过程,其对抗体的生物活性和体内代谢有着重要的作用[1],不同的糖基化对抗体亲和力和体内代谢具有显著影响[2-4]。抗体药物中常见的糖型有岩藻糖(Fuc)、半乳糖(Gal)、唾液酸(Sia)和甘露糖(Man)修饰,不同比例的糖型修饰可影响抗体药物的稳定性、电荷异构、生物学活性等,如岩藻糖修饰影响单抗的抗体依赖细胞介导的细胞毒性作用(antibody dependent cell-mediated cytotoxicity,ADCC)[5-6];高甘露糖修饰可缩短药物的半衰期[7];半乳糖修饰可提高抗体与补体的亲和力、增强补体依赖的细胞毒性(complement-dependent cytotoxicity,CDC)效应[8]。因此,糖基化修饰通常作为抗体药物生产过程中的关键质量属性(critical quality attributes,CQA)进行调控[9]。
地诺单抗糖基化形式为N-糖基化。N-糖基化是在内质网上由糖基转移酶催化、在内分泌蛋白和膜结合蛋白的天冬酰氨残基的氨基上结合寡糖的过程,寡糖中的乙酰葡萄糖与多肽链中天冬酰胺残基的酰胺氮连接形成N-连接糖蛋白。N-糖基化的位点是Asn-X-Thr/Ser(其中X是除了脯氨酸之外的任何氨基酸)3个氨基酸残基组成的序列段[10-11]。单克隆抗体糖基化类型主要有G0、G0F、G1F、G2F、Man5等[1],地诺单抗的糖基化类型以G0F和G1F为主,所占比例分别约为62%和20%;本研究中的单抗为地诺单抗生物类似药,其糖基化类型以G0F为主,所占比例约为80%。糖基化修饰的差异可能导致药物结合活性、半衰期等差异,从而影响药效,考虑到生物类似药用药的安全性,需将糖型优化至与地诺单抗高度类似。
糖型调节是生物药工艺研发过程中常遇到的工艺难题,影响单克隆抗体糖基化类型及比例的因素有很多,如细胞株、培养方式、培养参数控制等[1,12-16] ,在细胞株构建和筛选过程中,可通过基因改造等方式进行糖基化优化,如利用基因敲除降低巖藻糖基化比例从而增强抗体的ADCC效应;在细胞培养工艺中可通过改变细胞培养过程中培养基的糖分、金属离子浓度等条件来改变蛋白质的糖基化类型及比例。细胞株构建虽然能从根本上决定糖型的类型与比例,但通过细胞株改造进行糖型调节耗时、耗力,并不适用于生物类似药的工艺优化。通过培养基成分的调节及控制参数优化是常见的优化方式,但细胞培养方式和控制参数对糖基化的影响通常是多因素交互作用的,在工艺开发过程中需要考虑工艺控制的可操作性和精确性;另外,在糖型优化过程中不仅需要选择合适的糖型调节试剂,还需要兼顾同一试剂对不同糖型的影响程度和影响趋势,以及产品本身的其它关键质量属性,如电荷异构体、蛋白纯度等;同时,不同培养规模条件下细胞生长环境的变化、不同反应器控制策略的差异导致细胞培养过程对糖型调节试剂需求有所差异,因此工艺放大过程可能带来的结果差异也需要特别关注。
本研究选择氯化锰、半乳糖和尿苷作为糖型调节剂,先采用单因素方法测试三种糖型调节剂的效果,再采用实验设计(design of experiment,DOE)的方法找到合适剂量,并将优化后培养工艺放大到中试规模确证,确保优化后糖型可达到与原研药高度类似的效果,且对抗体的其他质量属性无明显影响。
1.1 实验材料
表达地诺单抗生物类似物的重组细胞为中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞,培养基为CD CHO(Gibco公司);地诺单抗对照抗体采购于市售药物;糖型调节剂为氯化锰、尿苷(Sigma公司)、半乳糖(Pfanstiehl公司)。
1.2 细胞培养
1.2.1 摇瓶培养
从细胞库取出CHO细胞种子,在摇瓶上逐步扩大培养体积制备实验用种子细胞,培养条件为36.8 ℃、5% CO2、摇床转速120 r/min;采用分批补料(fed-batch)培养方式进行抗体制备,d 0~5培养温度为36.8 ℃、d 6降温至33 ℃,培养时间为14 d,培养过程中监测细胞生长和活率。
1.2.2 生物反应器培养
200 L规模培养工艺采用XDR 200反应器(Cytiva公司)、分批补料培养方式,d 0~5培养温度36.8 ℃、d 6降温至33 ℃,培养过程中控制pH 6.95、溶氧40%、搅拌转速100 r/min、培养时间14 d,监测细胞生长和活率。优化前工艺不添加任何糖型调节剂。
1.3 糖型优化方法
1.3.1 单因素
采用摇瓶培养对氯化锰、半乳糖和尿苷三种糖型调剂进行单因素实验,每个糖型调节剂设置3个浓度水平,氯化锰测试浓度为154、308和616 μmol/L;半乳糖测试浓度为15.4、30.8和61.6 mmol/L;尿苷测试浓度为1.65、3.3和6.6 mmol/L。
1.3.2 多因素DOE析因糖型优化
根据单因素试验的结果确定选择氯化锰和半乳糖作为糖型调节剂,进行2因素2水平DOE析因糖型优化实验,方案见表1。氯化锰浓度设置2水平分别是150、350 μmol/L,半乳糖浓度设置2水平分别是10、50 mmol/L。

1.3.3 200 L培养规模糖型优化
在优化前工艺基础上批次XDR200-1、XDR200-2、XDR200-3添加氯化锰和半乳糖调节剂的用量分别为222.22 mmol/L、35.56 mmol/L,而批次XDR200-4分别为150 mmol/L、35.56 mmol/L。
1.4 产量和质量检测方法
IgG定量采用蛋白A亲和高效液相色谱法检测(Waters公司,Arc);抗体纯度采用分子排阻高效液相色谱(SEC-HPLC)方法进行检测;电荷异构体采用离子交换高效液相色谱(CEX-HPLC)方法进行检测,N-糖型采用2-AB标记法超高效液相色谱(Waters公司,H-Class)检测[17] 。
1.5 统计分析方法
多因素DOE析因实验结果使用JMP软件进行分析,以G0、G0F、Man5和G1F这4种主要的糖型为响应建模,分析不同因子对其影响程度及趋势[16] 。
2.1 不同糖型调节剂对糖型质量的影响
在摇瓶培养规模上进行Fed-batch细胞培养,进行氯化锰、半乳糖和尿苷这三种不同剂量糖型调节剂对糖型比例优化的效果,结果如表2、图1、图2所示。
氯化锰的高、中、低剂量分別是154、308和616μmol/L,在这个范围内氯化锰对细胞生长、抗体产量、纯度和电荷异构体比例均无明显影响,但对糖型有明显影响。氯化锰 616 μmol/L已将G0F降至低于地诺单抗,同时G0和Man5比例显著升高,提示高浓度锰离子对单抗G0和Man5修饰影响较大;氯化锰 154 μmol/L和308μmol/L可将G0、G0F、Man5、G1F比例调节至与地诺单抗类似,提示氯化锰有效用量在154~308 μmol/L之间。
半乳糖的高、中、低剂量分别是15.4、30.8和61.6 mmol/L,在这个范围内半乳糖对细胞生长、抗体产量、纯度和电荷异构体比例均无明显影响,其对糖型的G0、Man5无明显影响,但可降低G0F比例及提升G1F比例,使其与地诺单抗类似,但其作用与剂量无明显关系,提示半乳糖有效用量为30.8 mmol/L左右。
尿苷的高、中、低剂量分别是1.65、3.3和6.6 mmol/L,在此范围内尿苷对细胞生长、抗体产量、纯度和电荷异构体比例及糖型均无明显影响,在后续的实验中将不再使用尿苷来调节糖型。

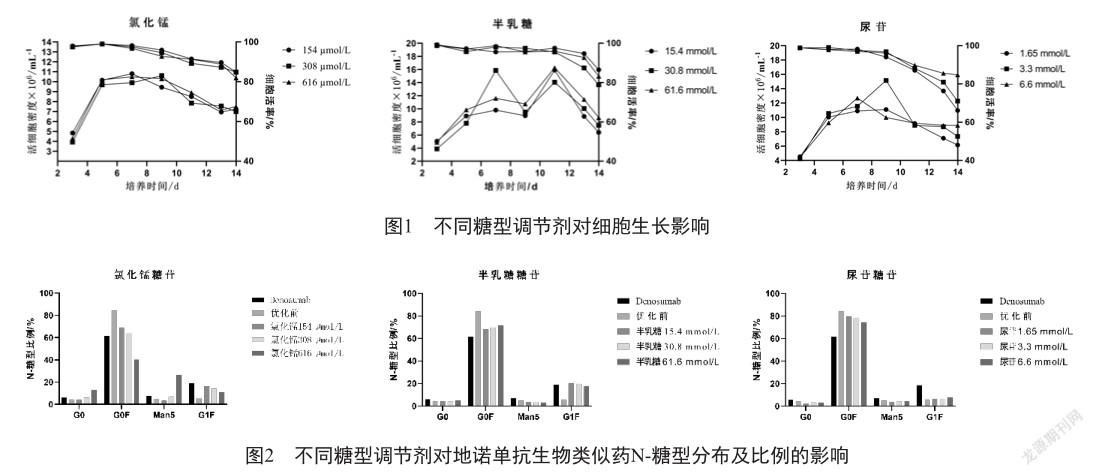
2.2 多因素DOE析因糖型优化结果
以氯化锰、半乳糖为因子,以G0、G0F、Man5和G1F这4种主要糖型为响应,采用JMP软件进行分析,结果表明,氯化锰对糖型影响显著,随浓度的升高显著降低G0F、G1F比例,同时提高G0、Man5比例;半乳糖对糖型G0、G0F、Man5影响较小,对G1F影响显著,随着浓度升高可提高G1F比例(图3)。根据意愿刻画,确定氯化锰和半乳糖组合用量分别是222.22 mmol/L和35.56 mmol/L。
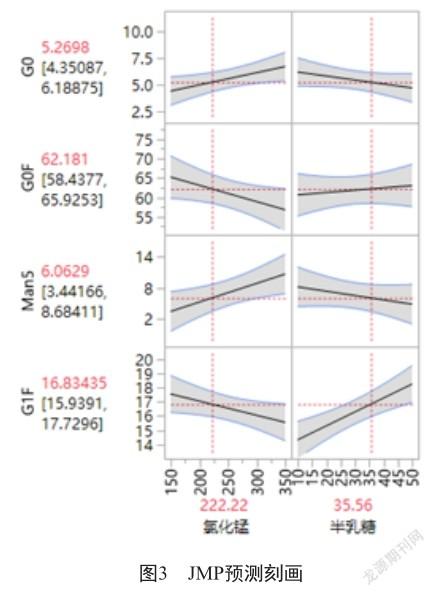
2.3 200 L培養规模放大试验
摇瓶培养工艺条件下确定氯化锰和半乳糖用量后,将工艺放大至200 L规模,考察工艺的可放大性。进行连续3批工艺放大培养(XDR200-1、XDR200-2、XDR200-3),培养过程中细胞生长、活率、抗体产量一致性良好,批次间无显著差异,经纯化制备后抗体关键质量属性纯度、电荷异构体比例结果与工艺优化前无显著差异,同时与地诺单抗保持一致(图4、表3);糖型G0、G0F、G1F比例较工艺优化前显著改善(图5),但与地诺单抗相比,G0F比例略低,Man5比例较高,可能原因为工艺放大后细胞生长环境的变化、不同反应器控制策略的差异导致细胞培养过程对糖型调节剂的需求量有所减少,结合小试单因素、DOE试验中高浓度氯化锰对Man5比例调节的影响趋势,推测Man5比例升高是因为工艺放大后细胞培养环境中锰离子浓度过高,因此降低氯化锰用量至150 mmol/L,进行第4批(XDR200-4)200 L培养试验。结果表明,降低氯化锰浓度至150 mmol/L后,培养过程中细胞生长、活率及抗体产量均无影响,关键质量属性纯度、电荷异构体比例与工艺优化前产物及地诺单抗一致性良好;随着锰离子量减少Man5比例较前三批结果显著降低,与地诺单抗比例一致,G0F、G1F比例略有上升(表3、图4、图5)。综合对比G0、G0F、Man5、G1F主要糖型比例,氯化锰、半乳糖用量分别为150 mmol/L和35.56 mmol/L时,主要糖型比例与地诺单抗高度一致,且抗体的其他质量属性纯度、电荷异构体比例无明显差异,达到优化目的。
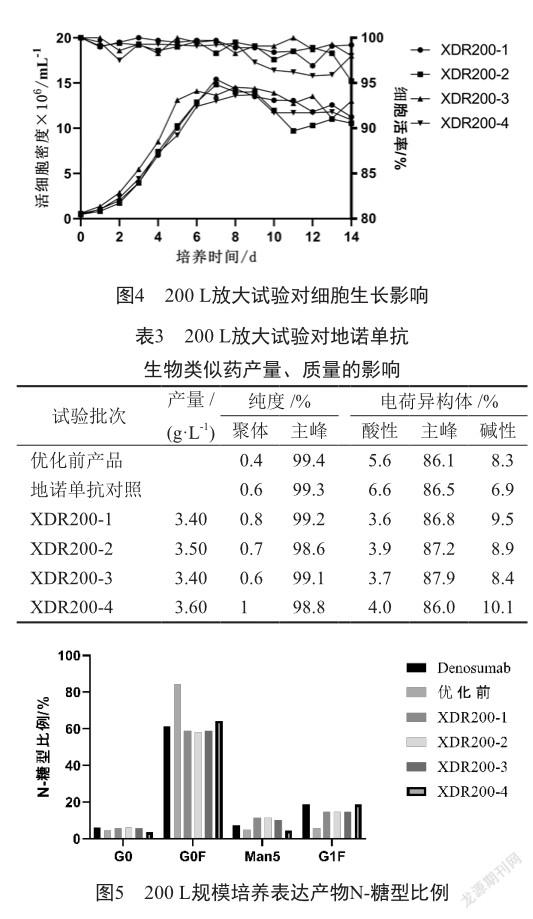
工艺过程中添加调节试剂是一种相对简单有效的糖基化优化方式,但是不同调节试剂的浓度需求以及对不同糖基化类型的影响程度可能会有所差异,通常需要多种试剂的组合使用才能实现;同时,在工艺放大、培养规模变化时会引起细胞生长微环境的变化,从而导致对糖型调节试剂需求的变化,因此在小试工艺开发过程中需要兼顾工艺放大的可行性。本研究使用氯化锰、半乳糖通过单因素试验、DOE分析对地诺单抗生物类似药N-糖基化修饰比例进行优化,同时将优化工艺放大至200 L规模,实现地诺单抗生物类似药糖基化水平与原研药地诺单抗的高度可比。
利用DOE分析方法可有效通过较少的实验次数,高效快速地确定糖型调节剂的交互影响及作用浓度,大大提高工艺优化效率。同时本研究在细胞培养过程中添加糖型调节试剂的工艺优化方式对地诺单抗生物类似药的糖基化修饰调节是有效的,这为其他单克隆抗体生物类似药工艺优化提供了较好的借鉴。
参考文献
[1] 张忠兵, 罗建辉. 单克隆抗体糖基化修饰研究进展[J]. 中国医药生物技术, 2020, 15(4): 426-431.
[2] 王冲. 单克隆抗体糖基化修饰研究进展[J]. 现代免疫学, 2017, 37(3): 247-252.
[3] 刘晓宇, 常军亮, 刘玉林. 单克隆抗体糖基化修饰的研究现状及进展[J]. 中国生物制品学杂志, 2020, 33(2): 216-221.
[4] 衣常红, 高春芳. IgG糖基化修饰及其意义研究进展[J].中国免疫学杂志, 2010, 26(11): 1051-1056.
[5] Konno Y, Kobayashi Y, Takahashi K, et al. Fucose content of monoclonal antibodies can be controlled by culture medium osmolality for high antibody-dependent cellular cytotoxicity[J]. Cytotechnology, 2011, 64(3): 249-265.
[6] Nguyen Dang A, Mun M, Rose CM, et al. Interaction of cell culture process parameters for modulating mAb afucosylation[J]. Biotechnol Bioeng, 2019, 116(4): 831-845.
[7] Goetze AM, Liu YD, Zhang Z, et al. High-mannose glycans on the Fc region of therapeutic IgG antibodies increase serum clearance in humans[J]. Glycobiology, 2011, 21(7): 949-959.
[8] Hodoniczky J, Zheng YZ, James DC. Control of recombinant monoclonal antibody effector functions by Fc N-Glycan remodeling in vitro[J]. Biotechnol Prog, 2005, 21(6): 1644-1652.
[9] Rathore AS, Weiskopf A, Reason AJ. Defining critical quality attributes for monoclonal antibody therapeutic products[J]. Biopharm Int, 2014, 27(7): 34-43.
[10] 张芳, 许之珏, 徐颖姣, 等. IgG糖基化与疾病相关性研究进展[J]. 生命科学, 2017, 29(4): 319-330.
[11] Werner RG, Kopp K, Schlueter M. Glycosylation of therapeutic proteins in different production systems[J]. Acta Paediatr, 2007, 96(455): 17-22.
[12] Grainger RK, James DC. CHO cell line specific prediction and control of recombinant monoclonal antibody N-glycosylation[J]. Biotechnol Bioeng, 2013, 110(11): 2970-2983.
[13] Kildegaard HF, Fan Y, Sen JW, et al. Glycoprofiling effects of media additives on IgG produced by CHO cells in fed-batch bioreactors[J]. Biotechnol Bioeng, 2016, 113(2): 359-366.
[14] Gramer MJ, Eckblad JJ, Donahue R, et al. Modulation of antibody galactosylation through feeding of uridine, manganese chloride, and galactose[J]. Biotechnol Bioeng, 2011, 108(7): 1591-1602.
[15] Fan Y, Jimenez Del Val I, Müller C, et al. Amino acid and glucose metabolism in fed-batch CHO cell culture affects antibody production and glycosylation[J]. Biotechnol Bioeng, 2015, 112(3): 521-535.
[16] 徐菲菲, 王太海, 楊玲, 等. 运用DOE方法降低抗体生产过程中五聚甘露糖水平的工艺开发[J]. 药物生物技术, 2017, 24(4): 305-309.
[17] 张峰, 于传飞, 王文波, 等. 人源化抗血管内皮生长因子单克隆抗体质控方法的建立[J]. 中国药学杂志, 2016, 51(13): 1101-1106.

