过路黄叶斑病病原鉴定及拮抗细菌的筛选
何 洁 梁 霜 李 忠,2,3,* 赵 致
(1 贵州大学农学院,贵州 贵阳 550025;2 贵州省药用植物繁育与种植重点实验室,贵州 贵阳 550025;3 贵州省农业微生物资源重点实验室,贵州 贵阳 550025)
过路黄(LysimachiachristinaeHance),属报春花科珍珠菜属多年生匍匐草本植物,民间俗称金银花、走游草、金钱草等[1]。过路黄茎匍匐,铺地效果好,可以作为观赏性植物用于园林建设。此外,过路黄是我国南方民间常用的中草药植物,有文献记载其具有清热解毒、消肿解痛、利尿通淋等作用[2],临床用于治疗胆结石、泌尿系统结石、慢性胆囊炎、肾积水等症状[3-4]。目前关于过路黄的研究报道仅限于其药用价值、临床应用和种植等方面,对其病害的识别及防治研究较少。随着市场需求增大,过路黄的种植面积逐年增加,其病害也开始发生。2019年6月在施秉县三泓药业股份有限公司中药材种植示范基地发现,过路黄叶部边缘有明显的红褐色病斑,且病斑面积随着时间的增长有逐渐扩大的趋势,发病后期叶部有穿孔现象,严重时可导致整片叶枯死,严重影响其观赏性及药用价值。
目前,中药材病害的防治方法主要以化学药剂为主,但农药残留、环境污染等问题迫使人们寻求更加安全高效的防治方法[5]。据报道,植物内生细菌具有固氮、分泌植物激素、诱导植物产生抗性和产生抗真菌代谢产物等多种生物学作用[6],因此分离并应用植物内生细菌成为生物防控技术研究的一大热点[7-8]。其中芽胞杆菌是研究较为广泛的一类细菌,其稳定性、相容性、一致性均优于其他生防菌[9]。目前运用生物防治控制作物病害已取得了一些进展,已从多种植物内部分离出具有促生或拮抗作用的内生细菌,如苜蓿[10]、黄精[11]、人参[12]等,在病害的防治上具有巨大的开发潜力,但关于过路黄的病害防控鲜有报道。为了明确过路黄的叶部病害病原种类,采集典型病叶并利用组织分离法、柯赫氏法则、形态观察和分子生物学方法等技术对病原菌进行分离鉴定,并从太子参健康块根内分离筛选出对该病原菌有显著抑制作用的拮抗细菌,利用形态、生理生化、16S rDNA以及DNA促旋酶A亚基编码基因(gyrA)序列分析明确细菌种类,旨在为过路黄叶斑类病害的病原识别及生物防治技术提供一定的理论依据。
1 材料与方法
1.1 试验材料
1.1.1 材料来源 过路黄病叶及太子参健康块根于2019年6月分别采集自贵州省施秉县三泓药业股份有限公司中药材种植基地和牛大场镇太子参种植基地。将样品装入采样袋带回实验室,于4℃冰箱保存备用。
1.1.2 培养基 马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:去皮马铃薯200 g,葡萄糖20 g,琼脂粉20 g,蒸馏水定容至1 L;Luria-Bertani(LB)固体培养基:蛋白胨10 g,酵母膏5 g,氯化钠5 g,琼脂15 g,蒸馏水定容至1 L。
1.1.3 供试病原菌 细极链格孢菌(Alternariatenuissima)、尖孢镰刀菌(Fusariumoxysporum)、齐整小核菌(Sclerotiniatidis)、果生刺盘孢菌(Colletotrichumfructicola),均由贵州大学农学院植物病理研究室提供。
1.2 病原菌的分离与纯化
采用组织分离法[13]在病健交界处切取5 mm×5 mm的组织块,于75%酒精中浸泡10 s,无菌水冲洗3次后用无菌滤纸吸干水分,接种于PDA平板,于28℃恒温培养箱中培养3~5 d,挑取无污染的边缘菌丝至另一PDA平板,重复此步骤3~5次获得纯培养菌株,于4℃斜面保存备用。
1.3 病原菌的致病性测定
选取健康叶片洗净擦干水分,用5 mm的无菌打孔器在培养7 d的菌落边缘打取菌饼,用灭菌针在叶片刺伤2个定点,接种菌饼于定点上,将叶片置于铺有湿润滤纸的培养皿中,以同样方法接种菌饼于无刺伤的叶片上,以接种无菌琼脂块为对照,每个处理3次重复。置于温度28℃、相对湿度70%、光周期为12 h光照/12 h黑暗的培养箱内恒温培养,每天观察并记录叶片的发病情况[14]。
1.4 病原菌的形态学鉴定及分子鉴定
1.4.1 形态学鉴定 将菌株接种于PDA培养基上于28℃恒温培养箱中培养7 d,观察记录菌落特征、产孢结构、孢子形态及生长情况。
1.4.2 分子生物学鉴定 将纯化培养7 d的菌株,用DNA提取试剂盒(上海生物工程有限公司)并参照说明书提取DNA。采用真菌核糖体基因转录间隔(internal transcribed spacer, ITS)区通用引物ITS1: 5′-G G C G T C A A G T G G A T G C C T-3′/ITS4: 5′-G G T A T A G T T A T T C G C C T C C T-3′、转录延伸因子(elongation factor,EF-1α)引物EF1: 5′-A T G G GT A T A A G G A(A/G)G A A A G A C-3′/EF2: 5′-GGA(G/A)G T A C C A G T(G/A)A T C A T G T T-3′、β-微管蛋白基因(β-tubulin)引物Bt2a:5′-T T C C C C C G T C T C C A C T T C T T C AT G-3′/Bt2b:5′-GGA(G/A)G T A C C A G T(G/C)A T C A T G T T-3′[15]对菌株进行PCR扩增(以上引物均由上海生物工程有限公司合成)。25 μL反应体系:DNA模板1 μL、正反引物各1 μL、2×Taq PCR Mix 12.5 μL、ddH2O 9.5 μL。PCR反应条件:ITS序列反应条件:95℃预变性5 min;95℃变性30 s,52℃退火45 s,72℃延伸90 s,35个循环;72℃延伸10 min。β-tubulin基因的PCR反应条件:95℃预变性3 min;95℃变性1 min,55℃退火50 s,72℃延伸1 min,35个循环;72℃延伸10 min。EF-1α基因反应条件:94℃预变性5 min;94℃变性45 s,56℃退火45 s,72℃延伸45 s,35个循环;72℃延伸10 min。反应结束后进行1.2%琼脂糖凝胶电泳检测,合格后送至上海生物工程有限公司测序。将获得的菌株序列复制至NCBI数据库进行BLAST比对,然后在Genbank中进行同源性比较,参考文献[16]下载各模式菌株基因序列基于最大简约法用PAUP*4.0软件构建多基因系统发育树,进一步确定病原菌的种类。
1.5 内生细菌的分离、筛选及鉴定
1.5.1 内生细菌的分离 采用组织块培养法[17]进行内生菌的分离。具体步骤:将采集的健康太子参块根用自来水冲洗干净,75%酒精表面消毒5 min,无菌水冲洗3次,将最后一次使用的无菌水均匀涂布于PDA平板上,于28℃恒温培养1~3 d验证表面消毒情况。用无菌滤纸擦干块根水分,用灭菌刀切取3 mm×3 mm的组织块于LB固体培养基上,于28℃恒温培养箱中培养2~3 d。将平板上形状、颜色、大小不一的菌落挑取至另一LB平板上,不断划线获得纯菌株保存于含20%甘油的冻存管内,于-80℃保存。
1.5.2 内生拮抗细菌的筛选 采用平板对峙法[18],将纯化后培养7 d的病原菌接种于PDA培养基中央,将各形态不一的细菌以十字交叉法分别接种于距离病原菌2 cm处,以只接种病原菌的平板作为对照,对照组菌落长满平板时利用十字交叉法测量病原菌的生长直径,设置3个重复取平均值计算拮抗菌对病原菌的抑制情况。
抑制率=[(对照菌落直径-处理菌落直径)/对照菌落直径]×100%。
1.5.3 拮抗菌形态观察及生理生化测定 参照《常见细菌鉴定手册》[19],将活化后的拮抗菌株接种于LB固体培养基上,28℃培养24 h,观察菌落形态及颜色,同时挑取适量菌落进行革兰氏染色及生理生化指标测定。
1.5.4 拮抗菌的分子鉴定 利用Biomiga细菌基因组DNA提取试剂盒对菌株的基因组DNA进行提取。PCR扩增利用16S rDNA通用引物27F:5′-C T A C G G C T A C C T T G T T A C G A-3′和1492R:5′-G A G A G G A T C C T G G C T C A G-3′、gyrA引物F:5′-C A G T C A G G A A A T G C G T A C G T C C T T-3′和R:5′-C A A G G T A A T G C T C C A G G C A T T G C T-3′[20](以上引物均由上海生物工程有限公司合成)。反应总体系与上述病原菌体系相同,PCR扩增条件:95℃预变性3 min,95℃变性30 s,50℃退火30 s,72℃延伸60 s,循环30次;72℃再延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测后送上海生工生物公司测序,用NCBI数据库中的BLAST软件将测序得到的序列和GenBank中的核酸序列进行比对分析,下载同源性较高的菌株序列通过MEGA6.0软件采用邻近(neighbor-joining, NJ)法构建系统进化树。
1.6 拮抗细菌抑菌谱测定
通过平板对峙法测定拮抗菌株对极细链格孢菌(Alternariatenuissima)、尖孢镰刀菌(Fusariumoxysporum)、齐整小核菌(Sclerotiniatidis)、果生刺盘孢菌(Colletotrichumfructicola)4种病原真菌的抑菌谱,平板对峙法的操作步骤同1.5.2。
1.7 数据分析
用Excel 2010进行数据处理,用SPSS 16.0数据处理系统采用Duncan新复极差法对试验数据进行分析。
2 结果与分析
2.1 病原菌的致病性测试
过路黄叶斑病发病时,在叶片上能看到明显的红褐色病斑,发病后期病斑面积逐渐扩大,聚合为一个大病斑,伴有穿孔现象(图1-A)。在过路黄健康叶片上用无菌接种针刺伤后接种病原菌,于28℃培养箱内培养3 d后开始发病,7 d后发病部位病斑逐渐扩大呈红褐色,致病力较强(图1-D、D1),无伤接种病原菌7 d后叶片也出现红褐色病斑,但病斑面积较刺伤叶片小(图1-C、C1)。接种琼脂块的对照叶片培养7 d后仍无发病现象(图1-B、B1)。从发病部位再次分离病原菌得到与之前相同的菌落,表明该病原菌为过路黄叶斑病的致病菌,菌株编号为GLHYB。

注:A:过路黄叶斑病发病症状;B、B1:接种琼脂块7 d后的发病症状;C、C1:未刺伤接种病原菌7 d后的发病症状;D、D1:刺伤接种病原菌7 d后的发病症状。Note: A: Symptoms of Lysimachia christinae leaf spot. B、B1: Symptoms after 7 days with stab inoculation. C、C1: Symptoms of 7 days after inoculation without stab wound. D、D1: Symptoms after 7 days of inoculation.图1 过路黄叶斑病发病症状及人工接种病原菌发病症状Fig.1 Symptoms of Lysimachia christinae leaf spot and artificial inoculation of pathogen
2.2 病原菌的形态学鉴定
GLHYB菌株在PDA培养基上培养10 d左右时,病原菌长满全皿,菌落颜色为白色、米白色,菌丝生长茂盛,呈绒毛状,菌落底部有淡黄色的分生孢子座,基物表层肉色,菌落背面呈淡黄色(图2-A、B)。小型分生孢子数量多,卵型或肾型,大多为0~1个隔膜(图2-C),大型分生孢子呈纺锤型,有的两端略弯曲且较钝,大小为(21.65~38.74)μm×(2.68~7.46)μm,有3~7个隔膜,多数为3~5个隔膜(图2-D)。厚垣孢子数量多,单生、对生或串生,呈球形(图2-E~G),产孢细胞在气生菌丝上长出单瓶梗状,单瓶梗产孢(图2-H、I)。
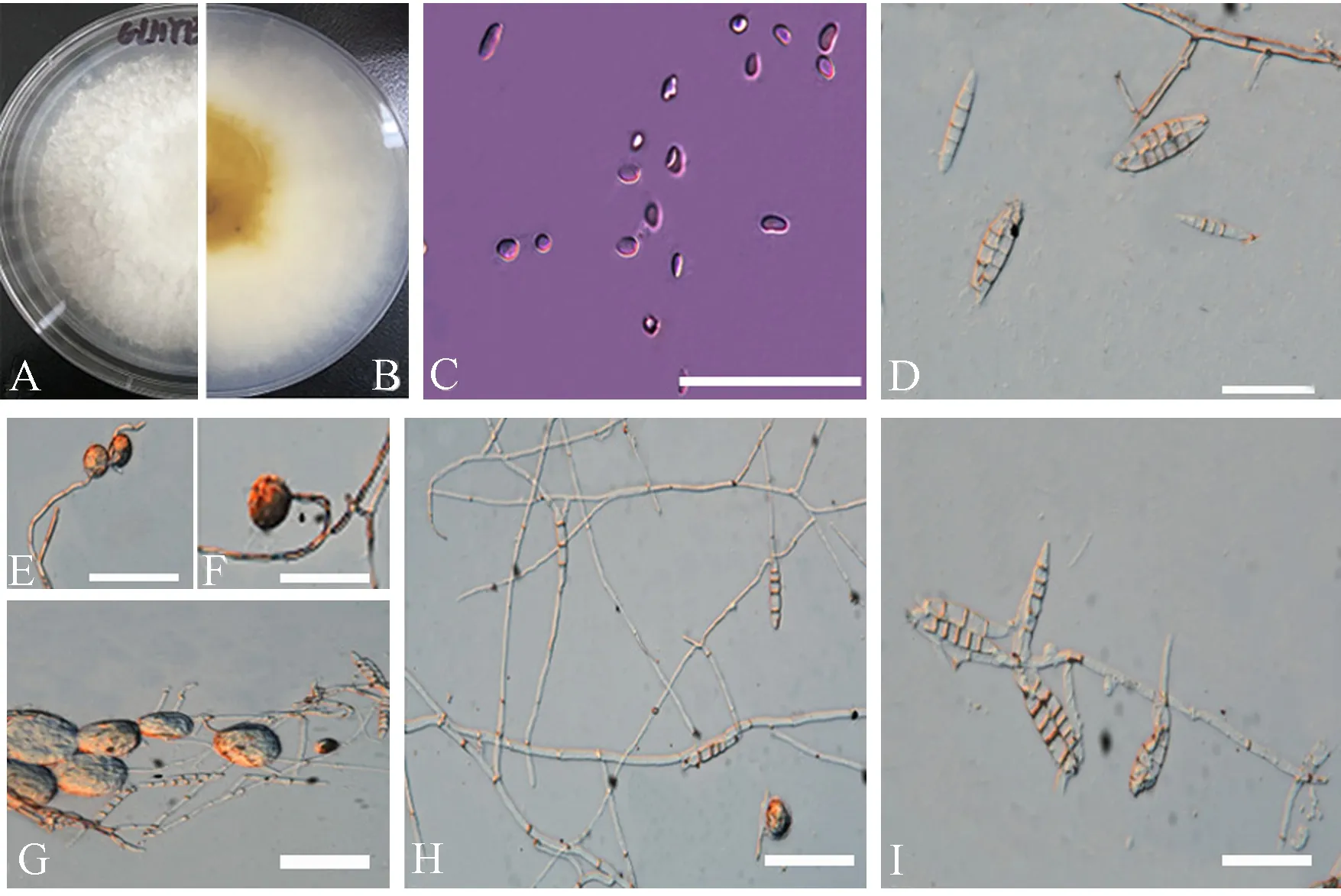
注:A:病原菌菌落形态正面;B:病原菌菌落形态背面;C:小型分生孢子;D:大型分生孢子;E、F、G:厚垣孢子形态;H、I:产孢细 胞。标尺为20 μm。Note:A、B: The colony morphology of pathogen (A: Front, B: Back). C: Small conidias. D: Large conidias. E、F、G:Morphology of chlamydospores. H、I: Sporogenic cell. The scale is 20 μm.图2 腐皮镰刀菌菌落形态特征Fig.2 Colony morphological characteristics of F. solani
2.3 病原菌的分子鉴定
测序结果显示,ITS、EF-1α、β-tubulin基因获得的序列长度分别为522、602、337 bp,各基因序列如图3所示。将各基因序列复制到NCBI进行序列比对,选取同源性较高的菌株序列构建多基因系统发育树,结果表明目标菌株GLHYB与腐皮镰刀菌(Fusariumsolani)聚为一支,支持率为95%,且与其他种的亲缘关系较远(图4)。结合形态及分子生物学结果鉴定可知,导致过路黄叶斑病的病原菌为腐皮镰刀菌(F.solani)。

图3 ITS、EF-1α、β-tubulin基因序列Fig.3 ITS, EF-1 α,β-tubulin gene sequence
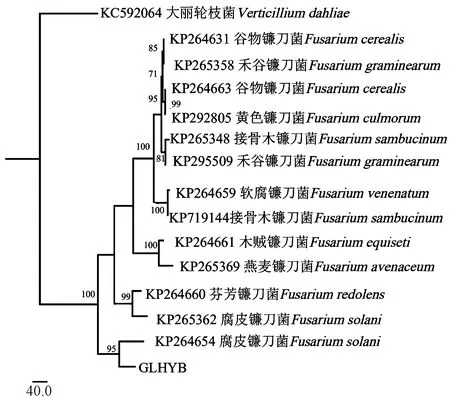
图4 基于ITS、EF-1α、β-tubulin基因序列构建的系统发育树(GLHYB为目标菌株)Fig.4 Phylogenetic tree based on ITS,EF-1 α,β-tubulin genes sequences (GLHYB as target strain)
2.4 内生拮抗细菌的分离、筛选
利用组织块培养法从太子参块根内分离出12株形态不一的细菌,进一步以GLHYB为指示菌,采用平板对峙法筛选出1株对GLHYB抑制效果达50%以上的拮抗细菌,编号为X14(图5-A、B)。利用光学显微镜观察该菌株对GLHYB菌丝生长的影响,发现X14可引起GLHYB菌丝的膨大及畸形(图5-C、D)。
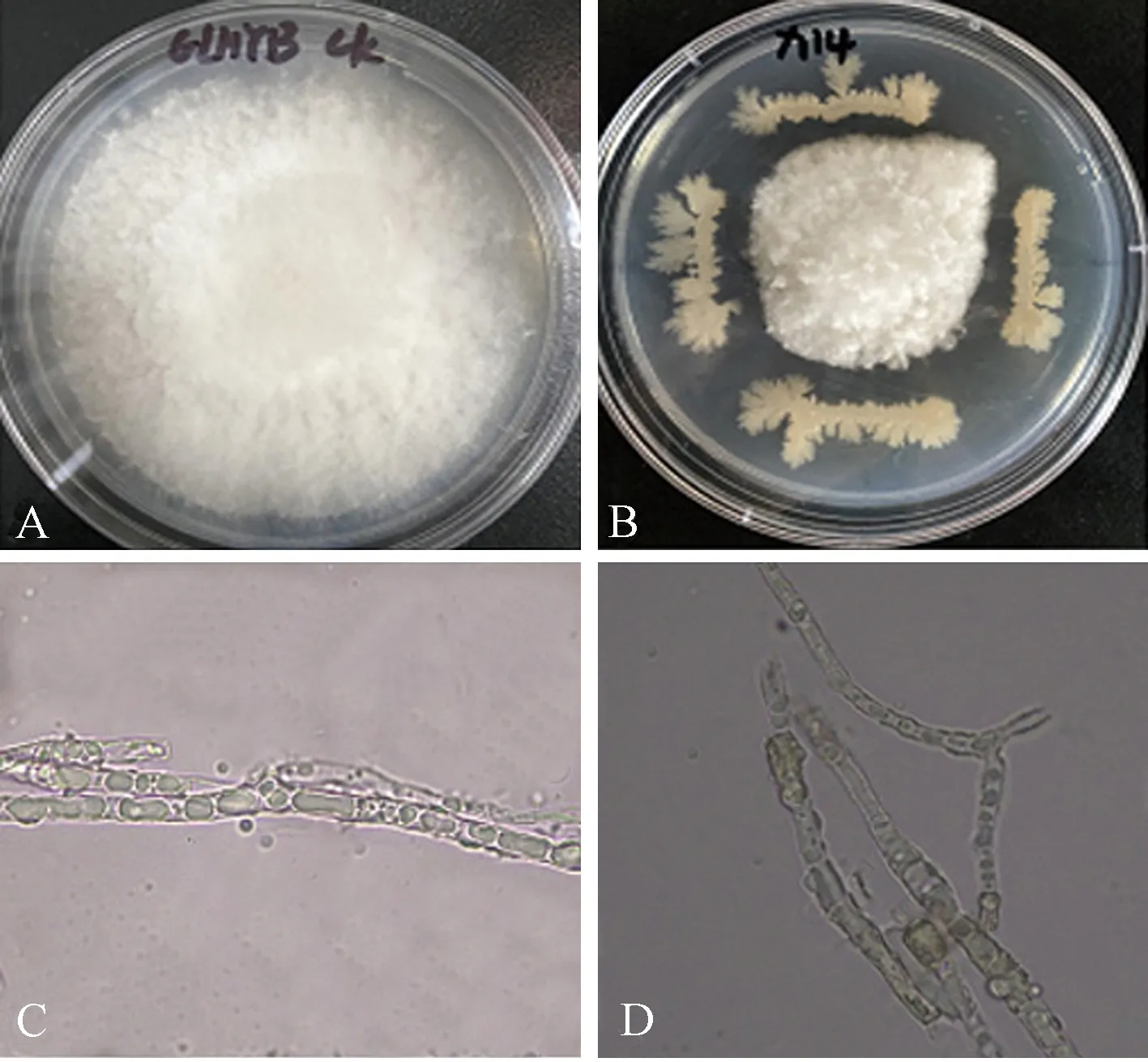
注:A:GLHYB菌落形态;B菌株X14对GLHYB的拮抗效果;C:GLHYB 的菌丝形态;D:菌株X14引起GLHYB菌丝膨大、畸形。Note: A: The colony morphology of GLHYB. B: Antagonistic effect of X14 on GLHYB. C: The mycelial morphology of GLHYB. D: The strain of X14 caused the mycelial of GLHYB enlargement and deformity.图5 拮抗细菌X14对GLHYB菌丝生长的影响Fig.5 Effect of X14 on the mycelial growth of GLHYB
2.5 内生拮抗细菌的抑菌谱测定
利用平板对峙法测定X14对细极链格孢菌(A.tenuissima)、尖孢镰刀菌(F.oxysporum)、齐整小核菌(S.tidis)、果生刺盘孢菌(C.fructicola)4种主要病原真菌的抑菌效果,结果显示X14对这4种病原真菌均有较强的抑菌效果(图6),抑菌率均达50%以上(表1)。
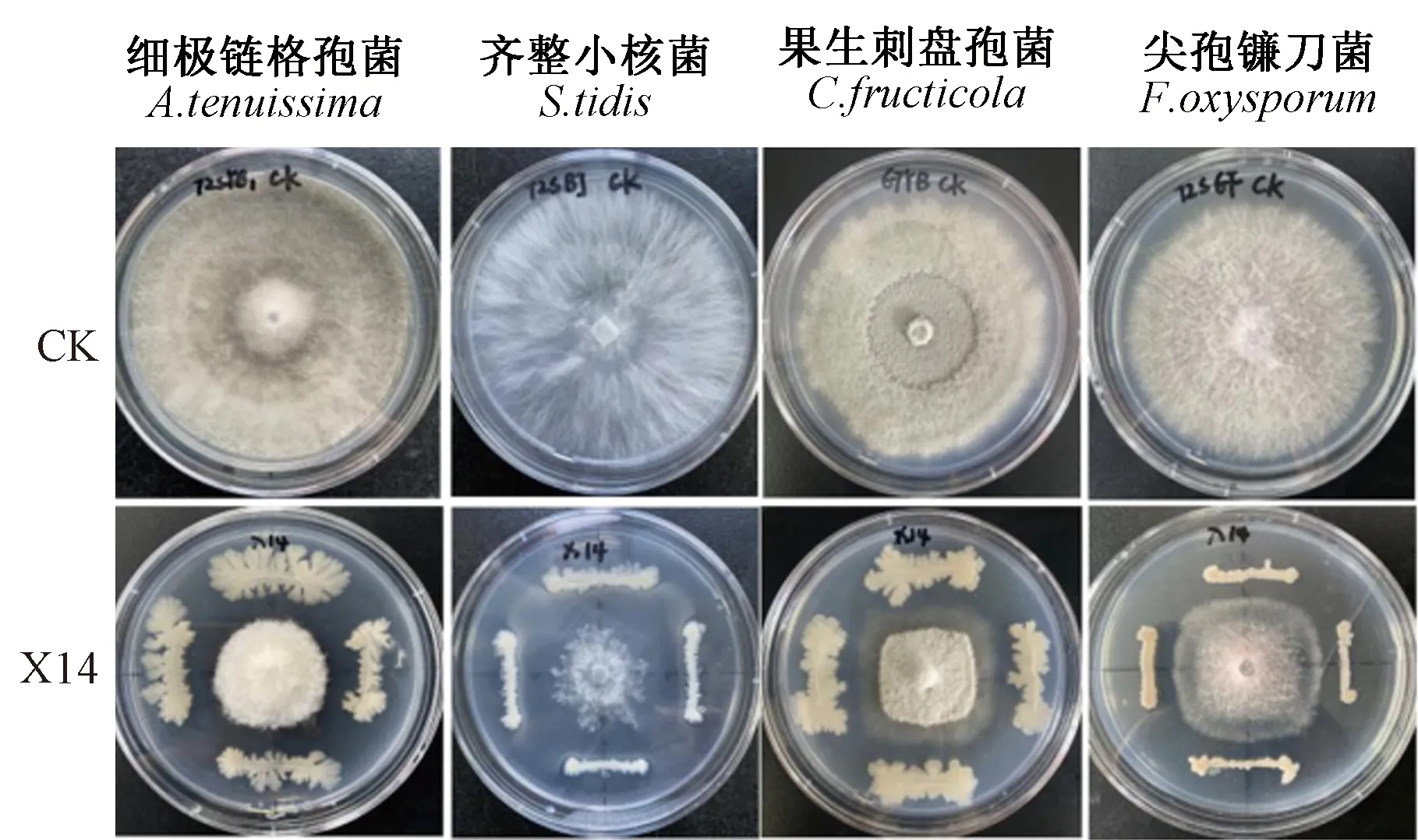
图6 菌株X14对4种主要病原真菌的拮抗效果Fig.6 Antagonistic effects of X14 against four pathogen fungi
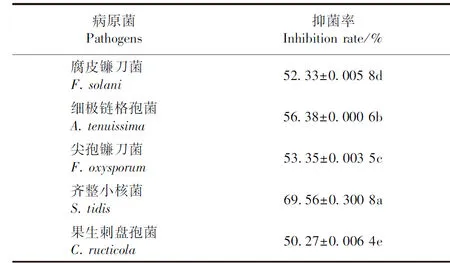
表1 菌株X14对5种供试病原真菌的抑菌率测定Table 1 Determination of bacteriostatic rates of X14 against five tested pathogenic fungi
2.6 拮抗细菌的形态及生理生化测定
菌株X14在LB培养基上菌落初期为白色,后期颜色泛黄,表面粗糙、不透明(图7-A)。该菌株经生理生化特征测定结果为革兰氏染色呈阳性(图7-B),明胶液化明显呈阳性,能使淀粉水解(表2)。
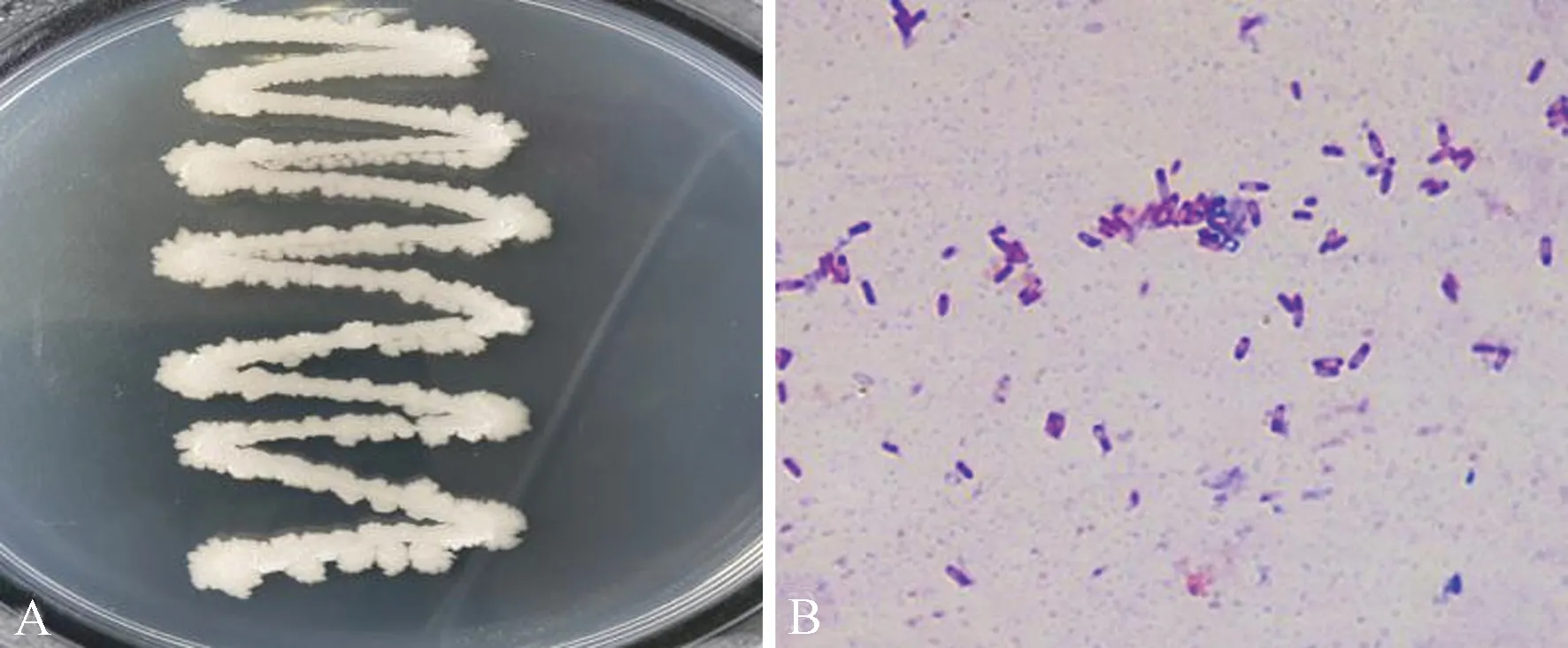
注:A:菌株X14的菌落形态;B:菌株X14的革兰氏染色结果。Note: A: The colony morphology of X14. B: Gram staining results of X14.图7 菌株X14的菌落形态及革兰氏染色Fig.7 Colony morphology and Gram staining of X14

表2 菌株X14的生理生化测定Table 2 Physiological and biochemical determination of X14
2.7 拮抗细菌的分子生物学鉴定
经上海生物公司测序返回的16S rDNA及gyrA基因序列如图8,序列长度分别为1 462、926 bp,将复制序列至NCBI数据库中进行BLAST比对,序列比对结果中X14与枯草芽孢杆菌(B.subtilis)的同源性达99.54%,基于16S rDNA构建的系统发育树表明X14与枯草芽孢杆菌聚为一支,支持率为90%,进一步进行gyrA基因鉴定,结果显示其与枯草芽孢杆菌聚为一支且支持率为100%(图9),因此可将X14鉴定为枯草芽孢杆菌(B.subtilis)。

图8 菌株X14 16S rDNA、gyrA基因序列Fig.8 16S rDNA and gyrA gene sequence of strain X14
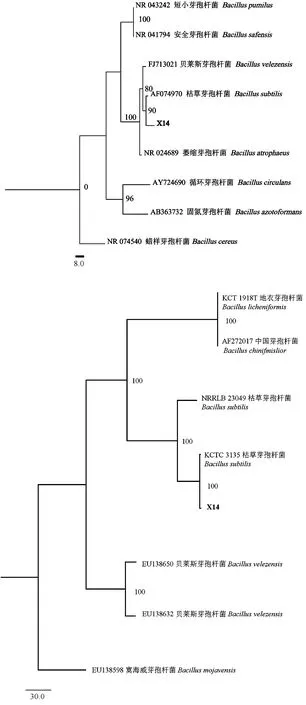
图9 菌株X14基于16S rDNA和gyrA基因构建的系统发育树Fig.9 Phylogenetic tree of X14 based on 16S rDNA and gyrA genes
3 讨论
叶斑病是多种植物叶部主要真菌病害之一,其病原种类较为广泛。研究表明,拟盘多毛孢(Pestalotiopsisspp.)、链格孢(Alterariaspp.)、棒孢霉(Corynesporaspp.)、茎点霉(Phomaspp.)、叶点霉(Phyllostictaspp.)等多种真菌均可引起植物发生叶斑病,而镰刀菌属真菌多为土传类病原菌,侵染植物根茎部,导致根腐、茎腐、枯萎等,国内仅报道了层出镰刀菌(Fusariumproliferatum)[21]、燕麦镰刀菌(Fusariumavenaceum)[22]可侵染植物引起叶斑病。本研究结合形态及分子生物学方法将贵州省施秉县过路黄叶斑病病原菌鉴定为腐皮镰刀菌,该菌广泛分布于世界各个角落,可作为腐生菌普遍存在于土壤及病残体内[21],同时也是一种土传病害的病原菌,可侵染多种植物(如滇黄精[23]、胡萝卜[24]、芒果[25]、半夏[26]、马铃薯[27]等)引起根腐病和茎枯病,对于腐皮镰刀菌能侵染过路黄引起叶斑病,本研究属早期发现。对于镰刀菌属真菌的鉴定,由于其孢子形态具有多型性及易变异性,仅依靠形态及单基因无法鉴定到种。随着分子生物学的发展,明确了一些可用于镰刀菌种间鉴定的基因位点,如内转录间隔区(ITS)、线粒体小亚基核糖体(mitochondrial small subunit rDNA,mtSSU)、β-微管蛋白(β-tubulin)及翻译延伸因子(nuclear translation elongation factor-1α,EF-1α)等[28~29]。本研究选用ITS、EF-1α及β-tubulin基因片段能区分目的菌株与其他菌株,明确了施秉县过路黄叶斑病病原菌为腐皮镰刀菌(F.solani)。
近年来,许多学者致力于从不同生态环境中分离筛选具有拮抗作用的菌株来防治植物病害,为病害的绿色防治提供了一条新途径。菌株以细菌居多,而根系内生细菌是生防功能微生物筛选的重要资源库,其中芽胞杆菌(Bacillusspp.)是其优势微生物种群,能产生耐热抗逆的芽孢,抗逆性强且能稳定定植[30],具有很好的抗菌防病效果,目前研究主要集中在枯草芽胞杆菌(B.subtilis)、多粘芽胞杆菌(Bacilluspolymyxa)、 短小芽胞杆菌(Bacilluspumilus)、蜡状芽胞杆菌(Bacilluscereus)和地衣芽胞杆菌(Bacilluslicheni-formis)等几个种[31],以枯草芽孢杆菌最为普遍。本研究以F.solani为指示菌,首次从太子参健康块根内分离筛选出1株对过路黄叶斑病病原菌抑菌率达50%以上的拮抗细菌X14,并对其进行了形态观察、生理生化测定,初步明确了该菌株为芽孢杆菌,以往对于细菌鉴定主要是生理生化结合16S rDNA序列分析进行种类鉴定,近年来许多研究发现16S rDNA序列在芽胞杆菌不同种之间存在较高的相似性[32-33],系统发育关系难以区分,但一些高突变率蛋白质编码基因可以用来区分种间差异,如促旋酶(gyrAse)亚单位基因(gyrA)、促旋酶B亚单位基因(gyrB)逐渐作为芽孢杆菌种类鉴定的新靶标,本研究利用16S rDNA以及gyrA基因明确了菌株X14为枯草芽孢杆菌,该菌具有广谱抑菌性,对供试植物病原真菌细极链格孢菌(A.tenuissima)、尖孢镰刀菌(F.oxysporum)、齐整小核菌(S.tidis)、果生刺盘孢菌(C.fructicola)的抑菌率在50%~70%之间,与韩如月等[34]研究结果相似。研究表明,芽孢杆菌的抑菌机理主要为直接竞争病原菌的营养和空间位点,从而抑制病原菌的生长,以及产生胞外酶从而达到溶菌作用[35],其自身还能分泌一些表面活性物质,如表面活性素、伊枯草菌素等抗菌素,具有抑制作物病害扩展能力[36]。Ambrico等[37]研究表明,枯草芽孢杆菌ET-1可产生伊枯草菌素,能有效抑制真菌菌丝的扩展,对柠檬绿霉病和草莓灰霉病防效分别为68.6%和74.1%;此外,芽孢杆菌还能分泌次生物质作为激发子诱导植物自身抗病性[38]。本研究结果表明,菌株X14能引起过路黄叶斑病菌丝膨大和畸形,与程欢欢等[39]研究结果相似。在本研究菌株培养过程中X14与病原菌未发生物理触碰,其抑菌机理可能是在培养过程中菌株X14产生了某种抗生素或次生代谢产物从而抑制了病原菌的生长,但具体的抑菌机理及田间防控效果等方面还有待进一步研究。
4 结论
本研究通过病原菌的分离纯化、致病性测定、形态学鉴定及多基因序列联合构建系统发育树等技术手段,将引起贵州省施秉县过路黄叶斑病的病原菌鉴定为腐皮镰刀菌(F.solani),并以F.solani为指示菌,从健康太子参块根内分离筛选出1株对该菌抑菌率达52.33%的拮抗细菌X14,利用形态、生理生化、16S rDNA及gyrA基因序列分析,明确该拮抗细菌为枯草芽孢杆菌(B.subtilis),该菌对细极链格孢菌(A.tenuissima)、尖孢镰刀菌(F.oxysporum)、齐整小核菌(S.tidis)、果生刺盘孢菌(C.fructicola)的菌丝抑制率在50%~70%之间,具有较大的生防潜力,可进一步用于田间验证以及抗菌机理的研究。

