肺原位移植瘤小鼠模型的建立
杨星九张文龙史旭东李梦媛张国新高苒*
(1. 中国医学科学院医学实验动物研究所 北京协和医学院比较医学中心,北京 100021;2. 国家人类疾病动物模型资源库,北京 100021;3. 国家卫生健康委员会人类疾病比较医学重点实验室,北京 100021;4. 北京市人类重大疾病实验动物模型工程技术研究中心,北京 100021)
肺癌是目前全球死亡率最高、且发生率第二的癌症[1]。目前肺癌治疗的主要方案是手术结合放疗和系统性化疗,然而在大多数临床病例中,肺癌仍然表现出明显的不良预后,肺癌患者的五年生存率明显低于其他癌症患者。对于肺癌研究而言,仍需要不断研究肺癌发展的机制,探索化疗药物对肺癌的治疗作用[2],而理想的肺癌动物模型是肺癌研究中的重要工具和研究桥梁。
肺癌动物模型主要包括化学诱导模型、基因工程模型、移植瘤模型等。相较于前两种模型而言,肺癌移植瘤模型因具备制备周期短、重复性高、易于跟踪等优点,在研究中被广泛应用[3]。
目前肺癌研究中应用较为常用的移植瘤疾病动物模型主要有两种,其一是肺癌的小鼠皮下移植瘤模型,另一种是经小鼠尾静脉注射形成的肺部转移瘤模型。前者操作简便,但是肿瘤发生发展脱离了肺部原本的微环境[3]。后者所构建的模型,相比于原发性肺癌的发生,更近似于模拟临床患者肿瘤的肺部转移而非发生情况。此外,尾静脉途径构建的肺转移瘤模型的肿瘤结节多而随机,难以对转移性肺肿瘤的发生发展过程进行跟踪和评价[4]。这两种模型在模拟临床肺癌病例时,均存在一定缺陷[5]。
为了更好的模拟临床肺癌病例,直接将肿瘤定植于小鼠肺的造模方式应运而生,即肺癌原位移植瘤模型。原位移植瘤的造模方法主要包括通过气道移植和从胸骨外直接注射两种方式。由于缺乏精确定位,其肺癌造模结果依然存在肿瘤结节多发、不易准确跟踪的可能[6-7]。为了解决上述问题,我们对前人方法进行了改进,通过影像学CT确认模型所需进针深度及进针位置,采用立体定位仪,精确控制进针位置、进针深度与进针角度,使用微量注射器精确控制细胞注射体积,将肿瘤细胞直接接种于小鼠肺部,建立了一种小鼠肺癌原位移植瘤模型。相较于之前的模型研究,原位移植瘤模型具有原发于肺部、定植位置明确、肿瘤结节单发等优点,更贴近于临床患者肺癌的发生及发展,并可利用分子影像学技术对肿瘤发展过程进行示踪记录。
1 材料与方法
1.1 材料
6只6周龄SPF级C57BL/6J雄性小鼠,体重16 ~ 18 g,购买自北京华阜康生物科技有限公司【SCXK(京)2019-0008】。饲养期间各组小鼠自由饮水,饲喂普通维持饲料由北京华阜康生物科技有限公司提供。饲养环境:昼夜各半循环照明,湿度恒定,温度控制在22 ~ 25℃,饲养于中国医学科学院医学实验动物研究所动物房【SYXK(京)2019-0039】。所有操作均符合中国医学科学院医学实验动物研究所伦理学要求(IACUC GR21003)。
1.1.2 细胞
LLC小鼠肺癌细胞(国家实验细胞资源共享平台,中国)。
1.1.3 主要试剂与仪器
Luc过表达慢病毒(吉凯基因,中国),0.25%胰酶-EDTA(Gibco,美国),PBS(Gibco,美国),Matrigel(BD,美国),D-Luciferin(泛博生化),CD3抗体(abcam,ab16669),CD19抗体(abcam,ab245235),F4/80抗体(abcam,ab16911),Ly6G抗体(abcam,ab25377),Ki-67抗体(abcam,ab16667),CD31抗体(CST,77699),α-SMA抗体(abcam,ab124964),Vimentin抗体(CST,5741S),E-cadherin抗体(CST,14472S)。Inveon微型CT扫描仪(西门子,德国),小鼠立体定位仪(正华生物,中国),30 g微量注射器(Hamilton,美国)。
1.2 方法
1.2.1 荧光素酶报告基因细胞构建
模型选用LLC小鼠肺癌细胞,购买自国家实验细胞资源共享平台,用含10% FBS的DMEM培养基培养,培养条件37℃,5% CO2。Luc过表达慢病毒购买自上海吉凯基因医学科技股份有限公司,将LLC细胞制备成浓度为5×104/mL的细胞悬液,接种2 mL于6孔细胞培养板中,于24 h后进行慢病毒感染。慢病毒的转染严格按照吉凯基因慢病毒使用操作手册进行。病毒感染72 h后,用6 μg/mL puromycin筛选细胞,并用3 μg/mL puromycin维持培养。构建成为LLC-luc细胞。
小学语文选取的课文,大多都是来源于生活,是对生活的一种体验。其实对于核心文化素质的培养也是这样,从生活中让学生体验到文化素质的意义,那学生的综合素质和情感都会更进一步提升。在语文课堂上和平时生活中,教师可以让学生仔细体会生活,通过对生活的感悟来提升自己的理解感知能力,从而激发情感,教化育人。例如,学习古诗《静夜思》时,教师就可以运用体验式教学,联合学生的实际或者自身的故事,给学生讲述离开亲人的无奈与痛楚,从而引导学生对于挂念父母亲人的这种思乡之情的体会和理解。并激发出学生孝顺父母的情感,达到情感和主旨的再次升华。这样对于学生体验式的培养,也有助于提高学生的核心素质。
1.2.2 细胞注射悬液制备
将LLC-luc细胞培养至汇合度达到80%,用0.25%胰酶-EDTA(Gibco,美国)消化成为单细胞悬液。1200 r/min,5 min离心后保留细胞沉淀,用PBS(Gibco,美国)吹洗1次再离心后,用预冷PBS重悬计数,使细胞浓度达到107/mL。Matrigel(BD,美国)提前置于4℃融化,用预冷枪头按体积比1∶1与细胞悬液混合,制备成细胞注射悬液,置于冰上。
1.2.3 肺原位移植瘤模型构建
模型选用C57BL/6J小鼠。手术前用1%戊巴比妥钠注射液麻醉,注射剂量100 mg/kg。将小鼠左前肢腋下至肋骨下沿处皮肤备皮。小鼠向右侧面位放置于小鼠立体定位仪操作台面上,用乙醇和碘伏消毒,切开皮肤,肌肉,暴露左侧肋骨。用30 g微量注射器吸取细胞注射悬液,于腋下第三、四肋骨间,垂直进针3.5 mm,缓慢注射10 μL细胞注射悬液,细胞注射量为5 × 104个。退针后缝合肌肉,皮肤(图1A)。为确保注射位置正确,对进针小鼠进行CT照射,可见注射器针头达胸腔左侧肺位置(图1B)。将术后小鼠放置于温暖环境,待小鼠清醒后正常饲养。对照组小鼠执行同样手术操作,不注射细胞,仅注射PBS/Matrigel混合液10 μL。

图1 小鼠肺原位肿瘤造模方法Note. A. Injection site of the othotopic cancer model. B. Injection site of the othotopic cancer model by CT imaging. Figure 1 Modeling of the othotopic cancer model
1.2.4 CT跟踪原位移植瘤生长
分别于模型构建第7、14、21天,用含2%异氟醚的医用氧(1 L/min)麻醉小鼠,置于Inveon微型CT扫描仪上。采用360°旋转,240次旋转,2次缩小基质尺寸,60 kV电压,400 μA电流,曝光时间800 ms,视场30 mm × 30 mm,获得小鼠胸部三维显微CT图像。采用中,高倍镜采集18 min,获得了30 μm的有效各向同性分辨率,所有后处理分析均采用高速CT重建系统(COBRA,SIEMENS临床前解决方案)进行。
1.2.5 生物素酶活体荧光成像检测
分别于模型构建第7、14、21天,小鼠腹腔注射15 mg/mL浓度D-Luciferin,注射量为10 μL/g体重。注射10 min后,使用含2%异氟烷的医用氧(1 L/min)诱导麻醉小鼠,使用PerkinElmer Lumina III小动物活体光学成像系统检测小鼠体内LLC-luc细胞活体荧光。
1.2.6 HE染色及免疫组化染色
肿瘤移植后第21天,小鼠脱颈处死后,取小鼠全肺置于福尔马林中固定。经过脱水浸蜡包埋切片后,对移植瘤肺部进行HE染色和免疫组化染色。免疫组化抗体为:CD3,CD19,F4/80,Ly6G+,Ki-67,CD31,α-SMA,vimentin,E-cadherin。
2 结果
2.1 同种原位移植肿瘤成功定植于左肺
LLC-luc细胞肺原位接种后第14天,CT影像学观察原位移植小鼠胸腔,可见左侧肺部存在单发性结节造影(图2A),HE病理可见肿瘤边缘存在一定浸润性生长(图2B)。解剖后与未接种肿瘤细胞的小鼠肺相比,明显可见小鼠左侧肺部存在单发性结节(图2C)。HE病理结果表明,该肺上单发性结节为肿瘤组织,与正常小鼠肺组织相比其细胞核仁明显,可见有丝分裂(图2D)。LLC-luc细胞经肺原位接种后成功定植于左肺。

图2 正常肺与肺原位模型肺脏器对比Note. A. Comparison of horizontal, coronal and sagittal CT images between uninoculated tumor mice and othotopic lung model. Red arrow. Tumor angiography. B. HE results of the lung of the othotopic cancer model. Red arrow. Mitosis. Yellow arrow. Tumor infiltration. C. Comparison of the lungs of the unvaccinated tumor mice and the lungs of the orthotopic cancer model. Yellow arrows. Tumor nodules. D. Comparison of HE in lung tissues of unvaccinated tumor mice and the orthotopic cancer model. Red arrow. Mitosis.Figure 2 Comparison of the normal lung tissue and the lung tissue of the orthotopic cancer model
2.2 小鼠肺原位肿瘤分子影像学示踪观察
LLC-luc细胞肺原位移植后,分别于术后第7、14、21天进行CT影像学观察(图3A)。通过高速CT重建系统对CT造影体积进行计算,绘制出肺原位移植瘤的生长曲线,可观察到肺原位移植瘤体积随时间变化逐渐增长(图3B)。通过荧光素酶活体荧光成像检测术后第7、14、21天的LLC-luc细胞肺原位移植瘤模型小鼠,可见LLCluc细胞定植成功后,仅原位定植于肺部,且其发光强度随着时间变化逐渐增强,说明肿瘤体积逐渐增长(图3C)。
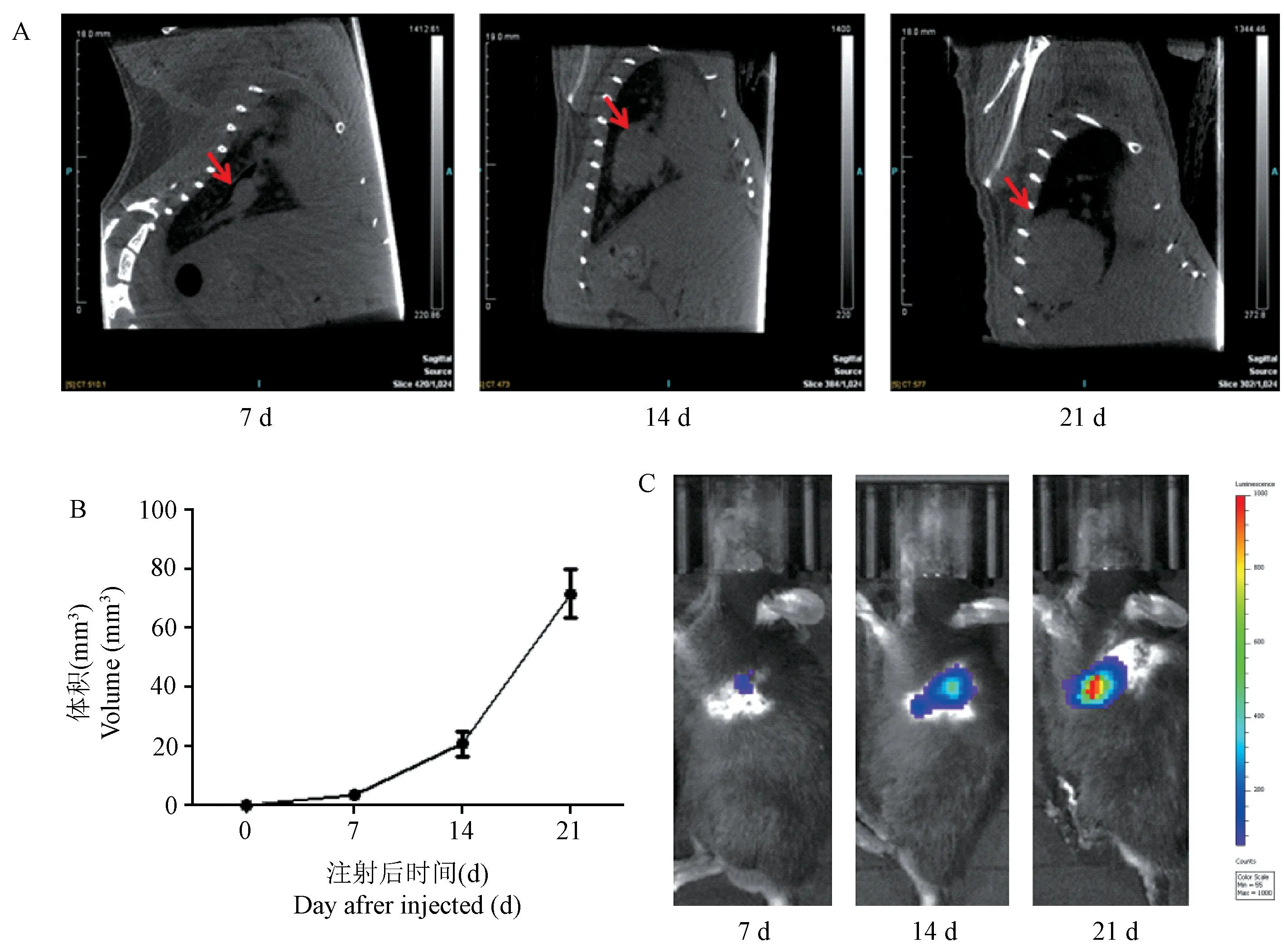
图3 对小鼠肺原位肿瘤体积进行跟踪观察Note. A. Tumor growth of the lung of orthotopic cancer model by CT imaging. Red arrow. Tumor angiography. B. Tumor volume curve by CT imaging in the lung of orthotopic cancer model. C. In vivo imaging fluorescence of tumor growth.Figure 3 Observation of the volume of the othotopic cancer model in mice
2.3 肺原位肿瘤模型的免疫学特征
通过肺原位肿瘤免疫组化实验探究肿瘤的免疫细胞浸润情况,可以观察到与正常肺组织相比,肿瘤内部存在一定量的T细胞(图4)浸润,B细胞、巨噬细胞及中性粒细胞(图4)浸润不明显。

图4 肺原位模型的免疫学特征Figure 4 Immunological characteristics of the orthotopic lung cancer model
2.4 肺原位肿瘤模型增殖及微环境特征
通过对肺原位肿瘤进行免疫组化染色,与正常肺组织相比,可以观察到原位肿瘤组织中Ki67呈阳性(图5),肿瘤组织生长旺盛。通过CD31染色可见肿瘤内部分布大量微小血管(图5)。对肿瘤相关成纤维细胞标志物α-SMA染色可见(图5),肿瘤组织中肿瘤相关成纤维细胞浸润明显。该肿瘤模型在肿瘤上皮间质转化方面,肿瘤组织E-钙黏蛋白表达缺失(图5),波形蛋白Vimentin表达明显(图5),表明肿瘤组织在模型构建过程中发生上皮间质转化。文献报道肿瘤的上皮间质转化与肿瘤的转移密切相关,由此肺原位模型的肿瘤组织存在转移的潜质。
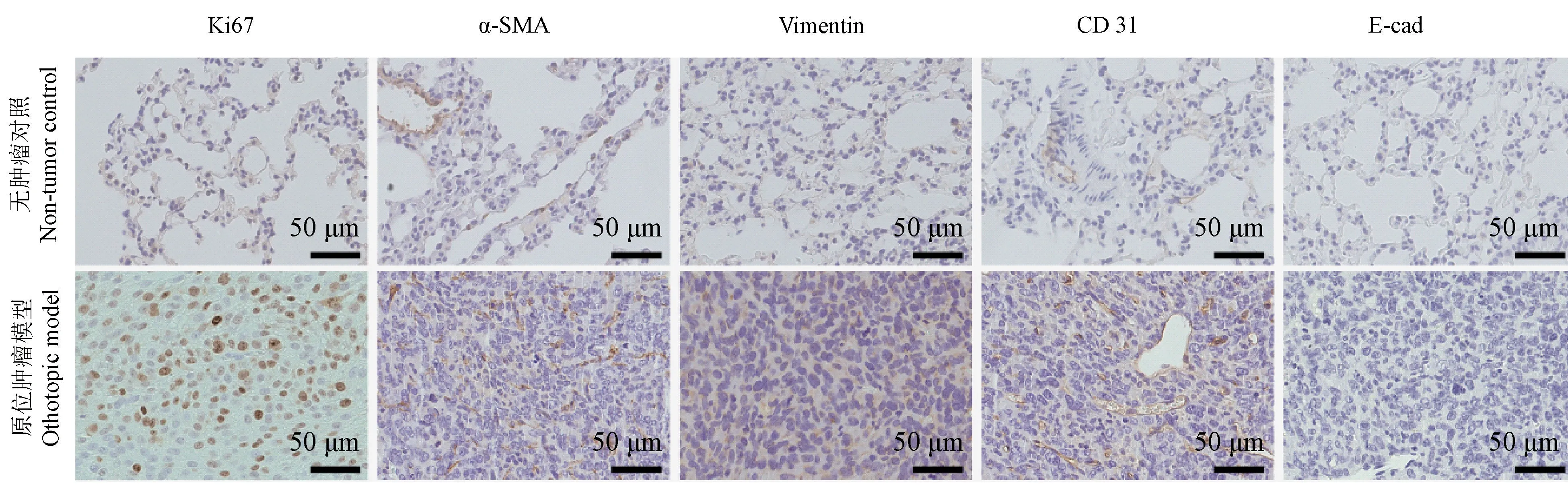
图5 肺原位肿瘤模型增殖及微环境特征Figure 5 Characteristics of proliferation and microenvironment of the orthotopic lung cancer model
3 讨论
合适的肿瘤动物模型对于肺癌研究有着不可或缺的作用。与皮下移植瘤肿瘤小鼠模型和肺转移肿瘤模型相比,虽然肺癌原位小鼠模型在构建技术上有一定难度,但是原位模型中肿瘤发生微环境更贴近于临床肺癌的实际情况。不论是肿瘤转移、肿瘤免疫还是药物呈递过程,肺癌原位小鼠模型在模拟临床病程的过程中均有一定的优势[3]。目前研究中常用的肺癌原位小鼠模型主要包括化学诱导模型、基因工程模型、肺原位移植瘤模型等[3]。其中化学诱导模型是通过注射或鼻饲致癌剂的方法,诱发小鼠肺癌。常用的致癌诱变剂有乌拉坦等[8-9]。该模型发病周期长、发生位点不明确、难以跟踪监测,且与大部分临床病例肿瘤发生机制不符;基因工程模型是通过胚胎编辑技术,对小鼠的癌基因进行突变,使得小鼠生长过程中自发肺癌。基因工程模型根据模型设计所需,可以定时定向突变肺部基因,肺癌发生机制与临床相似。如K-ras突变肺癌模型是代表性模型之一[10],其模型与K-ras突变的临床病例有着很高的相似性。然而该模型仍存在发病周期长,示踪监测困难等缺点[11]。近年来,肺原位移植瘤模型也逐渐出现在研究中。肺原位移植瘤模型则是通过原位注射或手术移植等方法,直接将肺癌细胞株原位接种定植于小鼠肺部[6-7]。相较于化学诱导模型和基因工程模型,该模型可以快速完成肿瘤的形成,且肿瘤定植位点明确,便于跟踪监测肿瘤生长。本文中的肺原位移植瘤模型,由于小鼠肺叶结构为一叶左肺,四叶右肺,因此将肺癌组织单一接种于小鼠左肺,便于肿瘤生长位点的一致性。免疫组化染色证明,模型中肿瘤组织具有分裂旺盛,血供丰富,上皮间质转化发生等特点。本模型构建方法明确,可重复性好,利用分子影像学手段可对肿瘤生长进行明确地示踪观察,适用于肿瘤生长相关研究或化疗药的探索。因此,肺癌原位小鼠模型是研究肺癌发生发展的有力工具之一。
在肿瘤治疗中,免疫系统起到多方面作用。一方面免疫细胞,包括T细胞、M1型巨噬细胞、DC细胞等,会对肿瘤组织起到杀伤作用,抑制肿瘤生长[12]。通过抑制免疫检查点,例如PD-1/PD-L1的结合,能有效提高免疫细胞对肿瘤的杀伤作用[13]。另一方面,部分免疫细胞,例如M2型肿瘤相关巨噬细胞,在肿瘤生长及浸润转移方面会起到趋化效果[14]。因此本文的模型构建选用的是免疫系统健全的C57BL/6J小鼠,以及该小鼠同源肺癌细胞系LLC细胞。相较于前人研究中,用人源肺癌细胞接种于免疫缺陷小鼠的模型[15],本模型特点在于免疫系统完全参与到了小鼠肺癌生长过程中,可明确观察到免疫细胞对肿瘤组织的浸润,对于肿瘤生长过程中的免疫系统作用的研究能起到有用的帮助,更好地模拟了临床肺癌病例中遇到的问题和困难。
相较于其他肺癌原位模型,本模型亦存在不足,由于肿瘤细胞来源不是人源细胞,在模型构建过程中,可能会由于人鼠之间的基因差异,导致分子机制存在差别。为了解决这个问题,在未来的研究中,我们将探索利用人源肺癌细胞和人源化小鼠,构建免疫人源化肺原位移植瘤小鼠模型,为临床前研究提供更符合临床病例的研究工具。