化学实验题解答策略
——明确实验目的,分析实验原理,正确解答问题
刘 影 李 康 陈 诚
(安徽省宿州市宿城第一中学)
化学是以实验为基础的自然科学,化学实验不仅是化学教学中非常重要的组成部分,也是现在高考中考查的重点和难点.常见的考查题型有物质制备型实验题、物质性质验证型实验题和探究型实验题.这类题不论以什么形式呈现,解题的基本策略大同小异.解题时要先明确实验目的,即通过这个实验,我们想达到什么目的(不外乎是制备某种物质、验证或探究某种物质的某种或某些性质等).在明确实验目的的基础上,结合自身知识体系和题目中所给信息,分析出实验原理.也就是说,为了达到上述实验目的,采取什么样的方法(实验原理通常以反应方程式的形式呈现).在明确原理的基础上,再去分析各装置或操作的作用,进而正确解答问题.在这一策略中,明确实验目的是根本,分析实验原理是灵魂,在完成前述活动的基础上,正确解答问题就水到渠成了.
在解答实验题时,一定不能本末倒置,不能开始就去分析甚至去猜装置的作用、操作的目的等,这样往往既浪费时间,也不能正确解答.本文分类展示各题型解答过程,希望可以给学生提供一些帮助.
1 制备型实验题
该类题型的实验目的通常是为了制备某一物质,实验原理基本为制取该物质的化学反应方程式.常见实验过程为实验原料的预处理(净化、粉碎等)→物质制备→净化除杂→物质收集→尾气处理.装置的选择也是围绕这一过程,为了实现这一过程而确定的,通常有发生装置、除杂装置、收集装置和尾气处理装置.
这种题型较经典,考查难度通常不大,对于一些陌生物质的制备,结合题目所给信息,利用这一解题策略,可以轻松应对.
例1无水四氯化锡(SnCl4)可用于制作导电玻璃,导电玻璃广泛用于液晶显示屏、薄膜太阳能电池基底等.可用图1所示装置制备四氯化锡(部分夹持装置已略去).有关信息如表1所示.
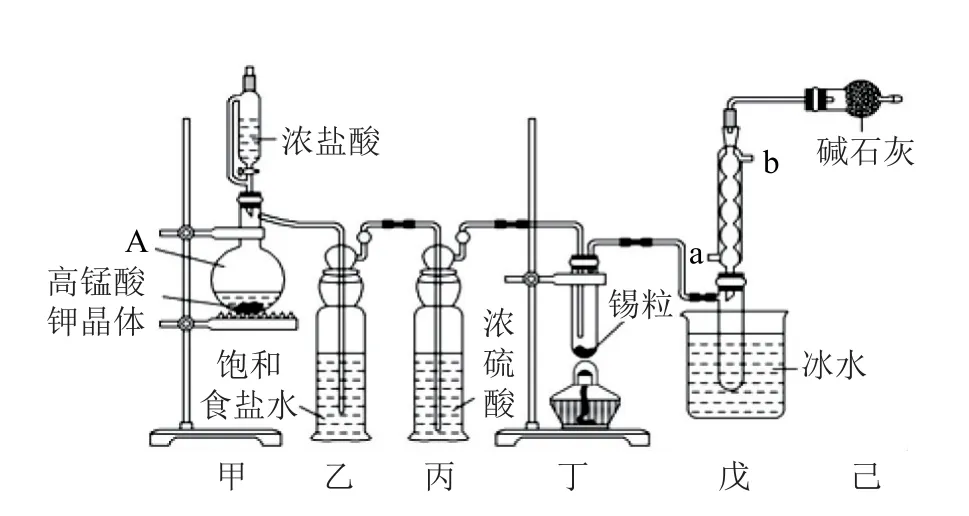
图1
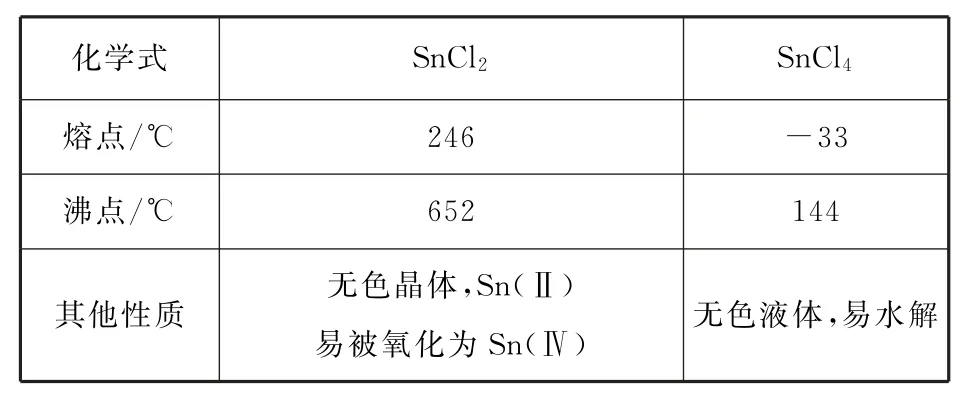
表1
回答下列问题:
(1)仪器A 中发生反应的离子方程式为______.
(2)将装置按图1所示连接好,检查气密性,慢慢滴入浓盐酸,待观察到_________(填现象)后,开始加热丁装置.锡熔化后适当增大氯气流量并继续加热丁装置.继续加热丁装置的目的是促进氯气与锡反应和_________.
(3)如果缺少乙装置可能产生的后果是_________.
(4)戊装置中球形冷凝管的冷水进口为_________(填“a”或“b”).
(5)己装置中碱石灰的作用是_________.
(6)碘氧化法滴定分析产品中Sn(Ⅱ)的含量.准确称取mg产品于锥形瓶中,用适量浓盐酸溶解,以淀粉溶液作指示剂,用cmol·L-1碘标准溶液滴定.滴入最后1滴标准溶液,出现_________时达到滴定终点,此时消耗碘标准溶液VmL,则产品中Sn(Ⅱ)的质量分数为_________(用字母表示).

该实验的目的为制备无水SnCl4,由装置可以看出在丁处试管内发生反应制得目标产物,该实验原理为.在明确实验原理的基础上,结合装置图,可知甲是氯气发生装置.(1)仪器A 中的离子反应方程式为10Cl-+16H++=5Cl2↑+8H2O+2Mn2+.(2)乙是除杂装置,除去Cl2中混有的HCl杂质气体,丙为干燥装置,进入丁中的就是干燥纯净的Cl2,待观察到丁装置内充满黄绿色气体后,开始加热装置丁;结合题目所给信息,由SnCl2和SnCl4的熔、沸点数据可以看出,丁装置的作用为制备SnCl4,并利用其沸点低的性质加热以促进SnCl4汽化,使SnCl4蒸气进入戊中便于收集;同时由于SnCl4的沸点较低,戊装置作用为冷凝回流收集SnCl4,提高SnCl4的产率.(3)乙是除杂装置,除去Cl2中混有的HCl杂质气体.(4)冷凝管中的冷却水应由下口进入.(5)制取SnCl4过程中由于Cl2不能完全反应,需要对尾气进行处理,则己装置中碱石灰的作用是吸收未反应的氯气,防止污染空气,同时可以防止水蒸气进入戊装置的试管中使产物水解.(6)对滴定终点的判断描述可以套用答题模板:当滴入最后1滴碘水,溶液变蓝,且30s内不恢复至无色,则达到滴定终点.再根据反应方程式进行计算,可得此时消耗碘标准溶液VmL,由Sn2++I2=Sn4++2I-,可知n(SnCl2)=n(I2)=cV×10-3mol,Sn(Ⅱ)的质量分数为
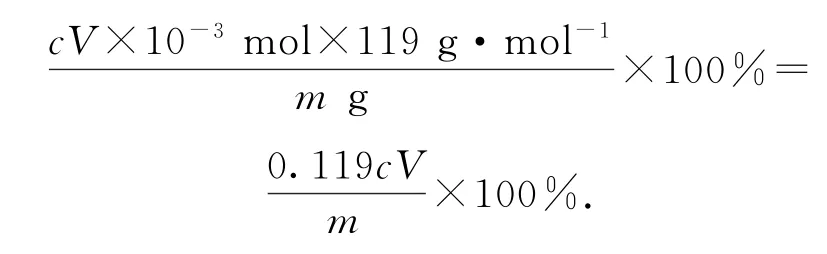
变式氢化钙固体是登山运动员常用的能源提供剂.某兴趣小组拟选用如图2 所示的装置制备氢化钙.
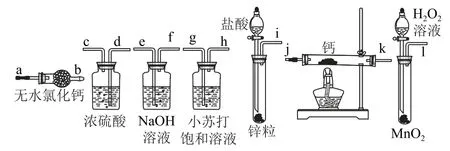
图2
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为________(填仪器接口的字母编号).
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞________(请按正确的顺序填入下列步骤的标号).
A.加热反应一段时间
B.收集气体并检验纯度
C.关闭分液漏斗活塞
D.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色,该同学据此判断,上述实验确有CaH2生成.
①写出 CaH2与水反应的化学方程式________;
②该同学的判断不正确,原因是_________.
(4)请设计一个实验,用化学方法区分钙与氢化钙,写出简要实验步骤及观察到的现象_________.
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是_________.
答案(1)i→e,f→d,c→j,k(或k,j)→a.
(2)B、A、D、C.
(3)①CaH2+2H2O=Ca(OH)2+2H2↑.
②金属钙与水反应也有类似现象.
(4)取适量氢化钙,在加热条件下与干燥氧气反应,将反应气相产物通过装有无水硫酸铜的干燥管,观察到白色变为蓝色;取钙做类似实验,观察不到白色变为蓝色.
(5)氢化钙是固体,携带方便.
2 验证型实验题
该类题型往往既考查物质的性质,又考查物质的制备,通常以对物质性质的考查为主.需要学生根据题目要求分析验证物质的性质,确定实验原理,寻找所需试剂、仪器及方法,对于多种性质的验证,要根据互不干扰的原则确定性质验证的顺序.解这类题型的难点在于确定物质性质验证的先后顺序,要求学生要扎实掌握元素化学和实验化学的基础知识,对学生灵活运用知识解决实际问题的能力素养要求较高.
例2Fe3O4是一种非常重要的磁性材料,同时也可用作催化剂载体和微波吸收材料.Fe3O4有多种不同制法.甲同学查阅资料发现,温度高于570℃时铁与水蒸气反应的氧化产物只有Fe3O4.该同学利用图3装置(部分装置已略去)进行“铁与水蒸气反应”的实验,并检验产物.

图3
请回答下列问题:
(1)仪器D的名称是________,E装置的作用是_________.
(2)装置B 中发生反应的化学方程式为_______.
(3)若甲同学称取16.8gFe粉放于硬质玻璃管B中,在温度高于570 ℃,反应一段时间后停止加热,冷却后称得固体质量为20.0g,则实验后的固体物质中氧化物的质量为________g;取实验后的固体加入过量盐酸充分反应,检验溶液中是否含有Fe2+的方法是向溶液中滴加_________.
A.酸性高锰酸钾溶液
B.硫氰化钾溶液再通氯气
C.NaOH 溶液
D.铁氰化钾溶液

该实验的目的是制备Fe3O4并验证产物中是否有氢气,原理为:用A 装置产生水蒸气,通入装有还原铁粉的B中,若发生反应则生成Fe3O4和H2.对生成的H2利用CuO 进行验证,所以D 装置作用为干燥H2,E 装置中的CuO 可以和H2反应生成铜和水,通过E 中粉末颜色由黑变红,可以检验生成的氢气.根据反应前后固体质量的变化,利用差量法进行计算,由于铁与水蒸气反应的氧化产物只有Fe3O4,根据反应方程式:
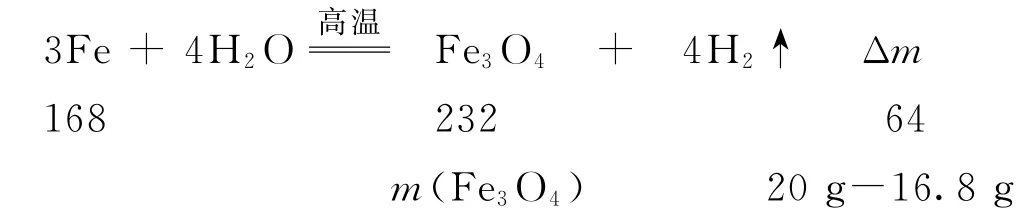
计算可知生成的Fe3O4的质量为11.6g,物质的量为0.05mol,则铁的质量为20g-11.6g=8.4g,物质的量为0.15mol.向实验后的固体中加入过量盐酸充分反应,铁粉过量,所以反应后的溶液中只有Fe2+.Fe2+的检验可以用可溶性碱溶液、铁氰化钾溶液、硫氰化钾和氯水等.本题中用过量盐酸溶解固体,不能用酸性高锰酸钾溶液,因为溶液中有Cl-,容易被酸性高锰酸钾溶液氧化,对Fe2+的检验存在干扰.
变式图4虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白.
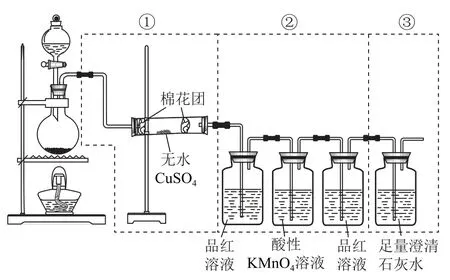
图4
(1)如果将装置中①②③三部分仪器的连接顺序变为②①③,则可以检出的物质是_________;不能检出的物质是_________.
(2)如果将仪器的连接顺序变为①③②,则可以检出的物质是_________;不能检出的物质是_________.
(3)如果将仪器的连接顺序变为②③①,则可以检出的物质是_________;不能检出的物质是_________.
答案(1)SO2、CO2;H2O.(2)H2O;SO2、CO2.(3)SO2、CO2;H2O.
3 探究型实验题
该类题型对学生来说难度较大,主要原因是学生不能准确把握出题人的意图,不知道从何下手.在平时解题时可以利用本文的解题策略,静下心来,认真读题,首先从实验目的出发,提出合理的假设,确定可行的原理,然后再根据实验原理设计方案,通过实验现象,分析得出结论.这种题型通常也是建立在物质制备或物质性质基础上的探究,起点虽高,但是落点较低,学生一旦正确领悟了出题人的意图,探究起来就得心应手,正确解答也不再困难.
例3某兴趣小组设计实验探究SO2与新制Cu(OH)2悬浊液反应的产物.按图5连接好装置(夹持装置省略),打开磁搅拌器,先往CuCl2溶液中加入NaOH 溶液至恰好完全反应,再通入过量的SO2,三颈烧瓶中生成大量白色沉淀X.
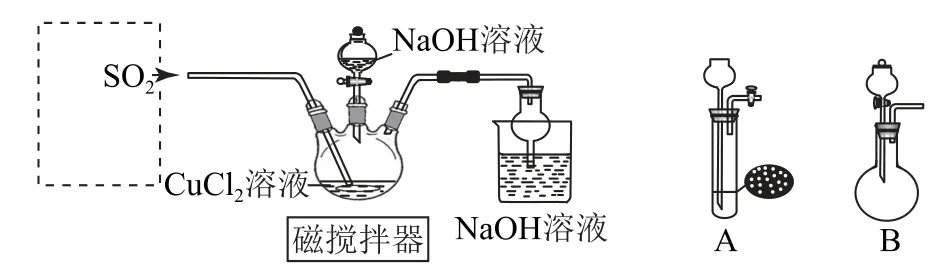
图5
(1)制取SO2最适宜的试剂是_________.
A.Na2SO3固体与20%的硝酸
B.Na2SO3固体与20%的硫酸
C.Na2SO3固体与70%的硫酸
D.Na2SO3固体与18.4mol·L-1的硫酸
(2)根据选定的试剂,虚框中应选用_________(填“A”或“B”)装置;通入SO2过程中不断用磁搅拌器搅拌的目的是_________.
(3)甲同学推测X 可能为CuSO3.他取出少量洗涤后的X 加入足量稀硫酸进行实验验证,观察到________,则甲同学推测错误.
(4)乙同学查阅资料:CuCl为白色固体,难溶于水,能溶于浓盐酸形成;与氨水反应生成,在空气中会立即被氧化成深蓝色溶液,据此推测X可能为CuCl.该同学取出少量洗涤后的白色沉淀X,加入浓盐酸,沉淀溶解,加水稀释,又出现白色沉淀,据此得出乙同学推测正确.
①从平衡角度解释加水稀释重新产生白色沉淀的原因________.
②请再设计一种证明该白色沉淀为CuCl的方案:_________.
③三颈烧瓶中生成CuCl的离子方程式为____.

(1)该实验是为了探究SO2和新制Cu(OH)2悬浊液反应的产物,虚框内应为SO2发生装置,制备原理:用Na2SO3固体与70%的硫酸反应.因为70%的硫酸中存在少量的水,该浓度的硫酸可以电离出氢离子与亚硫酸钠发生反应生成二氧化硫,若用浓硫酸,则不能电离出氢离子,而若硫酸浓度太小,SO2又可溶于水,使产率降低,因此70%的硫酸最佳.(2)由于亚硫酸钠遇水溶解,发生装置应选B,因为A装置一般要求使用块状固体;搅拌的目的是:使反应物接触更充分,加快反应速率.(3)甲同学推测X 可能为CuSO3,探究的原理为CuSO3+H2SO4=CuSO4+SO2↑+H2O.若未观察到气泡冒出,则甲同学推测错误.(4)由三颈烧瓶中加入的试剂CuCl2和查阅资料所得信息,学生不难推测出白色沉淀可能为CuCl,从平衡角度解释加水稀释重新产生白色沉淀是因为存在平衡:,加水使Cl-浓度减小,由于Q>K,平衡逆向移动,利用题给信息,可以用过量氨水设计实验证明该白色沉淀为CuCl:向白色沉淀X中,加入过量的氨水,露置于空气中迅速得到深蓝色溶液.综上所述,结合SO2有还原性,二价铜有氧化性,可以写出三颈烧瓶中SO2与新制Cu(OH)2悬浊液(存在未反应完的CuCl2)反应生成CuCl的离子方程式为

变式某兴趣小组为培养学生对科学探究的兴趣,设计图6所示实验来探究与Cu2+的反应.
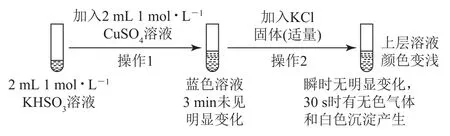
图6
已知:氯化亚铜(CuCl)为白色立方结晶或白色粉末,难溶于水.回答下列问题:
(1)若用CuSO4·5H2O 配制100 mL 1 mol·L-1CuSO4溶液,需用托盘天平称取CuSO4·5H2O 的质量为_________.甲同学在定容时采用图7方式观察,则所配制的CuSO4溶液浓度________(填“偏高”或“偏低”).

图7
(2)将操作2生成的无色气体通入氯化铁溶液,_________(填实验现象),说明该气体为SO2,反应的离子方程式为_________.
(3)操作2生成的白色沉淀为_________(填化学式),生成该沉淀和无色气体的反应离子方程式为________.
答案(1)25.0g;偏低.
(2)溶液由黄色变浅绿(或黄色变浅);SO2+.
高考中的实验题,主要以实验装置图为载体,以实验设计及探究分析能力的考查为重点,以物质制备的探究型实验题为命题趋势,兼顾基本实验操作、实验方法、误差分析、实验计算等.因此不仅要求学生知识储备要丰富,还对学生运用知识解释现象、解决问题等能力提出了更高的要求,是对学生综合能力的系统性考查,学生在运用自身知识体系的基础上,根据解题策略,按先明确实验目的,后分析实验原理,最后再去解答问题的顺序进行分析,可以做到目标明确,思路清晰,能又快又好地解答实验题.
(完)

