有关核外电子排布规则的一些问题
王笃年(正高级教师)
(北京十一学校)
问题1Mg原子的第一电离能高于与它左右相邻的Na、Al原子,为什么不能说是因为Mg基态电子排布为3s2全充满结构?
首先,与Na相比,Mg的第一电离能大,主要因为其原子半径小而核电荷数大,故原子核对最外层电子的吸引力强,这也是符合同周期元素递变规律的,与核外电子排布的稳定性关系较小.
其次,Mg和Al相比,原子半径大且核电荷数小,理论上其第一电离能应低于Al,但实测数据却显示I1(Mg)>I1(Al).这就令我们不得不从别的方面寻找原因.于是有了洪特规则特例(有的教科书称之为“洪特规则补充规则”):当等价轨道(能量、大小、形状都相同的轨道,又叫“简并轨道”)电子排布为全充满、半充满或全空时,原子结构相对稳定.
注意,洪特规则特例只适用于“等价轨道”电子排布.3s轨道只有1个,并不存在等价轨道.试想,如果说由于3s 轨道全充满符合洪特规则特例,那么3s0(空)、3s1(半满)岂不也都符合洪特规则特例了吗?每一种状态都是稳定的吗?
因此,在解释Mg、Al第一电离能数据关系的时候,只能说Mg的最外层电子排布为3s23p0,3p亚层的3 个等价轨道属于全空结构,这符合洪特规则特例,相对比较稳定,而不可说3s2充满更稳定.
问题2既然等价轨道上电子半充满稳定,为什么基态碳原子的价电子排布不是2s12p3?
核外电子排布遵循的几条规律是有次序的,总的规则是能量最低原理.由于2s、2p能级间的能量差较大,碳原子进行核外电子填充时,要优先按照能量最低原理,即填满了2s轨道后再填充2p轨道.我们注意到,洪特规则特例只用来解释能量极其接近的3d、4s轨道间排列时的情况,只涉及几种元素的原子,不可滥用.
问题3按铜的基态电子排布[Ar]3d104s1,铜应该是+1 价比较稳定,如何理解铜的常见化合价为+2价?
元素的稳定化合价确实与价电子结构有关,但价电子结构并非唯一决定因素.离子存在的环境(氧化性还是还原性)、离子的水合能大小等因素,也影响着其常见价态的稳定性.目前看来,在氧化性的氛围下、水溶液里的确是+2价的铜元素比较稳定.如果把氧化铜(Cu呈+2价)高温加热,它会分解为氧化亚铜(Cu呈+1价),这说明高温下+1价的铜比较稳定,这与基态铜的价电子排布一致.
单纯从铜原子的基态电子排布看,其+2价确实不好理解.但是我们要知道,3d、4s轨道间的能量差本来很小,我们说铜原子的基态价电子排布为3d104s1,这是按照洪特规则特例的写法,如果不考虑这个非常特别的规则,它有可能是3d94s2,这样,铜失去最外层2个能量相对较高的电子,就是+2价了.这种说法貌似不可接受,如果我们从另外的角度想一想,为什么周期表中把ⅠB族列入ds区? 元素在周期表中属于哪个区,决定于其能量最高的电子处于哪个能级.Cu处于ds区的事实本身,就反映出它能量最高的电子说不清楚到底是在3d还是在4s,毕竟它们之间的能量差很小很小.
问题4铜原子的价电子是11个,它能够全部失去这些价电子呈+11价吗?
目前还没有人能够运用化学手段让铜失去全部的11个价电子.但是,在科学界有关价电子性质的研究一直在不断进行着.
十几年前,人们认识到的元素化合价最高只是+8,如四氧化锇OsO4、四氧化钌RuO4、四氧化氙XeO4中的Os、Ru、Xe等.2010年,科学家借助计算手段从理论上得出结论,认为处于第Ⅷ族、拥有9个价电子的铱Ir元素(核外电子排布[Xe]4f145d76s2)有可能以的形式稳定存在,其中铱为+9价.四年后,我国学者采用脉冲激光溅射法先后获得了中性的四氧化铱分子IrO4(Ir 为+8 价)、四氧化铱正离子(Ir为+9价),突破了元素最高氧化态的纪录.再后来,还有学者通过化学计算指出,铂的一种离子(其中Pt为+10 价)也是有可能稳定存在的(尽管这一计算结果尚未得到实验证实).
这些理论计算和实际研究结果说明,价电子的确是可能在一定条件下参与化学反应的能量相对较高的电子.只是,当元素的原子失去较多电子形成很高价态时,其结构会变得很不稳定,具有极强的氧化性.
问题5何谓“n+0.7l规则”,它有什么实际的应用价值?
“n+0.7l规则”是我国化学家徐光宪教授(中国科学院院士)提出的一个关于计算、比较不同能级(轨道)能量高低的经验规则.其中n是该轨道的主量子数(即电子层序数,K 层的n取值为1,L层的n取值为2,……),l为副量子数(s亚层对应的l值为0,p亚层对应的l值为1,……).1s~4f能级的“n+0.7l”值如表1所示.
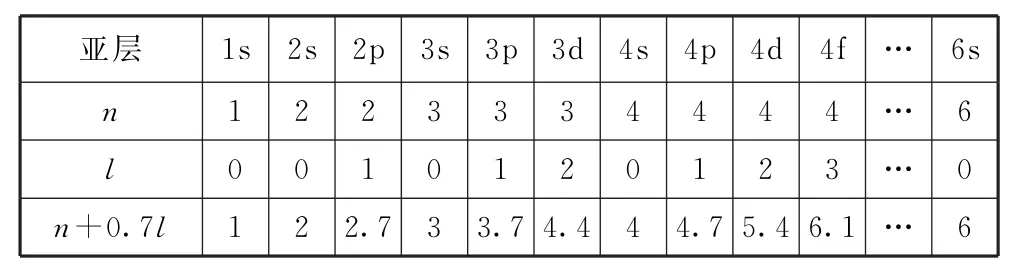
表1
可见,3d轨道的“n+0.7l”值为4.4,大于4s轨道的“n+0.7l”值(4);4f轨道的“n+0.7l”值为6.1,大于6s轨道的“n+0.7l”值(6),这与教科书里所讲的能级交错现象是一致的.
另外,徐光宪教授还将“n+0.7l”值首位数相同的能级归入同一个能级组,能级组序数与元素所在的周期序数相等,而非简单地看能层数.例如,上述1s属于第一能级组;2s、2p属于第二能级组;3s、3p属于第三能级组;3d、4s、4p则同属于第四能级组…… 这样算来,只有4个电子层的钯元素隶属于第五周期就得到了圆满的解释,因为其4d亚层的“n+0.7l”值为5.4,首位数字是5,属于第五能级组,对应于第五周期.
需要注意的是,“n+0.7l”规则仅是一个经验式,并非经过严密的数学推导所得,有其片面性,它较好地适用于外围电子,不宜无限制地推广滥用.
(完)

