模型化解决平衡常数的计算问题
杨金美 赵雷修
(1.昆明市第一中学西山学校 2.西南林业大学)
1 问题的提出及模型的建立
《普通高中化学课程标准(2017 年版2020 年修订)》要求能书写平衡常数表达式,能进行平衡常数的简单计算.分析近3年全国卷高考试题(如表1)可知,每年每套试卷都有考查平衡常数的计算知识,而学生在这一问题,特别是填空题中的平衡常数计算类问题得分率比较低.
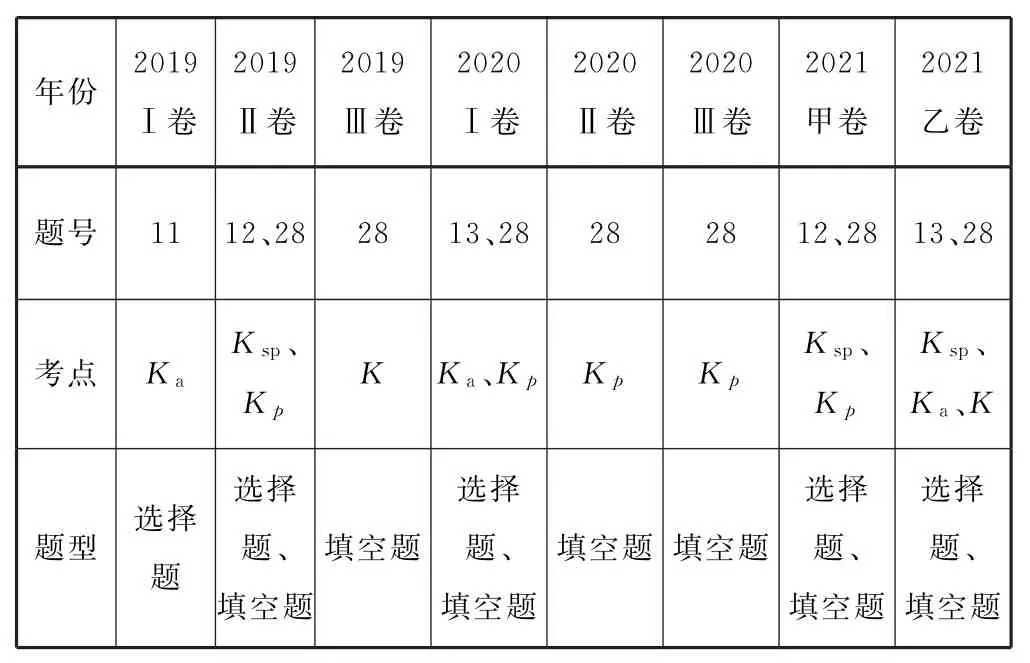
表1
分析本知识的特点,结合高考题对本知识的考查方式,建立以下模型(如图1)进行平衡常数的计算,可以更快地找准思路,提高计算的正确率.
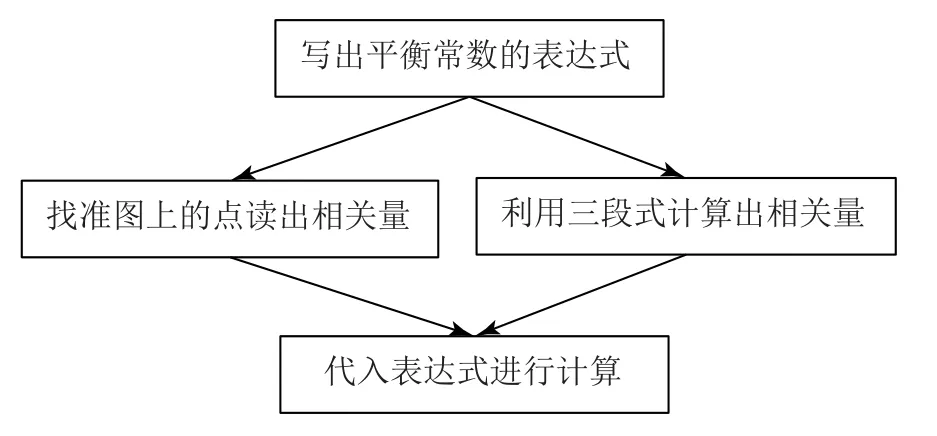
图1
2 模型的运用
2.1 Ka、Ksp的计算
例1(2020 年全国Ⅰ卷)以酚酞为指示剂,用0.1000mol·L-1的NaOH 溶液滴定20.00mL未知浓度的二元酸H2A 溶液.溶液中,pH、分布系数δ随滴加NaOH 溶液体积V(NaOH)的变化关系如图2所示.[比如 A2-的分布系数:δ(A2-)=下列叙述正确的是( ).
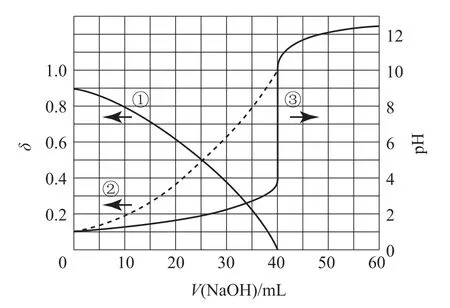
图2
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A 溶液的浓度为0.2000mol·L-1
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)

HA-的电离常数Ka的表达式为;由图可知,加入40 mL NaOH 溶液时,溶液的pH 发生突变,又知H2A 为二元酸,则H2A 的浓度为0.1mol·L-1,0点时没有加入NaOH 溶液,H2A 溶液的pH 为1.0,曲线①、②代表组分δ之和为1,分析可知H2A 第一步为完全电离,曲线①代表δ(HA-),曲线②代表δ(A2-),则曲线①、②交点处c(HA-)=c(A2-),此时对应pH=2.0;代入表达式计算Ka=c(H+)=10-2,选项C 正确.答案为C.

计算本题的Ka关键有两点:一是判断出曲线①、②分别代表δ(HA-)、δ(A2-),确定可以用曲线①、②的交点进行计算;二是读取曲线①、②交点处的pH 时,不要根据交点直接对应pH 轴读数,要在曲线③上找出与交点横坐标相同的点,然后对应pH 轴读数.
例2(2021 年全国甲卷)已知相同温度下,Ksp(BaSO4)<Ksp(BaCO3).某温度下,饱和溶液中与-lg[c(Ba2+)]的关系如图3所示.下列说法正确的是( ).
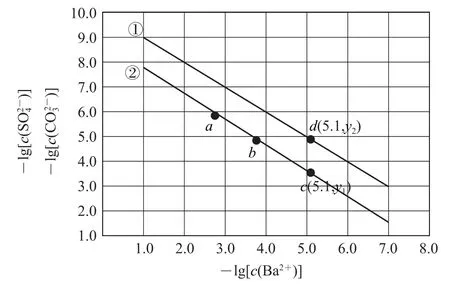
图3
A.曲线①代表BaCO3的沉淀溶解曲线
B.该温度下的Ksp(BaSO4)值为1.0×10-10
C.加适量BaCl2固体可使溶液由a点变到b点
D.c(Ba2+) = 10-5.1时两溶液中

写出 表达式Ksp(BaSO4)=c(Ba2+)×;本题横、纵坐标均为离子浓度的负对数,因此坐标值越大,表示离子浓度越小,因为Ksp(BaSO4)<Ksp(BaCO3),所以判断①为BaSO4的沉淀溶解曲线,②为BaCO3的沉淀溶解曲线,选项A错误.曲线①上的点均应该符合BaSO4的Ksp,凡是曲线①上能够读出数值的点,均可用于计算;故将曲线①上点(7.0,3.0)代入表达式计算Ksp(BaSO4)=,选项B 正确.a点存在BaCO3的沉淀溶解平衡:BaCO3(s)⇌,加适量BaCl2固体,c(Ba2+)增大,-lg[c(Ba2+)]减小,a 点的横坐标应该减小,c(Ba2+)增大,平衡逆向移动,减小,增大,a点纵坐标增大,选项C 错误.c(Ba2+)=10-5.1时,由d点读出=y2,即,由c点读出y1,即,代入数据计算得,选项D 错误.答案为B.

需要注意的是本题中横、纵坐标均为离子浓度的负对数,即坐标值越大表示离子浓度越小.
例3(2021年全国乙卷)HA 是一元弱酸,难溶盐MA 的饱和溶液中c(M+)随c(H+)而变化,M+不发生水解.实验发现,298K 时c2(M+)~c(H+)为线性关系,如图4 中实线所示.下列叙述错误的是( ).
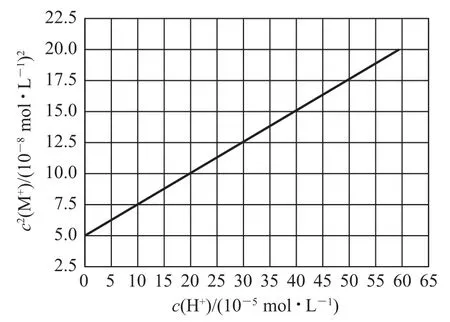
图4
A.溶液pH=4时,
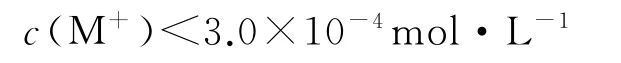
B.MA 的溶度积Ksp(MA)=5.0×10-8
C.溶液pH=7时,
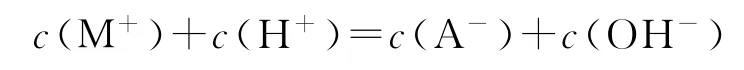
D.HA 的电离常数Ka(HA)≈2.0×10-4

MA 的溶度积Ksp(MA)=c(M+)×c(A-);MA 的饱和溶液中存在沉淀溶解平衡:MA(s)⇌M+(aq)+A-(aq),当未加H+,即c(H+)=0时,c(A-)=c(M+),Ksp(MA)=c(M+)×c(A-)=c2(M+),所以0 点的数据可用于计算;代入数据,Ksp(MA)=c(M+)×c(A-)=c2(M+)=5.0×10-8,选项B正确.
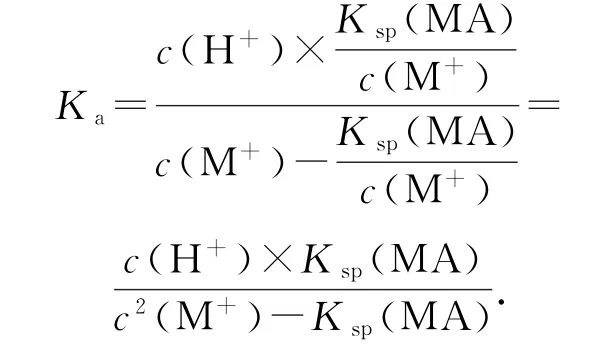
线上任意能够读出数值的点均可用于计算,取点(10,7.5)代入计算,有
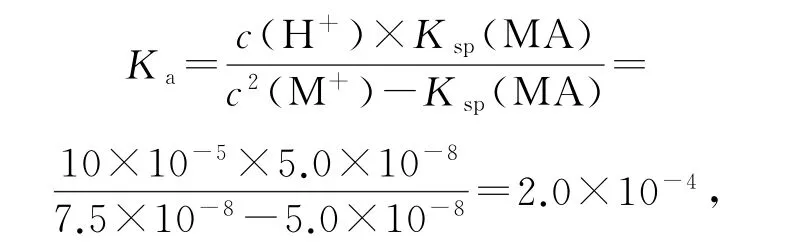
选项D 正确.答案为C.

选项B计算Ksp(MA)的关键是判断哪个点c(M+)×c(A-)=c2(M+),即c(A-)=c(M+);选项D 要用已经计算出的Ksp(MA)和图中可以读出的c(M+)代换c(A-).
2.2 K、Kp 的计算
例4(2019年全国Ⅲ卷,节选)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长.因此,将氯化氢转化为氯气的技术成为科学研究的热点.回答下列问题:
Deacon发明的直接氧化法为
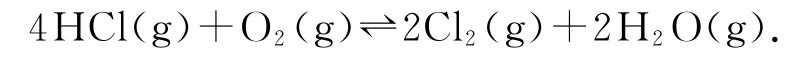
如图5为刚性容器中,进料浓度比c(HCl)∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系.
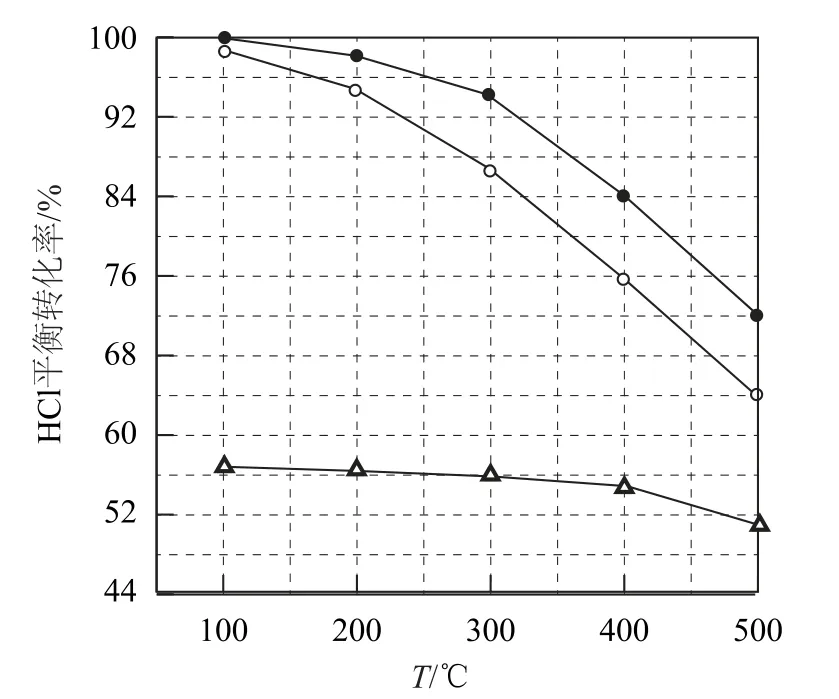
图5
设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400°C)=______(列出计算式).

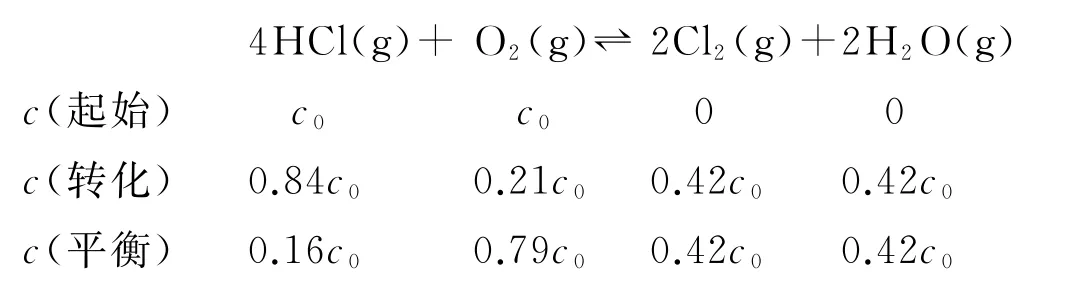
将各物质的平衡浓度代入计算
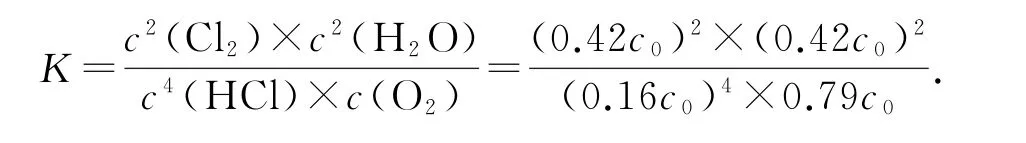

本题计算K的关键是正确判断出3条线对应的进料浓度比,利用点(400,84)进行计算.
例5(2020年全国Ⅱ卷,节选)天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料.
乙烷在一定条件下可发生如下反应:C2H6(g)⇌C2H4(g)+H2(g) ΔH.
容器中通入等物质的量的乙烷和氢气,在等压(p)下发生上述反应,乙烷的平衡转化率为α,反应的平衡常数Kp=_________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).

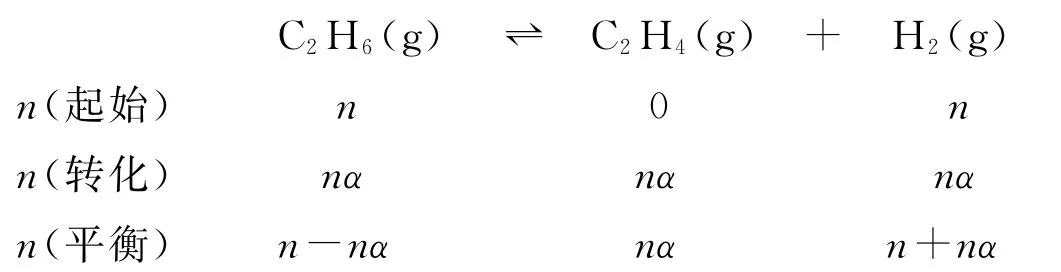
平衡时气体的总物质的量为2n+nα,各物质的分压分别为,.
将各物质的分压代入
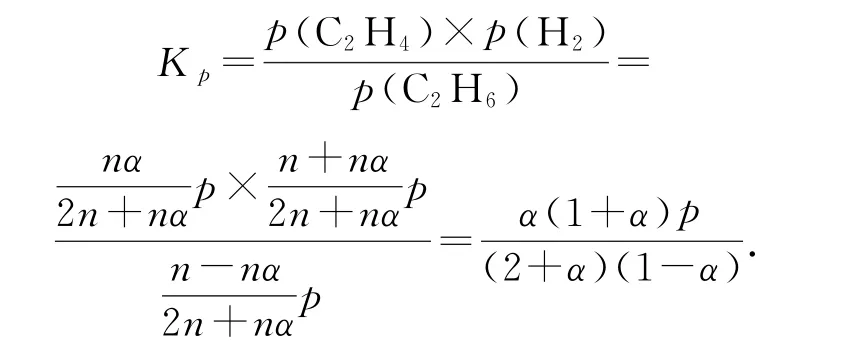

Kp的计算是近几年考查的热点,利用平衡分压代替平衡浓度计算,关键是正确计算出各物质的分压.本题需要注意的是产物之一H2的起始量不为0,计算时需特别注意.
例6(2021年全国乙卷,节选)一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂.回答下列问题:
氯铂酸钡(BaPtCl6)固体加热时部分分解为BaCl2、Pt和Cl2,376.8 ℃时平衡常数K′p=1.0×104Pa2.在一硬质玻璃烧瓶中加入过量BaPtCl6,抽真空后,通过一支管通入碘蒸气(然后将支管封闭).在376.8 ℃,碘蒸气初始压强为20.0kPa.376.8 ℃平 衡时,测得烧瓶中压强为32.5kPa,反应2ICl(g)⇌Cl2(g)+I2(g)的平衡常数K=_________(列出计算式即可).

写出表达式
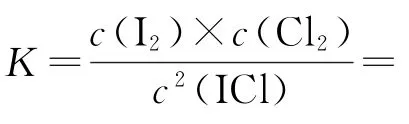
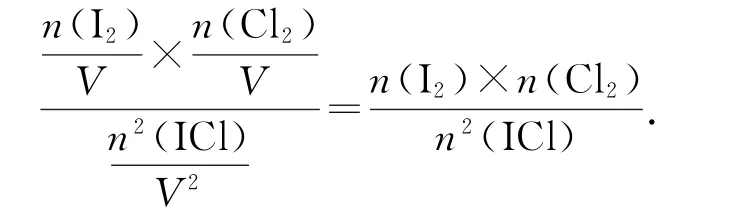
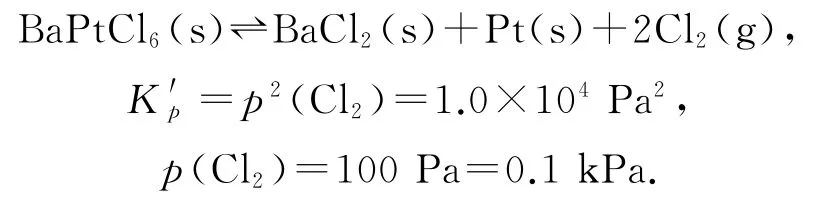
反应2ICl(g)⇌Cl2(g)+I2(g)为反应前后气体分子数相等的反应,又知加入碘蒸气平衡后压强为32.5 kPa,碘蒸气初始压强为20.0kPa,则初始p(Cl2)=(32.5-20)kPa=12.5kPa.相同温度下,平衡常数相等,平衡时Cl2分压为0.1kPa,则转化的p(Cl2)=(12.5-0.1)kPa=12.4kPa,列出三段式:
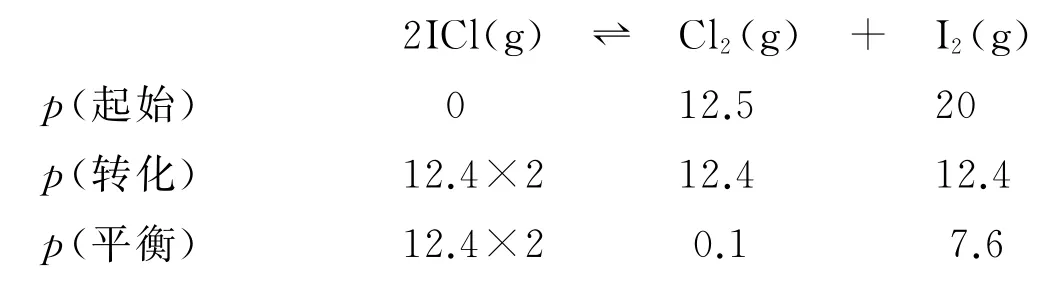
平衡时各物质分压分别为
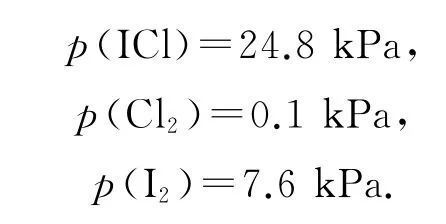
将各物质的分压代入
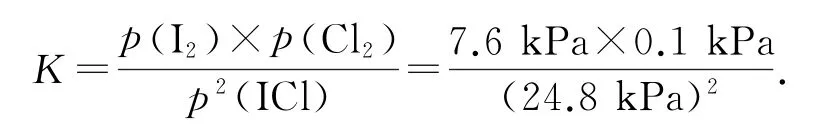

本题主要有两大难点:一是体系中存在双重平衡①BaPtCl6(s)⇌BaCl2(s)+Pt(s)+2Cl2(g)和②2ICl(g)⇌Cl2(g)+I2(g),需能够利用平衡①,根据计算并分析出平衡体系中p(Cl2)为0.1kPa;二是根据平衡②是两边气体分子数相等的反应,求出Cl2的初始压强.
平衡常数的计算,关键是模型的第二步,在图像中找出正确的点读出计算所需要的量或利用三段式计算出所需要的量,如果读出或计算出的量与所需量不一致,要考虑用已知量代换进行计算,计算平衡常数不要有畏难情绪,一般情况下写出表达式,明确计算所需要的量,就会有思路.
(完)

