XPR1在果蝇三龄幼虫神经肌肉接头中功能初探
张宝雪,牛晓晓,金珊
(湖北大学生命科学学院, 湖北 武汉 430062)
0 引言
无机磷酸盐的吸收在整个生物世界中是一种普遍的生物现象.磷在动物的骨骼、牙齿和细胞膜等都是极其重要的组成成分.无机磷酸盐参与了生物体内大多数的生化反应,因此严格控制细胞内外无机磷酸盐的水平对生物的生长和发育都非常重要.近年来的研究发现,人体中xpr1基因发生突变会导致原发性家族性脑钙化疾病(PFBC)[1].PFBC是一种罕见的神经退行性疾病,以双侧大脑钙化为病变特征,钙化主要分布在透镜核、尾状核、丘脑、小脑半球和皮层下白质等部位,临床症状表现为认知障碍、步态紊乱、运动障碍、精神异常和癫痫等.迄今为止研究者们发现了6个PFBC的致病基因,包括PDGFRB、PDGFB、slc20a2、xpr1、myorg和jam2[2-4].其中slc20a2编码无机磷酸输入蛋白PiT2,而xpr1是哺乳动物中目前唯一已知的编码磷酸盐输出蛋白的基因[5].在小鼠中xpr1突变导致肾的磷吸收功能严重受损,主要原因就是xpr1的功能缺陷影响了磷的外排.XPR1一开始是作为小鼠异嗜型或多嗜型的逆转录病毒(XMRV)受体被研究者发现,也是第四个被发现的具有多个跨膜结构域分子的哺乳动物C型癌逆转录病毒受体.XPR1是一种非典型G蛋白偶联受体(GPCR),与G蛋白的β亚基结合从而参与cAMP信号通路.据报道XMRV在小鼠体内就是由XPR1介导入侵的,结果就导致cAMP信号减弱,造成细胞感染死亡引起神经疾病[6].除了作为磷酸盐输出蛋白、GPCR以及异嗜型或多嗜型的逆转录病毒受体之外,XPR1还有别的功能,这里就不一一赘述.综上所述,不难发现xpr1突变容易引发神经疾病,所以我们以果蝇为实验材料,在果蝇幼虫的神经肌肉接头中去探索xpr1在突触前神经系统的结构及功能的调控作用.人类的xpr1在果蝇中的同源基因为CG10481、CG7536、CG2901和CG10483(见图1),其中CG10481和CG2901在幼虫的神经系统里并不表达,虽然CG7536在幼虫神经系统也有表达,但其集中表达在幼虫肠道中.而CG10483主要在幼虫神经系统中表达.所以本研究主要使用与人类的xpr1相似性高达55%的CG10483为基因背景的果蝇.

图1 人类xpr1与果蝇xpr1氨基酸序列对比图
大多数生物的脑、脊髓和腺体中存在着丰富的突触,突触是两个神经元或者两个细胞相互接触联系的场所.突触前细胞在这里组装释放神经递质,突触后细胞在这里接收整合神经递质传递的信息.根据突触形成的部位及突触传递的性质,突触又分为电突触和化学突触,本文中用到的体系主要为化学突触,以下直接称为突触.一个完整的突触包括突触前膜、突触间隙和突触后膜.神经支配肌肉的突触—神经肌肉接头(Neuromuscular junction NMJ)又称为运动终板,是由中枢神经系统与骨骼肌组成,人和动物能在环境中有目的的移动与NMJ的功能是分不开的.运动神经元末端释放化学信号作用于邻近的肌肉细胞表面,引起局部电流去极化引起肌肉收缩,损坏这一行为会导致肌肉无力或者瘫痪[7].与脑神经和脊髓神经突触相比,NMJ具有相似的结构特征,但是体积更大,更容易制备,是一个优秀的突触功能研究模型[8].
果蝇作为典型的模式生物,拥有众多遗传学操作工具.神经肌肉接头的形态特征和功能调控在果蝇及脊椎动物之间是高度保守的,因此果蝇是研究突触发育分子机制和神经传递的重要模型.果蝇幼虫的神经肌肉接头是谷氨酸能的,一个成熟的谷氨酰胺突触模型形成于胚胎时期,但是突触的发育贯穿了整个幼虫阶段[9](胚胎晚期有32个运动神经元支配肌肉).果蝇幼虫有8个体节,A2~A7体节几乎相同[10],在每节体壁上都排列着左右对称的运动神经元和由一系列由多核肌细胞组成的肌肉[11],且每块肌肉都由固定的神经元支配.许多参与果蝇及脊椎动物突触发育的细胞是相似的,传递的分子也是保守的,参与果蝇突触发育的一些动物细胞粘附分子和细胞排斥分子的结构或功能也与脊椎动物突触中的相似[12]等.NMJ中蛋白种类丰富,这些蛋白分子会影响神经和肌肉间化学递质的释放和接收,它们在运动神经元和突触后的肌膜上分布复杂[13].编码这些蛋白的基因发生突变可能会导致NMJ的形态结构发生改变,从而影响NMJ的功能,严重可致死.经我们发现磷酸盐输出蛋白XPR1在果蝇幼虫的NMJ中也有表达,考虑到XPR1的多项重要功能,我们在NMJ这一体系中对XPR1的功能进行探究.
1 材料与方法
1.1 实验所用果蝇品系如表1所示.

表1 实验所用果蝇
1.2 免疫染色所用抗体及染料如表2所示.
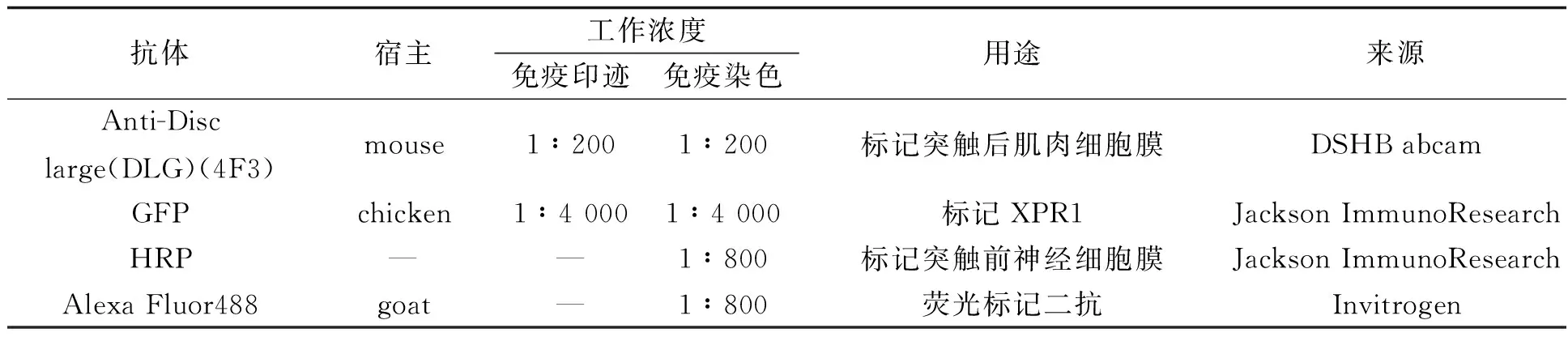
表2 实验所用抗体
1.3 实验方法
1.3.1 果蝇三龄幼虫的获取 取发育时间相同的雄性果蝇和处女蝇.为了控制幼虫的生长密度,将果蝇按照10∶5雌雄比例放置在25 ℃ 条件下养殖,培养基内加入少量干酵母(可促进果蝇产卵).管内雌雄果蝇交配产卵48 h后倒出成虫让培养基内的卵继续发育,待生长为三龄晚期幼虫后,取材实验.
1.3.2 果蝇三龄幼虫的解剖 用解剖镊从培养管内轻轻取出发育好的三龄幼虫,然后放入解剖液(HL3)中洗去幼虫身上的培养基.取出幼虫吸干解剖液放置于解剖盘上,使幼虫背部朝上漏出背部的两根气管,然后用解剖针固定头部和尾部.在固定好的幼虫身上滴一滴解剖液,用解剖剪在幼虫尾部剪一小口,然后从尾部沿两根气管之间剪至头部.夹取解剖针将幼虫的皮在头尾各取两个角使幼虫成片状伸展开呈六边形,最后用解剖镊将内脏和气管清除干净保留幼虫大脑及腹侧神经节.
1.3.3 免疫染色[14]解剖完成之后吸去幼虫样本的解剖液,吸干之后用PFA(4%多聚甲醛)浸住整个样品,室温固定40 min.固定过后,取下解剖针,将样本用0.2% PBST(1% PBS+0.2% Triton X 100)洗脱液进行漂洗,每10 min更换一次洗脱液,连续漂洗90 min.吸干洗脱液,用移液器加入一抗(0.2%的PBST配制),4 ℃过夜.吸走一抗,加入0.2% PBST洗脱液连续洗脱1 h,每10 min更换1次洗脱液.吸干洗脱液,用移液器加入二抗(0.2%的PBST配制),室温避光孵育3 h,漂洗样本,方法同一抗.将染色完成的样本置于载玻片上,吸干洗脱液,用Vectorshield封片油浸住样品,盖上盖玻片(注意样品内不出现气泡,否则会影响图片采集)后用指甲油密封.
1.3.4 图片采集和数据处理 实验中样本免疫染色图片的均由蔡司710共聚焦显微镜采集,图片处理主要由ZEN(black)和Photoshop CS完成.样本数据主要由Graphpad Prism 5.01和Image J处理完成.两组实验比较采用T检验(Student’sttest)进行统计分析,3组及其以上采用F检验(one-way ANOVA)进行统计分析.为了减小误差,我们统一检测第3体节4号肌肉的NMJ.
2 结果
2.1 XPR1分布定位于果蝇三龄幼虫的NMJ免疫染色结果显示GFP标记的XPR1在NMJ的神经轴突、突触前(图2A)和突触后(图2B)都有分布 (见图2).
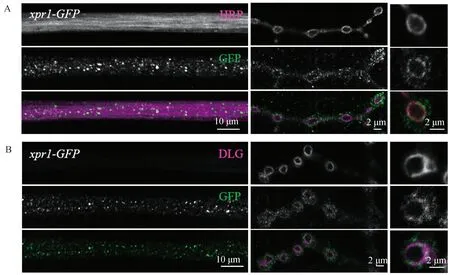
图2 XPR1的免疫染色分布图A:HRP标记突触前神经细胞膜.GFP标记的XPR1在NMJ的轴突和突触前都有分布. 左图为NMJ神经轴突,中间图及右图分别为NMJ的突触及单个突触扣结放大图. B:DLG(洋红)标记NMJ突触后的肌肉细胞膜,GFP标记XPR1(绿色)的分布.由图可知XPR1在NMJ的突触后也有分布.
2.2xpr1-果蝇的三龄幼虫的NMJ形态出现缺陷为了更好地观察xpr1-果蝇三龄幼虫的NMJ,我们用HRP和DLG进行标记.共聚焦图像显示,与野生型相比,xpr1-果蝇的NMJ在形态上出现显著差异,如图3A和3B.xpr1-果蝇的NMJ的扣结明显变小且不平滑,甚至出现卫星扣结(环绕在正常突触扣节周围的略小的扣节),如图3B箭头所示所示.虽然xpr1-果蝇幼虫NMJ的扣结变小(图3D),但其扣结数目(图3C)、长度(图3E)及伸展度(图3F)没有明显变化.
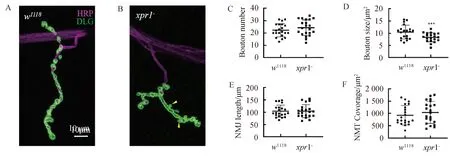
图3 xpr1-果蝇幼虫的NMJ出现形态缺陷A,野生型果蝇(w1118)的NMJ染色图.HRP(洋红),DLG(绿).B,xpr1-果蝇的NMJ染色图.图C、D、E及F分别为果蝇NMJ扣结数目、平均大小、NMJ长度以及覆盖面积统计图(n>20个NMJs, ***P<0.001), Error bars 代表 s.e.m
2.3xpr1在NMJ发育中的功能主要集中在突触前为了验证xpr1-三龄幼虫NMJ变小的结果,我们对xpr1-的NMJ分别进行突触前和突触后挽救实验.我们在xpr1突变的背景下用elav-Gal驱动UAS-xpr1-进行突触前挽救(elav-Gal4/+;UAS-xpr1/+;xpr1-),结果显示,与野生(图4A)型相比,NMJ的表型恢复至正常水平(图4C).当在xpr1突变的背景下,使用C57-Gal4驱动UAS-xpr1进行突触后挽救(UAS-xpr1/+;C57-Gal,xpr1-/xpr1-),结果显示NMJ并没有恢复至正常水平(图4B),NMJ的扣结呈紧密排列,与野生型对照相比扣结面积明显较小(图4F).然后我们又用elav-Gal4驱动UAS-xpr1进行XPR1的高表达(图4D),结果显示XPR1的高表达并不会影响幼虫NMJ的形态发育.我们同样对这些基因型的果蝇NMJ的扣结数目(图4E)、长度(图4G)和覆盖面积(图4H)进行统计,结果显示均与对照组无显著差异.突触后挽救结果显示NMJ扣结数目(图4E)无显著变化,大小(图4F)明显变小,这与图片中显示的结果一致.这些结果可能表明xpr1虽然在幼虫NMJ的突触前后均有表达,但在神经肌肉接头发育中的主要功能集中在突触前的神经系统.
图4 xpr1在NMJ中的功能主要集中在突触前A,野生型果蝇(w1118)的NMJ染色图(左).HRP(洋红),DLG(绿). B,使用C57-Gal4驱动UAS-xpr1对无功能突变体进行突触后挽救(UAS-xpr1/+;C57-Gal4, xpr1-/xpr1-)的NMJ染色图片(C57 Rescue).C,使用elav-Gal4驱动UAS-xpr1对xpr1-进行突触前挽救(elav-Gal4/+;UAS-xpr1/+;xpr1-)的NMJ染色图片(elav Rescue).D,使用elav-Gal4驱动UAS-xpr1对XPR1进行高表达(elav-Gal4/+;UAS-xpr1/+)的NMJ染色图片(elav UAS). 图E、F、G及H分别为果蝇NMJ扣结数目、平均大小、NMJ长度以及覆盖面积统计图 (n>25个NMJs,***P<0.001),Error bars 代表s.e.m.
3 结果与讨论
xpr1-在果蝇三龄幼虫NMJ中出现了NMJ扣结变小、排列紧密且不平滑等形态缺陷,说明该基因在NMJ具有较重要的功能.实验中利用在突变体背景下用C57-Gal4在突触后进行回补表达xpr1, 发现并不能挽救xpr1-的缺陷表型;然而在突变体背景下用elav-Gal4在突触前进行回补表达xpr1,发现幼虫NMJ的缺陷表型被挽救恢复至野生型水平,因此我们推测xpr1-在NMJ发育中的功能主要集中在突触前.
人类xpr1与果蝇及其他动植物和单细胞生物编码xpr1的同源基因具有高度的保守性,表明了其在细胞中发挥着重要的基础功能.在人体中若xpr1发生突变会导致PFBC.我们的结果显示在xpr1-果蝇的三龄幼虫中其NMJ突触后表达时不能挽救其突变体表型,说明xpr1在神经系统中发挥着重要的作用.
有研究表明XPR1参与cAMP信号通路的调节,影响cAMP的水平的主要原因为XPR1是一种非典型G蛋白偶联受体.cAMP作为细胞的第二信使在许多细胞功能中都很重要,如细胞代谢、生长、凋亡及神经系统的发育和神经传递等[6,15].cAMP通过与靶蛋白PKA结合,使蛋白激酶K(PKA)磷酸化激活调控基因的转录表达.cAMP水平增加会增强果蝇神经肌肉连接结构和功能.果蝇幼虫的NMJ是谷氨酸能的突触,NMJ发育过程的生命活动及突触可塑性的调节是cAMP依懒性的. FasII(细胞粘连分子)能够控制NMJ结构而非功能的可塑性,在调控突触前后发育中都发挥着重要作用,并且FasII还可以通过CREB(cAMP的应答元件结合蛋白)与cAMP共同调节NMJ结构与功能.CREB是cAMP反应元件结合蛋白,它是单个基因d(creb2)编码的,d(creb2)根据需求可以通过选择性的剪切和拼接成为激活因子dCREB2-a和抑制因子dCREB2-b.CREB可以启动上游调控区含有cAMP反应元件(CRE位点)的基因的转录,当它的抑制因子dCREB2-b在dunce(编码cAMP特异性磷酸二酯酶,负责cAMP降解)突变体中表达时,会抑制CREB介导的转录从而阻断突触的功能但不影响其活动.当激活因子(dCREB2-a)的在FasII突变体表达时会激活CREB介导的转录调控,引起突触的扣结数目增加,也就是说dCREB2-a 的表达重塑了突触的cAMP依赖的可塑性[16].xpr1突变时磷酸盐输出功能受损,在人体中会导致PFBC,病人的大脑中发生羟基磷酸钙沉淀的钙化现象.有研究发现,给三周大的小鼠喂食缺钙的食物时NMJ的结构和功能会发生细微变化,肌肉缺乏持续的应激反应[17].由此可见xpr1对NMJ发育的影响是多方面的,后期我们将进一步研究xpr1对NMJ发育的影响机制.

