山羊流产衣原体ompA和CPAF基因的序列分析及原核表达
徐海玲,杨 萍,张金生,王满定,刘广阔,李梦磊,张 琪*,许信刚*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.咸阳市动物疫病预防控制中心,陕西咸阳712000;3.甘肃元生农牧科技有限公司,甘肃永昌 737200)
羊流产衣原体(Chlamydophilaabortus)属于衣原体科衣原体属成员,是一种严格寄生在细胞内的革兰氏阴性微生物,是引发羊地方性流产(Enzootic abortion of ewes,EAE)的主要病原[1]。C.abortus能够通过胎盘感染山羊、绵羊、奶牛等多种动物而引发母畜流产和死胎,孕妇与患流产衣原体病的家畜直接接触也可发生感染,导致流产[2]。C.abortus感染动物造成流产的现象在全世界范围内广泛分布,在我国也比较多发,而且感染率呈逐年上升趋势[3],造成的经济损失非常严重。由于流产衣原体感染的动物在初期症状不明显,所以常常被忽视或容易造成误诊,目前临床广泛应用的检测方法也仅有操作复杂的补体结合试验和敏感性差的间接血凝试验,对该病的早期诊断有一定程度的局限性,而且尚无针对性的流产衣原体商品化疫苗,从而导致了疾病的传播[4-5]。C.abortus编码的外膜蛋白(outer membrane protein,ompA)是一种具有血清型、亚种、种和属特异性抗原决定簇的基因。作为存在于衣原体外表面的基因,不仅在维持衣原体结构完整性中起重要作用,还具有黏附宿主细胞,辅助衣原体侵染的功能,也是衣原体从宿主细胞摄取ATP等物质的离子通道[6],所以在衣原体研究中ompA是最受关注的组分,也常被用作诊断C.abortus的主要研究基因和研制疫苗的主要候选抗原。C.abortus蛋白酶样活性因子(chlamydial protease like activity factor,CPAF)是由衣原体合成进而分泌到宿主细胞内的蛋白。研究表明CPAF可中和补体,降解细胞外抗菌肽,增加感染力和致病性。C.abortus的CPAF作为衣原体和宿主之间相互作用的一个重要分子,具有很强的免疫原性,而且在不同种菌株之间高度保守,可以作为衣原体诊断和疫苗的候选抗原[7-9]。2020年3月陕西省某奶山羊养殖场发生群发性流产,经过检测证明是羊流产衣原体感染引起。本试验分别进行山羊流产衣原体陕西分离株ompA基因和CPAF基因的克隆、序列分析及原核表达,为建立山羊流产衣原体抗体ELISA快速诊断方法奠定基础。
1 材料与方法
1.1 材料
1.1.1 阳性病料 无菌采集陕西某奶山羊场发生流产母羊的血液以及流产胎儿的肺脏、脾脏、羊水和胎盘,置-20℃保存备用。
1.1.2 菌株和质粒 山羊流产衣原体阳性血清由西北农林科技大学动物医学院兽医微生物实验室保存[5]。pGM-T克隆试剂盒和感受态细胞Trans5α、BL21(DE3)为北京天根生化科技有限公司产品;pET-28a(+)质粒由西北农林科技大学动物医学院微生物实验室保存。
1.1.3 主要试剂 DNA提取试剂盒、胶回收试剂盒、质粒提取试剂盒,天根生化科技有限公司产品;EcoR1、XhoⅠ、BamHⅠ内切酶、T4 DNA连接酶,NEB(北京)有限公司产品;HPR标记的兔抗山羊IgG抗体,上海翊圣生物技术有限公司产品;其他试剂均为国产分析纯。
1.1.4 仪器设备 PCR仪(K960),力康生物医疗科技控股有限公司产品;核酸电泳仪(DYCP-31DHDYY-6C),北京六一生物科技有限公司产品;蛋白电泳仪(LF-2000),北京龙方科技有限公司产品;超净工作台(SJ-CJ-1FD),苏洁医疗器械有限公司产品;超声波破碎仪(JY92-IIN),宁波新芝生物科技股份有限公司产品;酶标仪(AMR-100),杭州奥盛仪器有限公司产品。
1.2 方法
1.2.1 引物设计与合成 参照NCBI上公布的C.abortus的ompA(M73036.1)和CPAF(CR848038.1)基因序列,结合特异性酶切位点,应用Primer 5.0软件,设计ompA和CPAF基因的2对特异性扩增引物。ompA的特异性扩增引物为ompA-F:5′-CCGGAATTCATGTGGGAAGGTGCTTCAGGTGA-TC-3′ (下划线为EcoRⅠ酶切位点)ompA-R:5′-CCGCTCGAGTGAATCTGAATTGAGCATTCA-TGTGA-3′ (下划线为XhoⅠ酶切位点),扩增出ompA基因的大小为1 053 bp;CPAF的特异性扩增引物为:CPAF-F:5′-CGCGGATCCATGGTCCCGTATTTCTGGAGCGAAT-3′ (下划线为BamHⅠ酶切位点);CPAF-R:5′-CCGCTCGAGTCGACTCAGTGATTTTGTCTGCACTT-3′ (下划线为XhoⅠ酶切位点),扩增出CPAF基因的大小为1 056 bp,引物由西安热默尔生物公司合成。
1.2.2ompA基因和CPAF基因的扩增及重组质粒的构建 用DNA提取试剂盒提取的C.abortus阳性病料DNA作为模板,应用2对引物PCR扩增ompA和CPAF基因。回收纯化目的基因片段后分别连接至pET-28a原核表达质粒中,对重组载体进行PCR和双酶切鉴定,将阳性质粒命名为pET-28a-ompA和pET-28a-CPAF。
1.2.3ompA基因和CPAF基因的序列分析 通过NCBI上的Blast功能和DNAStar软件将山羊流产衣原体ompA基因与GenBank已收录的其他C.abortus基因组DNA序列(AJ440239.1、AF272945.1、EF202609.1、DQ478954.1、DQ227703.1、X51859.1、AF269256.1、KC879303.1、KP984478.1、AJ005617.1、MH542160.1、HQ622433.1、M37040.1、KY399850.1、DQ435300.1、M37036.1)进行比对并进行核苷酸遗传进化分析,绘制系统进化树。将C.abortus的CPAF基因与GenBank已收录的其他C.abortus基因组DNA序列(CR848038.1、CP041038.1、CP047319.1、CP041038.1、LN554882.1、CP18296.1、CP003795.1、CP031646.1、LN554883.1、CP021996.1、CP002744.1、CP033059.1、CP003791.1、CP024084.1)进行比对并进行核苷酸遗传进化分析,绘制系统进化树。
1.2.4ompA基因和CPAF基因的原核表达 将测序鉴定的重组质粒pET-28a-ompA和pET-28a-CPAF以及空载体分别转化入BL21(DE3)表达感受态细胞中,分别涂布到带有卡那霉素抗性的LB平板上于恒温培养箱过夜培养后挑取单菌落,37℃、220 r/min培养12 h,次日按1∶100的比例转接到500 mL LB液体培养基后,培养至对数期(约1 h~3.5 h)后加入1.0 mmol/L的IPTG诱导培养7 h,4 200 r/min离心10 min收集菌体沉淀,20 mL PBS洗涤1次后用24 mL PBS重悬,超声裂解30 min。分别取菌液上清和超声裂解过的菌体上清以及菌体沉淀进行SDS-PAGE,分析蛋白表达形式。
1.2.5 重组ompA蛋白和CPAF蛋白的Western blot分析 将表达产物经SDS-PAGE后,在150 mA条件下恒流转膜90 min。室温封闭1 h后用山羊流产衣原体阳性血清(1∶200倍稀释)作为一抗在4℃条件下进行过夜孵育,用HPR标记的兔抗山羊IgG(1∶10 000倍稀释)作为二抗孵育1 h,ECL避光显色,显影分析。
2 结果
2.1 ompA基因和CPAF基因扩增结果
用DNA 提取试剂盒提取的C.abortus阳性病料DNA作为模板,以ompA-F、ompA-R、CPAF-F、CPAF-R为引物进行常规PCR扩增,用10 g/L凝胶电泳检测可见与预期扩增产物大小一致的1 053 bp的ompA基因和1 056 bp的CPAF基因扩增条带(图1)。

M.DNA标准DL 2 000;1.ompA基因扩增产物;2.CPAF基因扩增产物M.DNA Marker DL 2 000;1.ompA gene amplification products;2.CPAF gene amplification products图1 ompA基因和CPAF基因扩增Fig.1 Amplification of ompA gene and CPAF gene
2.2 重组表达质粒pET-28a-ompA和pET-28a-CPAF的双酶切鉴定结果
以EcoRⅠ和XhoⅠ双酶切重组表达质粒pET-28a-ompA,经10 g/L凝胶电泳鉴定,出现一条大小为1 053 bp的目的条带和一条约5 360 bp的载体条带,表明重组质粒构建成功;以BamHⅠ和XhoⅠ两个限制性内切酶双酶切重组表达质粒pET-28a-CPAF,经10 g/L凝胶电泳鉴定,出现一条大小为1 056 bp的目的条带和一条约5 360 bp的载体条带(图2),表明重组质粒构建成功。

M.DNA标准DL 5 000;1:pET-28a-ompA经EcoRⅠ和XhoⅠ双酶切;2.pET-28a-CPAF经BamHⅠ和XhoⅠ双酶切M.DNA Marker DL 5 000;1.pET-a-28 ompA digested with EcoRⅠand XhoⅠ;2.pET-a-28 CPAF digested with BamHⅠand XhoⅠ图2 重组表达质粒双酶切鉴定Fig.2 Double enzyme digestion identification of recombinant expression plasmids
2.3 ompA基因和CPAF基因生物信息学分析
将重组质粒测序,通过NCBI Blast比较分析,ompA基因与GenBank已收录的其他C.abortus基因组DNA序列(M73036.1、AJ440239.1、AF272945.1、EF202609.1、DQ478954.1、DQ227703.1、X51859.1、AF269256.1、KC879303.1、KP984478.1、AJ005617.1、MH542160.1、HQ622433.1、M37040.1、KY399850.1、DQ435300.1)进行比对,同源性为99.54%~99.91%。CPAF基因与GenBank已收录的其他C.abortus基因组DNA序列(CP041038.1、CP047319.1、CP041038.1、LN554882.1、CP18296.1、CP003795.1、CP031646.1、LN554883.1、CP021996.1、CP002744.1、CP033059.1、CP003791.1、CP024084.1)同源性为91%~100%。在分析ompA基因和CPAF基因同源性的基础上,绘制ompA基因(图3)和CPAF基因(图4)核苷酸系统进化树进行分析,C.abortus的ompA基因与NCBI已公布的荷兰分离株DQ435300.1在同一个分支上,表明亲缘关系最近。CPAF基因与NCBI已公布英国分离株CR848038.1在同一个分支上,表明亲缘关系最近。
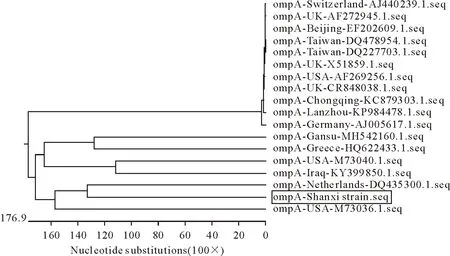
图3 ompA基因核苷酸序列进化树Fig.3 Phylogenetic tree of nucleotide sequences of ompA gene

图4 CPAF基因核苷酸序列进化树Fig.4 Phylogenetic tree of nucleotide sequences of CPAF gene
2.4 重组ompA蛋白和CPAF蛋白的原核表达
在1 mmol/L IPTG条件下诱导表达ompA蛋白和CPAF蛋白7 h后分别取菌液上清,超声裂解菌体上清和菌体沉淀进行SDS-PAGE。结果显示,重组蛋白ompA的菌体裂解沉淀在38 ku处有明显条带,重组蛋白CPAF的菌体裂解沉淀在在38 ku(图5)处有明显条带,蛋白大小与预期结果一致,ompA蛋白和CPAF蛋白均存在于超声裂解菌体沉淀中,表明主要是以包涵体形式存在于感受态细胞中。

M.蛋白分子质量标准;1.ompA菌液上清;2.ompA菌液裂解上清;3.ompA菌液裂解沉淀;4.CPAF菌液上清;5.CPAF菌液裂解上清;6.CPAF菌液裂解沉淀M.Protein molecular weight Marker;1.ompA bacterial liquid supernatant;2.ompA bacterial liquid cracking supernatant;3.ompA bacteria liquid cracking precipitate;4.CPAF bacterial liquid supernatant;5.CPAF bacterial liquid cracking supernatant;6.CPAF bacterial fluid cracking precipitate图5 重组蛋白ompA和CPAF表达形式分析图Fig.5 Expression analysis diagram of recombinant protein ompA and CPAF
2.5 重组ompA蛋白和CPAF蛋白的Western blot鉴定
Western blot结果显示,ompA蛋白能与山羊流产衣原体阳性血清特异性反应在并在38 ku处出现条带;CPAF蛋白能和山羊流产衣原体阳性血清特异性反应并在38 ku处出现条带(图6)。

M.蛋白分子质量标准;1~2.ompA重组蛋白;3~4.CPAF重组蛋白M.Protein molecular weight Marker;1-2.ompA recombinant protein;3-4.CPAF recombinant protein图6 ompA和CPAF重组蛋白的Western blot鉴定结果Fig.6 Western blot identification of ompA and CPAF recombinant proteins
3 讨论
C.abortus作为一种严重的人兽共患病病原,在全世界流行,不仅给养殖业带来了巨大的经济损失,严重阻碍养羊业和养牛业的进一步发展,而且对相关从业人员的健康问题也造成了威胁[10-11]。通过流行病学调查发现,我国部分地区的衣原体阳性率高达56%[12-14],而在临床中单靠症状又很难诊断出流产衣原体,所以经常出现误诊而错过最佳治疗时机[15]。因此,建立一种成本较低、操作简便以及特异性高的临床检测方法对流产衣原体的诊断尤为重要。ompA基因具有血清型、亚种、种和属特异性抗原决定簇,而CPAF基因作为衣原体和宿主之间相互作用的一个重要分子具有很强的抗原性,两个基因在不同菌株之间高度保守,所以ompA基因和CPAF基因有望成为研制C.abortus亚单位疫苗和ELISA检测试剂盒的首选基因。
本试验对来自临床病料分离的C.abortus进行了研究,成功克隆了ompA基因(1 053 bp)和CPAF基因(1 056 bp),与NCBI上已经收录的国内外流产衣原体核酸序列对比发现,在陕西奶山羊场分离的C.abortusompA基因与国内外其他分离株的同源性在99.54%~99.91%。C.abortus的CPAF基因与国内外其他分离株的同源性在91%~100%,说明这两种基因发生突变的概率低,具备功能性研究价值,通过绘制的遗传进化树结果分析,陕西分离的C.abortusompA基因与NCBI已公布的荷兰分离株DQ435300.1在同一个小分支上,而与荷兰、美国、伊拉克、希腊等地区分离株位于同一个大分支上呈交叉分布状态。陕西羊场感染的C.abortusCPAF基因与NCBI已公布英国分离株CR848038.1在同一个小分支上,与瑞典、美国等国家分离株位于一个大分支上呈交叉分布状态。说明陕西羊场C.abortus分离株ompA基因和CPAF基因在进化过程中没有明显的进化差异,分离株的两种基因保守程度都比较高。因此,深入研究C.abortus的ompA基因和CPAF基因的分子生物学功能对研制亚单位疫苗和快速检测方法的建立以及研究C.abortus的感染和发病机制有重要意义。
本试验成功诱导表达了C.abortus的ompA(38 ku)蛋白和CPAF(38 ku)蛋白,利用 Western blot进行检测,两种靶蛋白都能与山羊流产衣原体阳性血清特异性识别并结合,说明两种蛋白均有良好的反应原性,提示这两个基因都可以作为动物流产衣原体病的血清学检测抗原。本试验为进一步建立山羊流产衣原体的血清学快速检测方法和基因工程疫苗研制奠定了基础。

