查干湖鲢源豚鼠气单胞菌分离鉴定及生物学特性研究
刘长宇,田佳鑫,张 洋,徐雪彬,钱爱东,单晓枫*,刘艳辉
(1.吉林农业大学动物医学学院 动物科学技术学院,吉林长春 130118;2.吉林省水产科学研究院,吉林长春 130033)
豚鼠气单胞菌(Aeromonascaviae)属于弧菌科气单胞菌属,是一种革兰氏阴性短杆菌[1]。该菌是鱼-人-家畜共患菌,除了感染鱼类外,能够致使虾类、蟹类产生细菌败血症或出血病;还能引起人类败血病和急性胃肠炎[2-3]。近几年来我国水产业由该菌引发的病例日趋增多,造成了巨大的经济损失。查干湖位于北纬45°,东经124°。其地形平坦、水源充足,位于内蒙古自治区、黑龙江省和吉林省的交界地带,近年关于查干湖渔类细菌性疾病流行情况报道较少,且水产经济动物的气单胞菌疾病主要集中于维氏气单胞菌(Aeromonasveronii)和嗜水气单胞菌(Aeromonashydrophila),关于豚鼠气单胞菌的防治与大多细菌性疾病一样都采用抗生素以及部分强氧化剂,由于养殖户不按照养殖规定滥用抗生素导致多重耐药菌株的产生,同时也污染水质,威胁公共卫生安全。本研究从查干湖患病鲢鱼体内分离出1株优势菌,对其进行革兰氏染色、生理生化试验、16S rDNA和管家基因序列分析、毒力基因检测等,以期为鲢细菌性疾病的鉴别诊断和感染防治提供依据。
1 材料与方法
1.1 材料
1.1.1 试验用动物和菌株 患病鲢来自查干湖,病鲢体重450 g左右,主要临床症状为体表有出血点,剖检发现肝胰脏糜烂,脾脏出血,肠道有出血坏死;健康鲢购自吉林省某大型养殖场,平均体重100 g±3.9 g;斑马鱼购自吉林省长春市某批发市场;将健康鲢和斑马鱼分别在水箱中饲养14 d待用,温度为25℃;对照菌株A.caviaeATCC 154768保存于吉林农业大学动物科学技术学院实验室。
1.1.2 主要试剂 细菌生化鉴定试剂条,青岛海博生物技术有限公司产品;药敏纸片,杭州微生物试剂有限公司产品;细菌DNA提取试剂盒、PCR产物纯化试剂盒,宝生物工程(大连)有限公司产品;RS琼脂平板培养基,北京陆桥技术有限责任公司产品;LB固体培养基、LB液体培养基、PBS缓冲液等为吉林农业大学动物科学技术学院预防兽医学实验室配制。
1.1.3 主要仪器 PCR仪,Applied Biosystems公司产品;恒温摇床,CRYSTAL公司产品;高速离心机低温型,Sigma公司产品。
1.2 方法
1.2.1 病原菌的分离与纯化 选取发病鲢,无菌采集肝脏、脾脏和肾脏组织的横切面,划线于RS琼脂平板培养基,37℃恒温培养12 h~24 h后观察细菌生长状况;选取形态大小一致的优势菌落,进行菌落的纯化后获得纯培养菌株,4℃保存备用。
1.2.2 细菌形态观察及生理生化鉴定 将纯化的病原菌进行革兰氏染色,在显微镜下观察菌体形态特征;将分离纯化的菌株接种于哥伦比亚绵羊血琼脂培养基,37℃恒温培养20 h~24 h,观察分离菌株的溶血现象。并挑取单个菌落进行微量生化管试验,37℃培养12 h~24 h观察,参照文献[5-6]中菌株的生化特征,对分离菌株的分类地位进行初步判断。
1.2.3 16S rDNA和管家基因的序列分析 取对数生长期的菌液,离心取下层菌液,按照DNA提取试剂盒说明书提取细菌DNA。用细菌16S rDNA通用引物和gyrb、cpn60分别进行PCR扩增,引物信息见表1,引物由吉林省库美生物科技有限公司合成。PCR产物经10 g/L 琼脂糖凝胶电泳检测并回收纯化,测序由吉林省库美生物科技有限公司完成。基因序列通过NCBI(https://www.ncbi.nlm.nih.gov/)的检索系统进行序列相似性比较,用Mega4.0软件构建系统发育树并进行分析。

表1 引物序列信息Table 1 Primer sequence information
1.2.4 毒力基因检测 参照文献[5]方法并有所改进,分别合成7种毒力基因的特异性引物,即细胞毒性肠毒素(act)、黏附素(aha)、核酸酶(exu)、气溶素(aer)、密度感应系统调控基因(luxs)、脂肪酶(lip)、丝氨酸蛋白酶(ser)(表1)。
1.2.5 生长曲线测定 将具有致病性的分离菌株与相对应的标准菌株分别传代于LB液体培养基,30℃摇床过夜培养,用无菌生理盐水稀释至1×107CFU/mL;然后按照1%接种至LB液体培养基,放置于30℃摇床培养24 h,期间每隔1 h测定菌液OD600nm值。试验重复3次,取平均值。以时间为横坐标,OD600nm值为纵坐标,绘制出生长曲线。
1.2.6 人工感染试验 对文献[9]方法有所改进,将培养于LB液体培养基中的病原菌的菌液进行细菌平板计数,计算出初始菌液浓度,并将原菌液于离心机12 000 r/min离心2 min,并用PBS洗涤,重复洗涤3次。将洗涤后的菌液分别稀释成浓度为1×108、1×107、1×106、1×105、1×104、1×103、1×102、1×101CFU/mL,共8组攻毒浓度,每组10尾斑马鱼和10尾鲢鱼,0.2 mL/尾,腹腔注射各组的菌液浓度,并一同连续观察1周,记录试验组和对照组的发病鱼数及死亡鱼数,根据改良寇氏法计算出细菌的半数致死量。
1.2.7 药敏试验 采用纸片扩散法进行菌株耐药性分析[4],即将菌株接种在LB液体培养基中,30℃摇床培养20 h,向菌悬液中加入无菌生理盐水稀释至OD=0.5,取100 μL的菌悬液均匀涂布于LB固体培养基上;然后选择庆大霉素、新霉素、多西环素、四环素、氧氟沙星等30种抗菌素药敏纸片分别贴于培养基上;30℃培养24 h后取出平板,记录每个菌株药敏抑菌圈直径。判定标准参考杭州天和微生物试剂有限公司《药敏试验纸片法的抑菌范围解释标准》。
2 结果
2.1 病原菌纯化及形态特征
从病鱼体内分离出1株优势菌株,接种于RS培养基上30℃培养24 h。可形成圆形,表面湿润,边缘整齐中间突起的黄绿色菌落(图1);分离菌能够在血平板上形成溶血环(图2)。

图1 分离菌形态Fig.1 Isolated bacterial morphology

图2 α-溶血环Fig.2 α-hemolytic ring
2.2 病原菌革兰氏染色及生理生化特征
该病原菌经革兰氏染色为阴性,细菌形态为短杆状;结合细菌形态和生理生化结果可初步判断分离菌为豚鼠气单胞菌,命名为AC-CY(表2)。

表2 分离株和标准株理生化特征Table 2 Physiological and biochemical characteristics of isolated and standard strains
2.3 16S rDNA和管家基因的序列分析结果
分别用细菌16S rDNA和gyrb、cpn6对AC-CY基因组进行PCR扩增,扩增产物琼脂糖电泳见图3A。PCR扩增得到片段大小为1 408 bp,经过NCBI数据库 Blast后并建立系统发育进化树(图4),结果AC-CY与A.caviae同源性为99%。cpn60和gyrbPCR琼脂糖电泳见图3B。gyrb和cpn60进化树结果见图5、图6,与16S rDNA进化树结果相似,cpn60和gyrb结果表明AC-CY与A.caviae聚类,其隶属于A.caviae。

M.DNA标准DL 2 000;1~2.16S rDNA PCR结果;3.gyrb PCR结果;4.cpn 60 PCR结果M.DNA Marker DL 2 000;1-2.PCR results of 16S rDNA;3.gyrb PCR results;4.cpn 60 PCR results图3 病原菌16S rDNA和管家基因PCR扩增结果Fig.3 PCR results of 16S rDNA and house-keeping genes

图4 AC-CY 16S rDNA基因序列与相关菌株的系统发育树Fig.4 AC-CY 16S rDNA gene sequence and phylogenetic tree of related strains

图5 AC-CY gyrb基因序列与相关菌株的系统发育树Fig.5 AC-CY gyrb 60 gene sequence and phylogenetic tree of related strains

图6 AC-CY cpn 60基因序列与相关菌株的系统发育树Fig.6 AC-CY cpn 60 gene sequence and phylogenetic tree of related strains
2.4 毒力基因检测结果
通过PCR方法检测分离菌株AC-CY携带毒力基因(图7)。7种毒力基因PCR条带清晰且单一,大小与预期相符合。证明AC-CY携带7种毒力基因,分别为aer、lip、act、ser、aha、exu和luxs。

M.DNA Marker DL 2 000 ;1.aer;2.lip;3.act;4.ser;5.aha;6.exu;7.luxs
2.5 生长曲线测定结果
检测AC-CY与A.caviaeATCC15468菌株生长情况(图8)。分离株AC-CY与对照株ATCC 15468的生长曲线无显著差异,3 h~5 h期间为对数生长期,之后生长速度放慢,在13 h后达到平台期。

图8 分离菌与对照株生长曲线Fig.8 Growth curves of pathogenic bacteria and control strain
2.6 人工感染试验结果
对斑马鱼和鲢鱼腹腔进行梯度攻毒,连续观察 1 周,记录各组鱼体死亡数(表3和表4)。根据改良寇氏法计算出AC-CY感染斑马鱼和鲢鱼的半数致死量分别为 2.51×102CFU和2×104CFU,说明该菌的毒力较强。
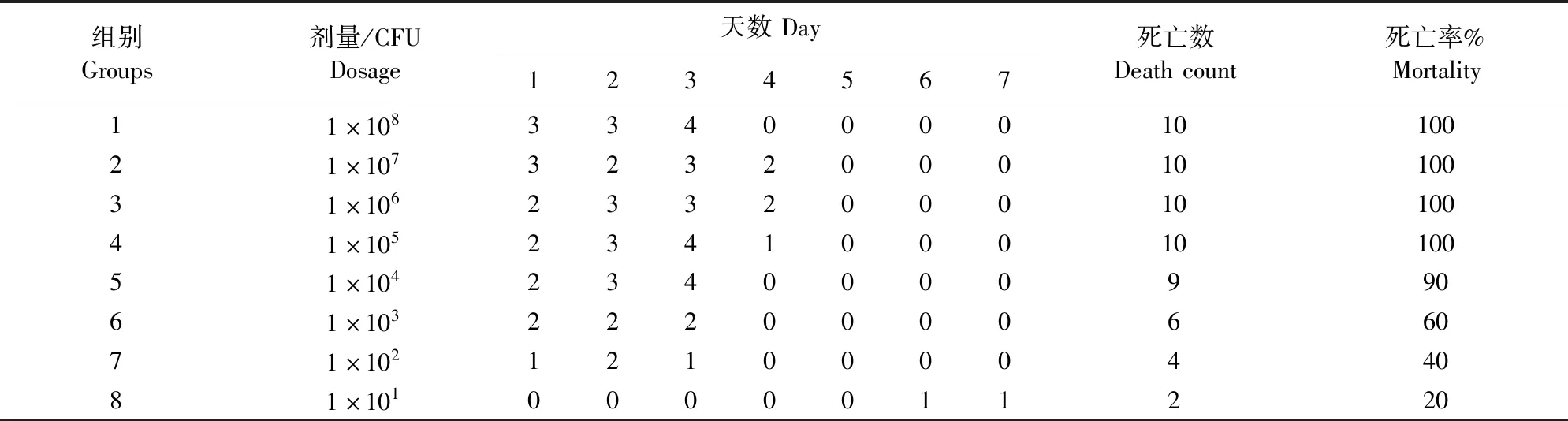
表3 豚鼠气单胞菌AC-CY感染斑马鱼半数致死量测定Table 3 Determination of median lethal dose of zebrafish infected with Aeromonas caviae AC-CY

表4 豚鼠气单胞菌AC-CY感染鲢鱼半数致死量测定Table 4 Determination of median lethal dose of silver carp infected with Aeromonas caviae AC-CY
2.7 药敏试验结果
采用纸片扩散法进行分离菌株AC-CY耐药性分析,并记录药敏抑菌圈直径。参考杭州天和微生物试剂有限公司《药敏试验纸片法的抑菌范围解释标准》进行判定(表3)。结果显示,分离菌株AC-CY对哌拉西林、多西环素、头孢哌酮、丁胺卡那、四环素、卡那霉素、呋喃唑酮、庆大霉素、新霉素、诺氟沙星、氧氟沙星、环丙沙星、氯霉素高度敏感;对复方新诺明、头孢曲松、头孢呋辛、多粘菌素B、红霉素中度敏感;对青霉素、苯唑西林、氨苄西林、羧苄西林、头孢氨苄、米诺环素、头孢他啶、克林霉素、麦迪霉素、万古霉素、头孢拉定、头孢唑啉耐药。

表5 分离菌株药物敏感性试验结果Table 5 Antimicrobials sensitivity of the isolated bacteria
3 讨论
Aeromonascaviae作为水产养殖行业发病严重的病原菌,典型的人-兽-水生生物致病菌,近些年关于其流行情况成上升趋势,对多种水生经济动物致病力强,造成严重过的经济损失。研究发现,草鱼源A.caviae具有较强的致病力[3],在南美白对虾中分离得到1株高致病性的A.caviae,对水产养殖业的发展造成影响[2]。本研究从查干湖患病鲢体内分离出1株优势病原菌,用细菌常用鉴定方法,对其菌落形态、革兰氏染色以及生理生化鉴定发现其菌落成半透明圆形菌落,在RS平板中呈黄绿色菌落,革兰氏阴性短杆菌,生理生化初步鉴定结果表明其隶属于气单胞菌属。用血琼脂平板对其溶血活性进行检测,表明其具有α-溶血活性,维氏气单胞菌具有溶血活性同时其具备较强的致病性[6]。为更准确地鉴定分离株AC-CY,用16S rDNA对分离株AC-CY进行PCR并测序,用NCBI数据库进行Blast后建立系统发育进化树,对其聚类进行分析,发现AC-CY与A.caviae聚类且相似度达99%。随着分子生物学和基因组学的发展,16S rDNA的保守程度的缺陷也日渐暴露,国内外学者通过对全基因组比对发现更多保守的序列,其中管家基因gyrb和cpn60保守程度更高,所以本试验用相对保守性高且携带一定变异率的管家基因序列进行分析,用RNA聚合酶基因gyrb和cpn60进行进一步鉴定。gyrb即为促旋酶B亚单位,1.2 kb~1.4 kb,其在DNA的合成、超螺旋结构的维持中作用极大。由于gyrb基因变化十分缓慢,每百万年碱基替换速率仅为0.7%~0.8%,在以核苷酸序列为基础的细菌分类及鉴别研究中可作为靶分子,能更有效地用来标记生物的进化距离,从而区分亲缘关系较近的种类[7]。研究表明,在气单胞菌属菌株的鉴定中,cpn60(Hsp60或GroEL)是编码细菌和部分古菌的一个高度保守蛋白的基因,它比16S rDNA更具有保守性,可应用于气单胞菌属鉴定[8]。同时应用3种基因鉴定从而弥补非蛋白编码16S rDNA基因鉴定细菌的缺陷。因此,本研究在16S rDNA的基础上,对AC-CY的管家基因gyrb和cpn60进行PCR扩增和测序,建立进化树后发现结果与16S rDNA结果相似,AC-CY与A.caviae聚类,进一步证明其为A.caviae,同时也说明16S rDNA在A.caviae的鉴定中具有较高的保守性。
为进一步探究其致病力,用斑马鱼以及鲢检测其半数致死量时,结果分别为2.51×102CFU和2×104CFU,证明其具有较强致病性[8]。结合气单胞菌常见7种毒力基因进行PCR,结果表明其具有aer、lip、act、ser、aha、exu和luxs7种毒力基因。aer是气单胞菌最常见的毒力基因,生物学功能为细胞毒性、溶血性和肠毒素毒性,可在宿主体内破坏宿主细胞的细胞膜,从而使宿主细胞死亡 。而ser、lip、aha毒力基因在气单胞菌黏附和整合的过程中发挥极大的作用。luxs毒力基因可能促进细菌生物膜的形成,进一步加强细菌的感染能力[4]。携带毒力基因的数量与致病性存在正相关性,但毒力基因之间的互作关系以及气单胞菌的致病机制还有待深入探究[9]。为检测AC-CY的耐药性,采用纸片扩散(KB)法进行分离菌株耐药性分析,结果显示AC-CY对哌拉西林、多西环素、头孢哌酮、丁胺卡那、四环素、卡那霉素、庆大霉素、新霉素、诺氟沙星、氧氟沙星、环丙沙星高度敏感;对复方新诺明、头孢曲松、头孢呋辛、多黏菌素B、红霉素中度敏感;对青霉素、苯唑西林、氨苄西林、羧苄西林、头孢氨苄、米诺环素、头孢他啶、克林霉素、麦迪霉素、万古霉素、头孢拉定、头孢唑啉耐药,AC-CY为多重耐药菌株。抗菌药物使用应当合法合规[10],从选择种类和用药剂量都要有理论根据,避免药物残留,避免盲目用药。
本研究通过对查干湖发病鲢进行分离病原菌得到1株具有强致病性的AC-CY菌株,其隶属于气单胞菌科、气单胞菌属,为A.caviae。A.caviae的报道较少,本菌株AC-CY携带7种毒力基因并具有较强的致病性,同时还存在多重耐药性,对水产养殖业具有潜在的威胁。

