牦牛乳腺上皮细胞的体外分离培养及鉴定
杨玉莹,荆海霞,董宝霞,张勤文
(青海大学农牧学院动物医学系,青海西宁 810016)
牦牛(Bosgrunniens)在我国主要分布于青藏高原及其周边地区[1],可稳定适应高原以低氧、低压、高寒为特点的恶劣环境,具有乳、肉、毛、绒、役等兼用的多种经济用途[2],不仅对我国牧区有着极为重要的经济价值,还表现出了特殊的生态和社会地位,被誉为“高原珍宝”[3]。其中,牦牛乳作为高原特有的一种天然资源,绿色、高品质、高营养食品为其优势特点[4],其丰富的功能性和生物活性成分[5],可发挥对机体有重要意义的抗氧化[6]、调节肠道微生物菌群[7]、免疫调节与抗炎[8]等生理功能,可极大满足消费者对高质量标准乳制品的消费需求。
由于放牧环境、饲养方式、品种特性[9-11]等原因,牦牛泌乳量相对较低[4,12],这不仅限制了牦牛乳及其制品在消费市场的地位,也在一定程度上造成了优质资源的浪费,因此对牦牛泌乳相关因子与其作用机制探究显得尤为重要。随着细胞生物学与分子生物学的发展,对乳腺泌乳的研究多为体外条件下、细胞水平上研究激素或基因调控,并深入探究到信号因子及其转导机制。目前虽有一系列培养乳腺上皮细胞(mammary epithelial cells,MECs)的技术体系,但是在物种上及可重复性上仍然不能满足需求,尤其对于牦牛这种生活环境独特且生长周期稳定的大型反刍动物,重复采集泌乳期乳腺组织并成功进行乳腺上皮细胞的培养与传代,相对来说,仍然是非常困难的。故建立稳定可重复的牦牛MEC体外分离、培养及鉴定技术体系对于高原牦牛泌乳相关问题的进一步研究是非常必要的。
本研究采取胰酶/Ⅰ型胶原酶分段消化法进行牦牛乳腺上皮的分离培养,并对分离培养得到的乳腺上皮细胞进行分子表型及功能鉴定,以期建立稳定可重复的牦牛乳腺上皮细胞培养体系,并为后期实现细胞永生化及研究牦牛乳腺的发育机制、泌乳机制和泌乳相关基因表达及其调控机制研究等提供参考资料。
1 材料与方法
1.1 材料
1.1.1 组织样品来源 青海省海北州祁连县养殖场成年泌乳期牦牛。
1.1.2 主要试剂 组织保存液(130-100-008),美天旖生物技术贸易(上海)有限公司产品;Ⅰ型胶原酶(C0130)、表皮生长因子(E4127)、氢化可的松(H0135)、DMSO(D2650),德国Sigma-aldrich公司产品;青霉素-硫酸链霉素(PYG0016)、DAPI染液(AR1176)、CCK8(AR1160)、HRP-羊抗兔IgG(BA1054)、鼠抗β-actin单克隆抗体(BM0627)、HRP-羊抗鼠IgG(BA1050),武汉博士德生物工程有限公司产品;DMEM/F12基础培养液(01-172-1ACS)、0.5 g/L胰蛋白酶/EDTA(03-053)、2.5 g/L胰蛋白酶/0.5 g/L EDTA(03-052),以色列Biological Industries公司产品;胎牛血清(FBS)(1099-141)、胰岛素-转铁蛋白-硒(41400-045),美国Gibco公司产品;4 g/L台盼蓝染液(C0040)、BCA蛋白浓度测定试剂盒(PC0020)、4×蛋白上样缓冲液(P1016)、凝胶制备试剂盒(P1200)、ECL Plus超敏发光液试剂盒(PE0010),北京索莱宝科技有限公司产品;波形蛋白一抗(bs-5833R)、CK18一抗(bs-2043R)、CK14一抗(bs-1792R)、β-酪蛋白一抗(bs-10032R),北京博奥森生物技术有限公司产品;荧光二抗试剂盒(P0186),上海碧云天生物技术有限公司产品;支原体检测(DNA荧光染料法)试剂盒(KGY0110)、全蛋白提取试剂盒(KGP250),江苏凯基生物技术股份有限公司产品;脱脂奶粉(232100),美国BD公司上海有限公司产品;催乳素(Peprotech-100-07),美国Peprotech公司产品。
1.1.3 主要仪器设备 Ti荧光倒置显微镜,日本Nikon公司产品;超净工作台、CO2培养箱、酶标仪和-80℃超低温冰箱,美国Thermo scientific公司产品;低温超速离心机和PCR仪,德国Eppendorf公司产品;电泳仪,Bio-Rad公司产品;化学发光凝胶成像系统,美国ProteinSample公司产品;核酸蛋白浓度测定仪,德国Implen公司产品;水平核酸电泳系统,北京凯元信瑞仪器有限公司产品。
1.2 方法
1.2.1 乳腺组织采集 于青海大学动物医院内采集10 g~20 g牦牛乳腺组织,置于生理盐水中多次涮洗至液体颜色变淡后,750 mL/L酒精浸泡3 s~5 s,无菌生理盐水再次涮洗后放入含20 g/L双抗的组织保存液中,750 mL/L酒精擦拭管口,无菌封口膜封口,于低温保温瓶内尽快带回实验室。
1.2.2 试剂配制 DMEM/F12培养液:150 mL/L~200 mL/L FBS+20 g/L双抗+基础培养液;0.5 g/L胰酶/0.2 g/L EDTA、2.5 g/L胰酶/0.5 g/LEDTA均为试剂成品,无需另外处理。
胶原酶Ⅰ溶液:用基础培养液溶解,使用浓度为1 mg/mL。
氢化可的松溶液:1 mL无水乙醇将其溶解,后加入19 mL基础培养液制备浓度为50 μg/mL的储存原液。
表皮生长因子溶液:500 μL(含100 mL/L FBS)基础培养液将其制备为0.2 mg/mL的储存原液。
催乳素溶液:用稀释液将其制备为500 μg/mL的储存原液。
诱导贴壁分化培养液:5 μg/mL胰岛素-转铁蛋白-硒+1 μg/mL氢化可的松+50 ng/mL表皮生长因子+DMEM/F12培养液。
传代培养液:1 μg/mL胰岛素-转铁蛋白-硒+200 ng/mL氢化可的松+10 ng/mL表皮生长因子+DMEM/F12培养液。
1.2.3 牦牛MECs的分离与原代培养 吸取约0.3 mL含20 g/L双抗的PBS于一次性60 mm培养皿中,剪取适当大小的组织块,修除杂组织,后将组织块剪碎至约1 mm3,用含20 g/L双抗的生理盐水反复漂洗3~5遍,直到液体变至无色及液面无漂浮物为止,1 000 r/min,离心5 min以收集组织,加入组织块6倍体积的2.5 g/L胰蛋白酶/0.5 g/L EDTA,封口后于37℃水浴中消化10 min,每2 min轻轻摇晃离心管,后70 μm细胞筛过滤,滤渣直接收集至离心管中,加入6倍体积的胶原酶Ⅰ(1 mg/mL),封口后于37℃水浴锅中消化2 h~3 h,每15 min~25 min轻晃离心管以充分均匀消化,视组织块被消化的程度和消化液的浑浊度依次用100 μm、70 μm细胞筛过滤,收集滤液并终止消化(视滤渣大小可选择继续消化),1 000 r/min离心6 min,弃上清,加1 mL诱导培养液(200 mL/L FBS)重悬细胞,镜下观察细胞密度,以保证高密度接种。
1.2.4 牦牛MECs的纯化、传代 待原代细胞铺至瓶底的70%~80%时,即可利用细胞对胰酶的敏感性及贴壁差异性纯化牦牛MECs。弃去旧培养液,用含20 g/L双抗的冷PBS清洗2~3遍后,加入0.5 mL冷0.5 g/L胰蛋白酶-0.2 g/L EDTA液于细胞表面预消化10 s,弃去液体,再加1 mL消化1 min,适时轻微摇晃培养瓶,镜下观察,待对胰酶敏感的成纤维细胞回缩变圆且有少量悬浮时,立即吸除消化液,加PBS迅速轻微漂洗2遍,后加入1 mL冷2.5 g/L胰蛋白酶-0.5 g/LEDTA消化,镜下观察,2 min左右待细胞变型且有微少细胞悬浮后,略略水平晃动培养瓶后终止消化,1 000 r/min离心6 min收集细胞,加入适量传代培养液重悬并接种,贴壁12 min左右,收集悬液高密度接种,适量补液,于培养箱内培养,48 h后换液。待细胞纯化完毕后,不再进行差速消化和差速贴壁,直接利用2.5 g/L胰酶/0.5 g/LEDTA进行细胞的传代,操作同上。
1.2.5 细胞形态学观察 做好细胞的观察记录,观察内容包括细胞的贴壁生长状况、形态等。
1.2.6 细胞的冻存、复苏及活力检测 细胞冻存:冻存液现用现配(FBS∶DMSO=9∶1)并4℃预冷。选择对数生长期的细胞(步骤同乳腺上皮细胞的传代),得到的细胞悬液以1 000 r/min离心6 min,吸尽液体,加入冻存液1 mL进行重悬,尽量无气泡,移入无菌冻存管,封口膜封口并标记,后放入程序降温盒内于-80℃冰箱过夜,次日即转入液氮。
细胞复苏:于37℃水浴锅使其快速完全融化,清理消毒,无菌条件下补充新鲜培养液,1 000 r/min离心6 min,收集细胞,加入1 mL完全培养液小心重悬,后以适当密度接种到25 cm2培养瓶,加入3 mL培养液,24 h后更换新鲜培养液。
台盼蓝染色法检测冻存前后的细胞活力。
1.2.7 细胞生长曲线绘制 取纯化3代的牦牛MECs,2.5 g/L胰酶/0.5 g/LEDTA消化并收集、重悬细胞,设空白孔(仅传代培养液)和实验孔(细胞+传代培养液),以2×104个/mL细胞密度接种,每孔接种0.1 mL细胞悬液,每隔1 d于96孔培养板内加入10 μL CCK8,孵育2.5 h,后于450 nm处测定各孔OD值,减去最大值及最小值后取各组平均值,实验组与空白组的OD值之差表示细胞活性,与细胞数量呈线性关系。连续计数至细胞铺满孔底,生长曲线以培养时间(D)为横坐标(x轴),OD值为纵坐标(y轴)。
1.2.8 牦牛MECs的细胞免疫荧光鉴定 具体操作参考试剂盒说明书,其中一抗浓度均为1∶200,二抗浓度均为1∶1000,阴性对照一抗为PBS。
1.2.9 Western blot检测β-酪蛋白的蛋白表达水平 为探究培养获得的牦牛MECs是否具有分泌β-酪蛋白的能力,试验提取了未经催乳素(仅传代培养液)或经催乳素(500 ng/mL催乳素+传代培养液)诱导48 h的细胞总蛋白,并以泌乳期牦牛乳腺组织作为阳性对照,通过Western blot试验检测其在蛋白水平上是否表达,其中以β-actin为内参,选择制备120 g/L分离胶及50 g/L浓缩胶,一抗浓度均为1∶1 000;二抗浓度均为1∶8 000。
1.3.0 支原体检测 具体操作参考试剂盒说明书。
2 结果
2.1 初期细胞贴壁生长情况
组合酶消化法所分离获得的细胞贴壁、增殖及分化速度均较快,第3天细胞贴壁量多,且见部分细胞开始增殖(图1A),培养第5天即见大部分贴壁细胞大量增殖并分化(图1B),高密度接种的条件下,平均于原代培养的第8天即能铺至细胞培养瓶底壁面积的85%以上,具有培养周期短、成功率高、最大限度地利用组织样品等优点。对比发现,于DMEM/F12培养液中添加激素可有效促进细胞贴壁、提高细胞活力及促进细胞增殖,后期传代时激素的加入可有效维持细胞形态及功能特征,延长细胞的传代次数。

图1 细胞镜下观察结果(10×)Fig.1 Cell observation by microscope(10×)
2.2 牦牛MECs形态学观察
原代培养细胞未经纯化时,多见呈扁平、梭状且轮廓不清的成纤维细胞与形态均一、排列整齐乳腺上皮细胞的混合生长(图2A),经多次纯化操作后,可得到纯度较高牦牛MECs。细胞低密度接种时,大部分于24 h内完成贴壁并增殖,未贴壁细胞部分仍有活力,单个细胞刚开始呈“煎蛋样”贴壁,后随增殖而呈独立的岛屿状(图2B),待细胞生长混合时,细胞呈上皮细胞特征,形成单层聚集,似“鹅卵石铺路样”,形态整齐均一,排列生长,活力旺盛,细胞间形成管腔状结构(图2C )。牦牛MECs的细胞核呈圆形或者椭圆形,核仁以2个~4个居多,排列紧密,未发现明显分泌的乳滴,但具有MECs典型的圆顶样结构(图2D)。
细胞前7代形态比较稳定,传至8代时,部分培养瓶内细胞形态发生变化,有的细胞呈长形,梭形,或三角形,并有拉网现象(图2.2E),边缘细胞逐渐变形,培养至12代后,细胞逐渐分化成多种形态,如大且扁平的圆形细胞、形态均一的铺路石样细胞及狭长不规则细胞,且随着培养时间的延长,扁平的圆形及狭长细胞包绕铺路石样细胞,并限制其增殖范围(图2.2F)。培养12代后,传代以低密度接种时,细胞生长缓慢并伴随空泡化、细胞崩解等衰亡迹象,但高密度均匀接种时,细胞活力相对旺盛,且具有继续增殖、传代的潜力。

A.原代培养时成纤维细胞与乳腺上皮细胞混合生长(10×);B.低密度接种乳腺上皮细胞呈岛屿状增殖(10×);C.高密度接种时,乳腺上皮细胞融合呈铺路石状(10×);D.细胞核以2~4个居多(20×);E.细胞呈拉网状,腔内边缘排列一层细长形态的细胞(10×);F.细胞分化出明显不同的形态(10×)A.fibroblasts and mammary epithelial cells in primary culture (10×);B.Low density inoculated mammary epithelial cells show island proliferation (10×);C.During high-density inoculation,the mammary epithelial cells fuse to form a paving stone state (10×);D.Most of the nuclei are 2 to 4 (20×);E.The cells show a tensile network,the edge of the lumen is lined with a thin layer of cells (10×);F.The cells differentiate into significantly different morphologies (10×)图2 牦牛乳腺上皮细胞形态观察结果Fig.2 Observation results of yak mammary epithelial cells
2.3 细胞冻存与复苏
冻存前和复苏后细胞活力均保持较高水平(85%以上),复苏后的乳腺上皮细胞形状规则,边缘整齐,短时间内即可贴壁分化,生长迅速、活力旺盛,仍保持聚集生长的特性。
2.4 细胞生长曲线绘制
牦牛乳腺上皮细胞在0~3 d、3 d~7 d、7 d后分别经历了生长迟缓期、对数生长期、平台期,生长曲线整体为“S”形(图3),表明培养的牦牛乳腺上皮细胞具有正常的分裂增殖特性,符合细胞生长的生物学规律。

图3 牦牛乳腺上皮细胞生长曲线Fig.3 Growth curve of yak mammary epithelial cells
2.5 牦牛MECs免疫荧光鉴定
免疫荧光结果(图4)表明,在荧光束下,分离纯化所得细胞的细胞质内,角蛋白18呈绿色荧光强阳性表达,另微弱表达β-酪蛋白,说明纯化后的细胞为乳腺分泌型上皮细胞;波形蛋白及角蛋白14阴性表达,说明纯化后所获得的细胞不存在成纤维细胞和乳腺肌上皮细胞,即纯化得到的牦牛MECs种类单一且具有正常泌乳生理功能。

A~C.角蛋白18(CK18)免疫荧光染色图(20×);D~F.β-酪蛋白(CSN2)免疫荧光染色图(10×);G~I.波形蛋白(Vimentin)免疫荧光染色图(10×);J~L.角蛋白14(CK14)免疫荧光染色图(10×);M~O.阴性对照图(10×)A-C.CK18 immunofluorescence staining (20×);D-F.CSN2 immunofluorescence staining (10×);G-I.Vimentin immunofluorescence staining (10×);J-L.CK14 immunofluorescence staining (10×);M-O.Negative control (10×)图4 牦牛乳腺上皮细胞特异性标记物检测结果Fig.4 Detection results of specific markers of yak mammary epithelial cells
2.6 β-酪蛋白的蛋白水平表达检测
以泌乳期牦牛乳腺组织作为阳性对照,Western blot结果显示,在经含有3种激素的培养液培养后,细胞在无催乳素刺激时,β-酪蛋白也可表现出在蛋白水平的表达;经催乳素刺激可有利于促进β-酪蛋白表达,明确了纯化后所培养的细胞是具有泌乳生理功能的牦牛乳腺上皮细胞(图 5)。

1.无PRL;2.有PRL,3.乳腺组织1.No PRL;2.PRL;3.Breast tissue图5 牦牛MECs内β-酪蛋白的蛋白水平检测结果Fig.5 Detection of protein level of MECs β-casein in yak
2.7 牦牛MECs支原体检测
镜下可见MECs的细胞核为圆形或椭圆形,于荧光束下发出蓝色荧光,但周围无丝状或散在的荧光颗粒小点即支原体的DNA染色斑,说明牦牛乳腺上皮细胞在培养过程中未被支原体污染(图6)。
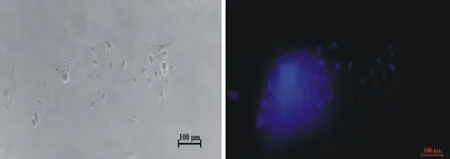
图6 荧光Hoechst 33258染色结果为阴性(10×)Fig.6 Negative staining result of fluorescent dye Hoechst 33258 (10×)
3 讨论
目前,培养乳腺上皮细胞的常用方法可分为组织块贴壁法和酶消化法,其中组织块贴壁法作为经典的原代细胞培养方法,一直以来在细胞体外分离培养中占有主要地位,亦在不断改进中[13-15],但相对于酶消化法,其优势尚不突出。在实际操作时,存在组织块干涸时间不好把握、培养周期长、迁出成功率较低等问题,本试验应用2.5 g/L胰酶/0.5 g/L EDTA组合Ⅰ型胶原酶分段消化发现,该方法所获得的细胞数量较多、活力较强、培养时间较短,细胞于原代培养第7天至第8天即可实现细胞的纯化传代,且操作具有可重复性,成功率较高,说明该操作程序具有可应用性。
组合酶消化所获得细胞大多为包含成纤维细胞和乳腺上皮细胞的异质细胞群,为保证目的细胞的存活与增殖,必须进行细胞的纯化。细胞的纯化方法主要有差速贴壁法、胰酶消化法和细胞刮刀法[16],因成纤维细胞对胰酶比较敏感,且贴壁速度更快[17],故可先通过低浓度即0.5 g/L胰酶(含0.2 g/LEDTA)预先消化掉大部分成纤维细胞,2.5 g/L胰酶(含0.5 g/L EDTA)则进行乳腺上皮细胞的消化分散,后将细胞悬液预接种,即于培养箱中静置培养10 min~15 min,见大部分成纤维细胞贴壁后,再将细胞悬液重接种,后期培养可发现MECs逐渐成为优势细胞群,视情况进行2~3次纯化,即可去除成纤维细胞。
细胞骨架包括微管、微丝和中间纤维,中间纤维家族中包含波形蛋白、角蛋白(CKs)等许多成员。其中间质细胞内主要的中间纤维是波形蛋白,如存在于成纤维细胞、内皮细胞和白细胞等;CK14和CK18则可分别作为乳腺肌上皮细胞和上皮细胞的分子标记物[18-20];除乳脂外,乳蛋白是判断乳腺特征的另一个基本指标,β-酪蛋白的表达已被用作MECs分化的重要标志[21],通常用来评估MECs的分泌功能。本试验通过细胞免疫荧光对纯化后的细胞进行分子表型鉴定,结果显示,细胞的细胞质中阳性表达CK18,而不表达波形蛋白和CK14,在氢化可的松、表皮生长因子、胰岛素-转铁蛋白-硒和催乳素作用下,均可检测到β-酪蛋白在蛋白水平的表达,综合说明纯化所得的细胞为为分泌型MECs,具有一定的泌乳能力且纯度较高。
体外培养时,添加一定的促细胞分裂剂可显著加快MECs原代培养的DNA合成,从而促进细胞的增殖[21]。表皮生长因子和胰岛素样生长因子能推进细胞周期进程,促使细胞由G1期进入S期,进而促进细胞分裂并刺激细胞的生长,转铁蛋白-硒钠可减缓细胞的衰退与老化,在仅添加这3种因子时,奶山羊MECs可传至30代且活力旺盛并具有乳蛋白分泌能力[22];体外培养细胞的贴壁和正常生长离不开氢化可的松的作用[23]。本试验在牦牛MECs分离后贴壁培养时添加胰岛素-转铁蛋白-硒、氢化可的松和表皮生长因子发现可极大提高细胞的贴壁数量,促进MECs的增殖分化,在传代培养过程中,降低三者的作用浓度,在保持β-酪蛋白在蛋白水平表达的同时,可有效维持细胞活力,增加牦牛MECs原代细胞的传代次数。
采用2.5 g/L胰酶/0.5 g/L EDTA结合Ⅰ型胶原酶消化方法成功分离培养了具有一定泌乳生理功能的牦牛乳腺上皮细胞,可为后期基于牦牛乳腺细胞水平上的相关试验提供一定的参考。

