甘薯蔓割病拮抗菌株KC2-8的筛选、鉴定及紫外诱变
张静珍, 靳晓杰, 王连军, 柴沙沙, 龙 同,杨园园, 程贤亮, 杨新笋*, 雷 剑*
(1.湖北省农业科学院 粮食作物研究所/粮食作物种质创新与遗传改良湖北省重点实验室/湖北省甘薯工程技术研究中心,湖北 武汉 430064; 2.长江大学 农学院,湖北 荆州 434025;3.国家生物农药工程技术研究中心/湖北省生物农药工程研究中心/湖北省农业科学院,湖北 武汉 430064)
甘薯蔓割病是我国南方甘薯种植区的主要病害,为导管系统病害,主要危害甘薯蔓茎基部,也可侵染薯块,发生规律与温度密切相关.2011年,湖北省在调查主要甘薯病害中发现,全省多地均发生了甘薯蔓割病的危害,部分产区发病率30%以上,对甘薯产业影响巨大[1].甘薯蔓割病的发生随机性较强,可使甘薯减产10%~20%,严重时可减产50%以上.近年来,在长江中下游区域发现有甘薯蔓割病的发生.甘薯蔓割病的主要致病真菌为尖孢镰刀菌甘薯专化型(Fusariumoxysporumf.sp.batatas,Fob),是一种具有较强腐生和寄生能力、分布较为广泛的土传性真菌病害,可侵染茄科、瓜类、棉花、香蕉、豆类及花卉等多种植物,引起枯萎病.
目前,尖孢镰刀杆菌的主要防治方法有:培育抗病新品种,利用化感物质及化学药剂防治结合农业措施.如,吴振新[2-3]研究表明,利用50%菌灵可湿性粉剂1 000倍液和20%噻森铜悬浮剂600倍液浸苗10 min,晾干后种植,结合有机肥的施用,可大大降低甘薯蔓割病的发病率.化学杀菌剂使用效果虽好,但是存在潜在风险.张鸿等[4]通过农杆菌转化筛选非致病突变体试验,获得3株非致病突变体,可与蔓割病菌发生营养竞争作用抑制菌丝生长,从而为甘薯蔓割病生物防治提供了理论基础.因此,以生物防治为主,代替化学防治的研究对尖孢镰刀菌的防治具有重要意义[5].
芽孢杆菌为革兰氏阳性杆菌,存在于植物微生态和土壤中,是优势生物种群,能在逆境下形成内生芽孢以抵抗不良环境[6],例如:耐酸碱、紫外、高温等;制剂成本低,易加工,安全性和稳定性较好;促进植物生长,增加产量,诱导植物产生抗病性[7].目前,芽孢杆菌已成为生物农药研发热点[8],如王波等[9]通过一株多粘类芽孢杆菌XZ-2对甘薯黑斑病的生防效果和作用机理进行了研究,结果表明,利用稀释10倍的XZ-2发酵液处理贮藏期薯块可有效抑制黑斑病孢子萌发.
本文以实验室保存的菌株为研究对象,筛选对尖孢镰刀菌甘薯专化型具有高效拮抗活性的菌株,对筛选出来的菌株KC2-8进行分子鉴定,并通过紫外照射时间的变化对原始菌株进行诱变,筛选到抗真菌生物活性较高的新突变株,从而更好地应用于生产实践.
1 材料与方法
1.1 供试菌株
尖孢镰刀菌甘薯专化型由徐州市农业科学研究院提供.供试菌株KC2-2、KC2-8、KC6-5由湖北省生物农药工程研究中心分离鉴定和保存.
1.2 供试培养基
PDA培养基:新鲜马铃薯(去皮)200 g,煮沸20 min,过滤加葡萄糖20 g,琼脂粉20 g,加蒸馏水定容至1 000 mL,115 ℃灭菌20 min.
LB培养基:NaCl 10 g,酵母粉5 g,蛋白胨10 g,加蒸馏水定容至1 000 mL,115 ℃灭菌20 min.
1.3 拮抗细菌的筛选
将经LB培养基活化的KC2-2、KC2-8、KC6-5分别接种于PDA培养基两侧,再将5 mm的尖孢镰刀杆菌菌饼接种于培养基中间,以只接种病原菌的PDA平板为对照,每个处理3个重复.置于28 ℃暗培养箱内96 h,待对照长满整个平板时观察菌株对病原菌的拮抗效果.抑菌率公式如下:
其中D表示直径.
1.4 分子生物学鉴定
将待测菌株KC2-8接种到LB液体培养基上,于28 ℃、180 r/min振荡培养24 h,将菌液直接作为DNA模板进行16S rDNA序列的PCR扩增.扩增总体系为25 μL,包括菌液DNA 1 μL,正反向引物各1 μL,ddH2O 9.5 μL,Master mix 12.5 μL.扩增程序:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min 30 s,33个循环;72 ℃延伸10 min.扩增产物经1%琼脂糖凝胶检测后,由天一辉远公司测序.测序结果在NCBI网站通过BLAST程序进行同源性比对,并用MEGA 7.0软件的邻接法(Neighbor-Joining Tree)构建系统发育树.
1.5 紫外诱变实验
1.5.1 液体菌种的制备将KC2-8菌株活化后,菌饼放至LB液体培养基中,200 r/min、28 ℃振荡培养24 h.
1.5.2 紫外诱变菌液浓度的确定分别取6支盛有9 mL无菌水的试管,依次编号为10-1、10-2、10-3、10-4、10-5、10-6,另取盛有LB无菌培养皿9套,编号10-4,10-5,10-6各3皿.将枯草芽孢杆菌于LB液体培养基中培养20 h,吸取1 mL离心后的菌液上清加到10-1试管中,振荡混匀,再将10-1的菌悬液取1 mL加入到10-2试管中,其余试管依次类推.分别精确吸取10-4、10-5、10-6的稀释液0.1 mL,对应加入已编号培养皿中,涂布均匀,待菌液稍干后,倒置,于28 ℃培养箱中培养12 h,对编号10-4、10-5、10-6培养皿的菌落进行计数.
1.5.3 KC2-8菌株的紫外诱变将KC2-8菌株活化后,取适量菌液10 000 r/min离心2 min,用生理盐水稀释成浓度为107~108个/mL,再取100 μL制备好的菌悬液均匀涂布于LB固体培养基中,分别进行5、10、15、20、30 s的紫外诱变,通过平板计数法估算单菌落数量(n),以未经辐照的涂布平板为对照组估计致死率,以决定最佳辐照时间.致死率为
1.5.4 诱变菌株的筛选将紫外诱变后的菌悬液稀释至一定倍数,取100 μL均匀涂布于LB固体培养基上,经紫外诱变照射不同时间后,28 ℃ 12 h暗培养,将平板上菌落直径大、生长迅速的单菌落涂布接种至斜面PDA培养基,4 ℃保存.
2 结果与分析
2.1 拮抗菌株的筛选和16S rDNA分子鉴定
2.1.1 尖孢镰刀菌的拮抗菌株筛选通过平板对峙法检测3株细菌对尖孢镰刀杆菌的拮抗作用.由图1可知,菌株KC2-8对尖孢镰刀杆菌抑制作用最强,抑菌圈最大,抑菌率为62.2%.菌株KC6-5的抑菌效果次之,抑菌率为52.4%,KC2-2的抑菌效果最差,抑菌率为50.0%.
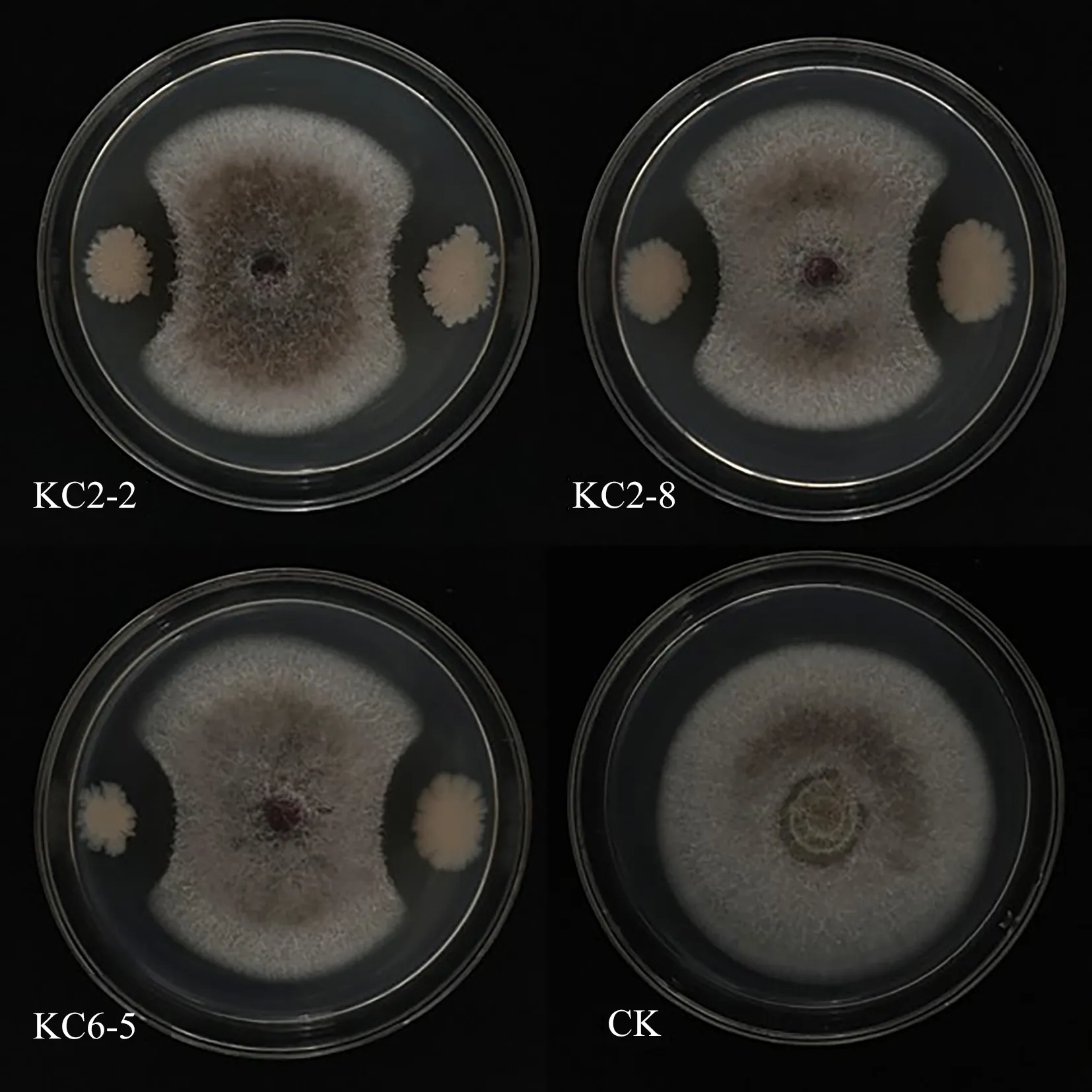
图1 3株细菌对尖孢镰刀杆菌的拮抗图Fig.1 Antagonistic diagram of three bacterial strains against Fusarium oxysporum
2.1.2 拮抗菌株的分子生物学鉴定以菌株KC2-8菌液为DNA模板,采用细菌通用引物16S rDNA进行菌液PCR扩增、回收、测序.测得KC2-8菌株16S rDNA基因片段长度为1 402 bp.将测序结果与NCBI数据库进行BLAST比对,结果显示:与菌株KC2-8相似性最高的为Bacillusmojavensis,相似度达到99%.从图2可以看出,菌株KC2-8与BacillusmojavensisstrainHM753629.1和BacillustequilensisstrainKT982221.1同属于一个遗传分支,亲缘关系十分接近,菌株KC2-8与BacillusmojavensisstrainHM753629.1在BLAST比对过程中的相似度为99.93%,与BacillustequilensisstrainKT982221.1的相似度为100%,最终将KC2-8确定为特基拉芽孢杆菌(Bacillustequilensis).

图2 基于16S rDNA序列构建的KC2-8菌株系统发育树Fig.2 Phylogentic tree based on sequence of 16S rDNA of strain KC2-8
2.2 拮抗菌株KC2-8的紫外诱变
2.2.1 紫外(UV)照射时间对KC2-8菌株致死率的影响KC2-8经不同诱变时间后,计算单菌落的个数、菌株的致死率并绘制UV诱变致死率曲线,结果显示(图3):KC2-8菌株对紫外诱变较为敏感,随着诱变时间的增加,致死率呈上升趋势,在10~20 s致死率上升速度最快,UV 照射20 s致死率为89.6%,30 s致死率高达99.2%,故选择UV照射 20 s为最佳诱变时间.
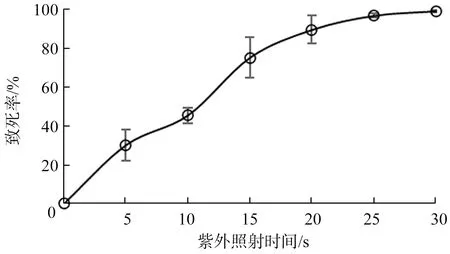
图3 UV诱变时间与致死率的关系Fig.3 Relationship between time of UV mutagenesis and mortality
2.2.2 KC2-8诱变高产菌株的筛选通过平板对峙法筛选高产菌株,结果如图4所示,共筛选出10株(UV1—UV10)高产优质诱变菌株,紫外诱变时间:CK,0 s;UV1,5 s;UV2,10 s;UV3、UV4,15 s;UV5、UV6,20 s;UV7、UV8,25 s;UV9、UV10,30 s.
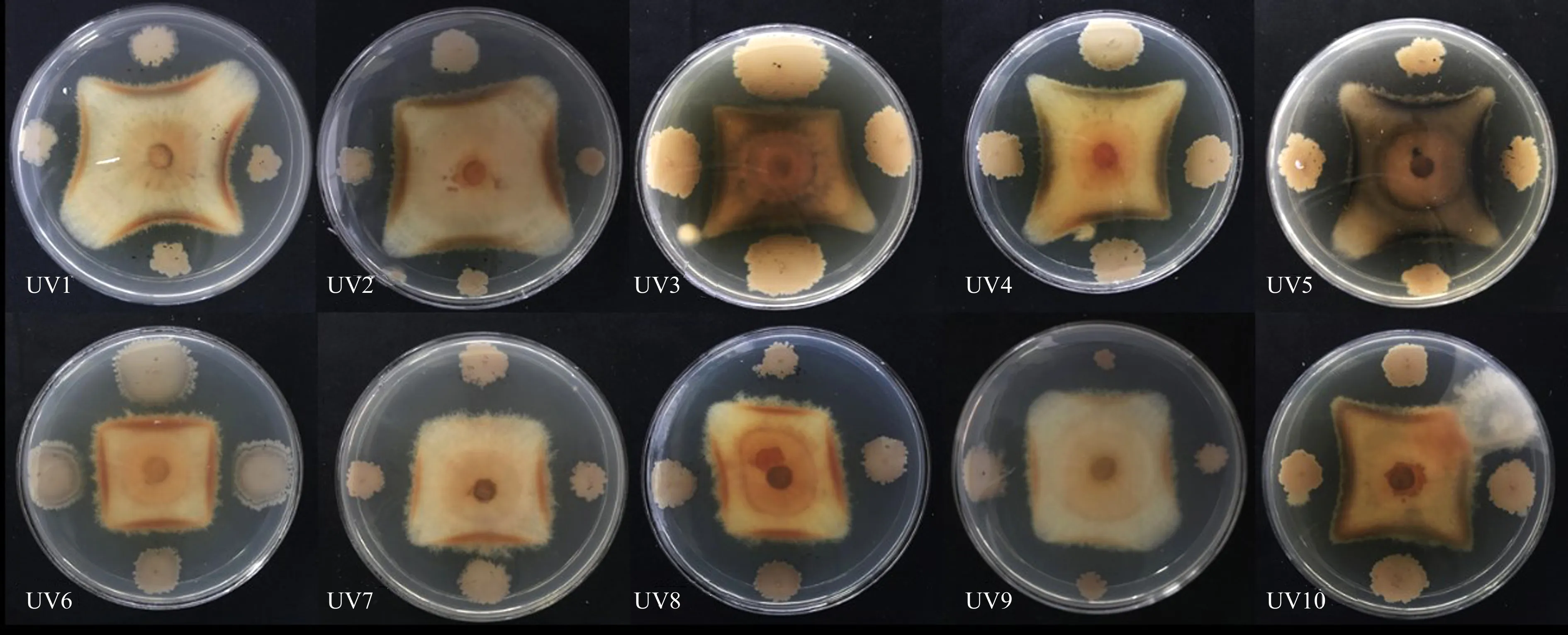
图4 KC2-8紫外诱变后复筛菌株发酵液对峙尖孢镰刀杆菌生长的抑制图Fig.4 Inhibition of Fusarium oxysporum growth in fermentation broth of KC2-8 strain after ultraviolet mutagenesis
10株诱变株抑菌活性如图5所示:菌株KC2-8的抑菌能力随着紫外照射时间增加呈现先降低后升高的趋势.在尖孢镰刀杆菌对峙中,UV5—UV10菌株抑制率高于原始菌株,其中:UV7抑菌效果最好,抑菌率为48.9%,较原始菌株的抑菌率提高了4.0%,UV8和UV9表现次之,抑菌率为48.4%,较原始菌株KC2-8提高了3.5%,且UV5—UV9的抑菌率差异不显著.UV1—UV4较CK抑菌率减少了3.6%~6.2%,抑菌效果较差.

图中不同字母表示处理间差异显著(p<0.05).图5 KC2-8紫外诱变后复筛菌株发酵液对峙尖孢镰刀杆菌生长的抑菌率Fig.5 Inhibition rate of KC2-8 fermentation broth byUV radiation on the growth of fusarium oxysporum
3 讨论与结论
大量研究表明:生防菌,如芽孢杆菌具有内生固氮、防治病害等生物学作用且对人畜无害,对环境友好.其生防机制主要表现在拮抗病原菌[10-14]、诱导植物产生抗病性[15-17]、溶解病原菌[18]、竞争[19]等方面.特基拉芽孢杆菌是Gatson等[20]从墨西哥的一个墓穴中首次分离得到的,它是一种广谱拮抗菌,可有效抑制黑曲霉、毛霉菌[21]、小麦赤霉病菌[22]、桑树地杖菌[23]、烟草黑胫病菌[24]、西瓜枯萎病菌[25]、大豆炭疽病菌[26]等.近年来,特基拉芽孢杆菌分离提取在国内外已有较多研究,如:Paliya等[27]从城市生活垃圾处理厂中分离出好氧降解的特基拉芽孢杆菌,为污染环境中PBDEs的生物修复提供了新的解释;Nayarisseri等[28]从微咸水中分离鉴定出一株新型的生物表面活性剂产生菌,即特基拉芽孢杆菌.Pradhan等[29]研究发现,特基拉芽孢杆菌通过产生生物表面活性剂等物质,破坏病原菌的生物膜,以达到抑菌效果.而特基拉芽孢杆菌开发利用仍有待研究.江苏师范大学邢珂等[30]申请了一种产挥发性抑菌气体的特基拉芽孢杆菌的专利,特基拉芽孢杆菌产生的挥发性气体对植物病原菌有强烈的拮抗作用,可显著抑制其致病力,对远距离防治植物病原菌具有参考价值.
本研究通过平板对峙对3个菌株进行筛选,筛选到一株对Fob具有拮抗活性的菌株KC2-8,该菌可有效抑制Fob的扩散.利用16S rDNA序列分析,将该菌株鉴定为特基拉芽孢杆菌BacillustequilensisstrainKT982221.1.通过对KC2-8进行紫外诱变,选择20 s为最佳诱变时间,致死率为89.6%.通过平板对峙筛选得到6株稳定突变株,其中UV7抑菌率高达48.9%,随着诱变时间的增加,抑菌率呈现先降低后升高的趋势.本研究结果可为由尖孢镰刀杆菌F.oxysporum引起的甘薯蔓割病的防治提供参考,但是对KC2-8菌株的抑菌活性物质及其对甘薯蔓割病的田间防治效果尚需进一步研究.

