基于网络药理学和分子对接技术的人参固本口服液治疗乳腺癌作用机制研究Δ
王艺璇,谭影影,陈美琳,黄佳奇,翟弋焱,吴嘉瑞
(北京中医药大学中药学院,北京 102488)
乳腺癌是全球女性最常见的恶性肿瘤,其病因尚不明确。2018年调查数据显示,全球女性乳腺癌的发病率在女性恶性肿瘤中最高,达24.2%[1]。我国女性乳腺癌发病率(36.1/105)和死亡率(8.8/105)分别居我国女性恶性肿瘤的第1位和第4位,年度变化百分比分别为3.9%和1.1%,均呈现升高趋势[1-2]。中医相关资料研究发现,乳腺癌属于中医学“乳石痈”“乳岩”等范畴,后世称该病为“乳岩”并沿用至今[3]。乳腺癌常见的中医证型为肝郁气滞、脾虚痰湿和冲任失调型等,气郁、痰浊、瘀血和热毒等邪气盛实为形成乳腺癌的主要原因[3-4]。近年来,中医对乳腺癌的了解记录已经与现代医学对乳腺癌的描写特征基本一致[5]。人参固本口服液由人参、熟地黄、牡丹皮、茯苓、山茱萸、山药、生地黄、泽泻、麦冬和天冬10味药组成。研究结果表明,人参含有人参皂苷、人参烯等多种可能具有抗癌作用的化学成分[6];茯苓作为扶正抗癌药,具有促进免疫球蛋白形成等免疫增强作用,可激活免疫监视系统,直接抑制肿瘤的生长[7]。因此,人参固本口服液具有益气补血、安心宁神和健脾固肾等功效,对乳腺癌具有一定的治疗作用。中药的特点为多成分、多作用靶点和作用途径复杂等,方剂配伍以“君、臣、佐、使”为组方原则[8]。网络药理学的特点与中医药学的原理殊途同归,这为中医药的现代化和国际化指明了方向[8-9]。因此,本研究借助网络药理学和分子对接方法,探讨人参固本口服液的作用机制,为人参固本口服液在乳腺癌及其他疾病中的合理应用提供参考。
1 资料与方法
1.1 收集并筛选人参固本口服液的活性成分
通过中药系统药理学数据库与分析平台(TCMSP)(https://tcmsp-e.com/)以及BATMAN-TCM平台(https://bionet.ncpsb.org.cn/bat-man-tcm/),分别以人参、熟地黄、牡丹皮、茯苓、山茱萸、山药、泽泻、天冬、地黄和麦冬为关键词检索人参固本口服液中的化学成分。同时,系统检索各大数据库中关于人参固本口服液化学成分研究的已有文献,筛选出同为人参固本口服液的活性化合物作为补充。口服生物利用度(OB)≥30%的化合物被认为可被人体吸收利用[10]。类药性(DL)≥0.18的成分对机体产生活性具有重要参考价值[11]。因此,以OB≥30%且DL≥0.18为筛选条件,借助TCMSP平台得到上述10味药中化合物符合的成分作为活性成分。在BATMAN-TCM数据库检索时,以scorecutoff≥20且P-valuecutoff<0.5为筛选条件。
1.2 预测人参固本口服液活性成分的靶点
借助Pubchem数据库(https://pubch-em.ncbi.nlm.nih.gov/)收集活性成分的简化分子线形输入规范(SMILES)信息,并将所得信息导入SWISSTargetPrediction数据库(http://www.swisstargetprediction.ch)预测靶点。在Pubchem数据库无法获取活性成分的SMILES信息,则直接在SWISSTargetPrediction数据库上画出该化合物的结构来预测靶点。
1.3 乳腺癌相关靶点筛选
以“breast cancer”为关键词,在人类孟德尔遗传综合数据库(OMIM)(https://www.omim.org/)和基因名片数据库(GeneCards)(https://www.genecards.org/)中检索筛选乳腺癌的相关靶点,合并得到的所有靶点并去除重复数据,最后结果为乳腺癌的相关靶点。
1.4 网络图的构建
使用Cytoscape 3.8.2软件构建人参固本口服液活性化合物和预测靶点构建“化合物-靶点”网络并分析,通过度值、介数中心度和紧密中心度3个关键拓扑参数筛选关键化合物。
1.5 蛋白质-蛋白质相互作用(PPI)网络的构建
取化合物靶点和乳腺癌靶点的交集靶点,将所得靶点录入STRING网站(https://string-db.org/cgi/input.pl),得到其PPI网络。将数据导入Cytoscape 3.8.2软件中进行拓扑分析并使用软件中的MCODE功能对其进行模块分析。
1.6 富集分析
使用Metascape(http://metascape.org/gp/index.html#/main/step1)平台对MCODE分析获得的人参固本口服液治疗乳腺癌的潜在关键基因进行基因本体(GO)功能富集分析和京都基因与基因组百科全书(KEGG)通路富集分析,并将结果以气泡图的形式呈现。
1.7 分子对接
在STRING网站上获取核心靶点的PDB编码,输入至蛋白质数据库(PDB,https://www.rcsb.org/),下载该核心靶点三维结构的PDB格式。在PubChem数据库下载对应化合物三维结构的SDF文件,并用Chem 3D转变为PDB格式。利用Notepad++软件对从PDB数据库下载的蛋白结构去水和去除蛋白原结构以外的其他小分子结构。上传至Autodock Tools 1.5.6设置活动键和可旋转键时需要移动的最少原子数目,保存为pdbqt格式。将处理后的蛋白结构导入Autodock Tools软件中进行合并非极性氢、加氢和加电荷等操作,并确定活性口袋位置,设置Grid Box的坐标与盒子大小。最后,使用Autodock Vina 1.1.2软件进行分子对接运算并使用PyMol 2.3.2软件进行可视化处理。
2 结果
2.1 筛选活性化合物
使用TCMSP数据库检索人参、泽泻、熟地黄、地黄、牡丹皮、茯苓、天冬、山茱萸、山药和麦冬10味中药的活性成分。由于TCMSP数据库没有麦冬、地黄的相关成分,故在BATMAN-TCM数据库检索。查找相关文献发现,人参皂苷Rg1、人参皂苷Rb1、人参皂苷Re以及丹皮酚在人参固本口服液中含量较高,且药理学研究发现其具有免疫调节作用,故将其保留为人参固本口服液的活性成分。最终共得到129个活性化合物及对应靶点489个,以及乳腺癌相关人类靶点15 240个(人参活性化合物22个、靶点542个;泽泻活性化合物10、靶点900个;熟地黄活性化合物2个、靶点200个;天冬活性化合物9个、靶点837个;牡丹皮活性化合物11个、靶点453个;地黄活性化合物2个、靶点29个;茯苓活性化合物15个、靶点821个;麦冬活性化合物18个、靶点411个;山茱萸活性化合物20个、靶点359个;山药活性化合物16个、靶点282;补充活性化合物4个、靶点79个),两者交集靶点共448个。其中,度值较大的靶点为SHBG、AR、CYP17A1、HMGCR、PTPN2和CES2等。
2.2 “化合物-靶点”网络的构建与分析
将人参固本口服液的活性化合物及潜在靶点导入Cytoscape 3.8.2进行网络分析,得到的人参固本口服液化合物-靶点网络共包含603个节点、3 262条边,见图1;图中,正方形表示药物;菱形表示靶点;六边形表示药物的共同化合物;圆形表示化合物。在“化合物-靶点”网络中,节点的度值代表网络中节点相连路线的条数。根据度值、介数中心度和紧密中心度3个关键拓扑参数筛选关键化合物。若1个节点在网络中连接较多的化合物或者靶点,其可能为关键的化合物或靶点。各边表示化合物分子与靶点间的相互作用关系。将人参固本口服液的活性化合物作用靶点和乳腺癌相关人类靶点取交集,共得到448个靶点,制作成韦恩图,见图2。

图1 人参固本口服液化合物-靶点网络图

图2 人参固本口服液-乳腺癌共同靶点韦恩图
2.3 构建PPI网络
将共同靶点通过STRING进行网络分析,并利用Cytoscape 3.8.2得到其PPI网络图,见图3;图中,每个节点的大小代表其度值,连线的粗细代表边介数。网络中有448个节点和1 360条边。根据PPI网络可知,SRC、STAT3、MAPK3、MAPK1、HSP90AA1、EP300、PIK3R1、RELA、Akt1、JUN、EGFR、ESR1和RXRA等13个靶点为核心靶点。
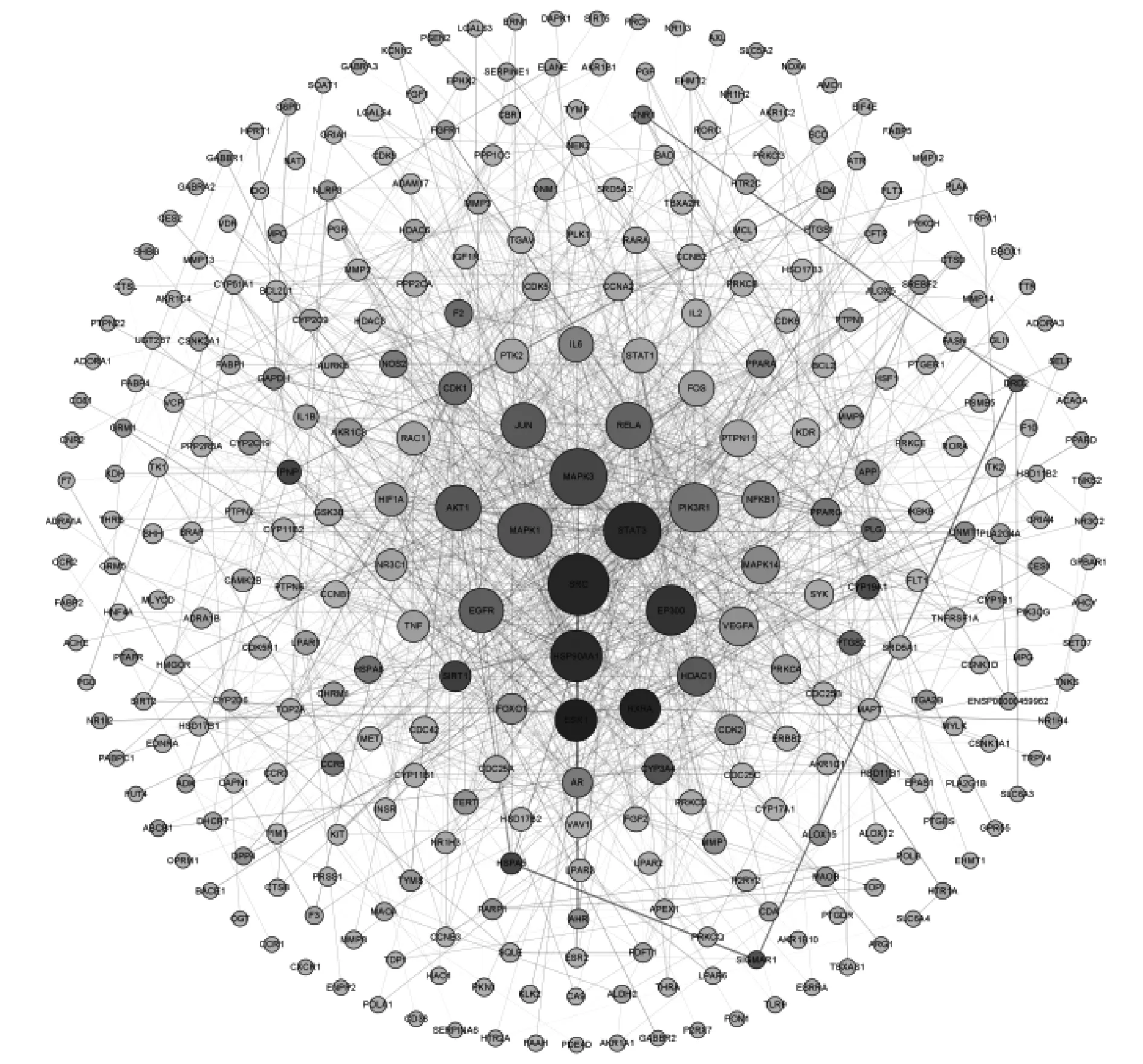
图3 人参固本口服液相关靶点PPI网络图
2.4 模块分析、GO和KEGG分析
在对蛋白互作网络进行分析后,对总的PPI网络图进行KEGG通路富集分析,共得到205条通路,图4展示了前30条显著的通路。基于文献搜索发现,磷脂酰肌醇3-激酶(PI3K)-蛋白激酶B(Akt)信号通路在肿瘤方面研究广泛,且其在KEGG分析结果中排序靠前,推测其与人参固本口服液治疗乳腺癌的作用机制相关,见图5;图中,箭头代表激活作用,线段代表抑制作用。对总的PPI网络图进行GO分析,最终得到与生物过程(BP)相关的条目2 949条;细胞组成(CC)相关条目180条;分子功能(MF)相关条目363条。展示各自前15条显著的条目,表明人参固本口服液活性化合物可能通过多种生物调控过程发挥抗乳腺癌的作用,见图6;图中,圆形颜色由深至浅表示-lg(P)由大到小。同时使用Cytoscape 3.8.2的MCODE功能对PPI网络进行模块分析,设置k-Core值为5,最终获得4个聚类模块,用Metascape进行GO和KEGG富集分析,并将结果可视化,见图7。
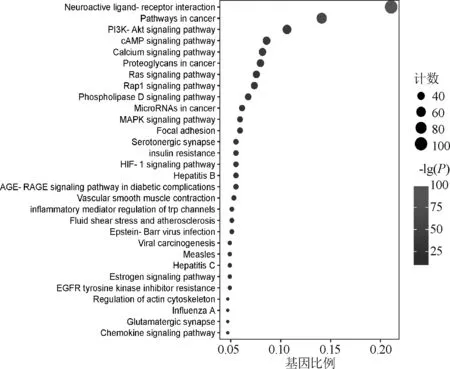
图4 KEGG通路富集分析部分结果图
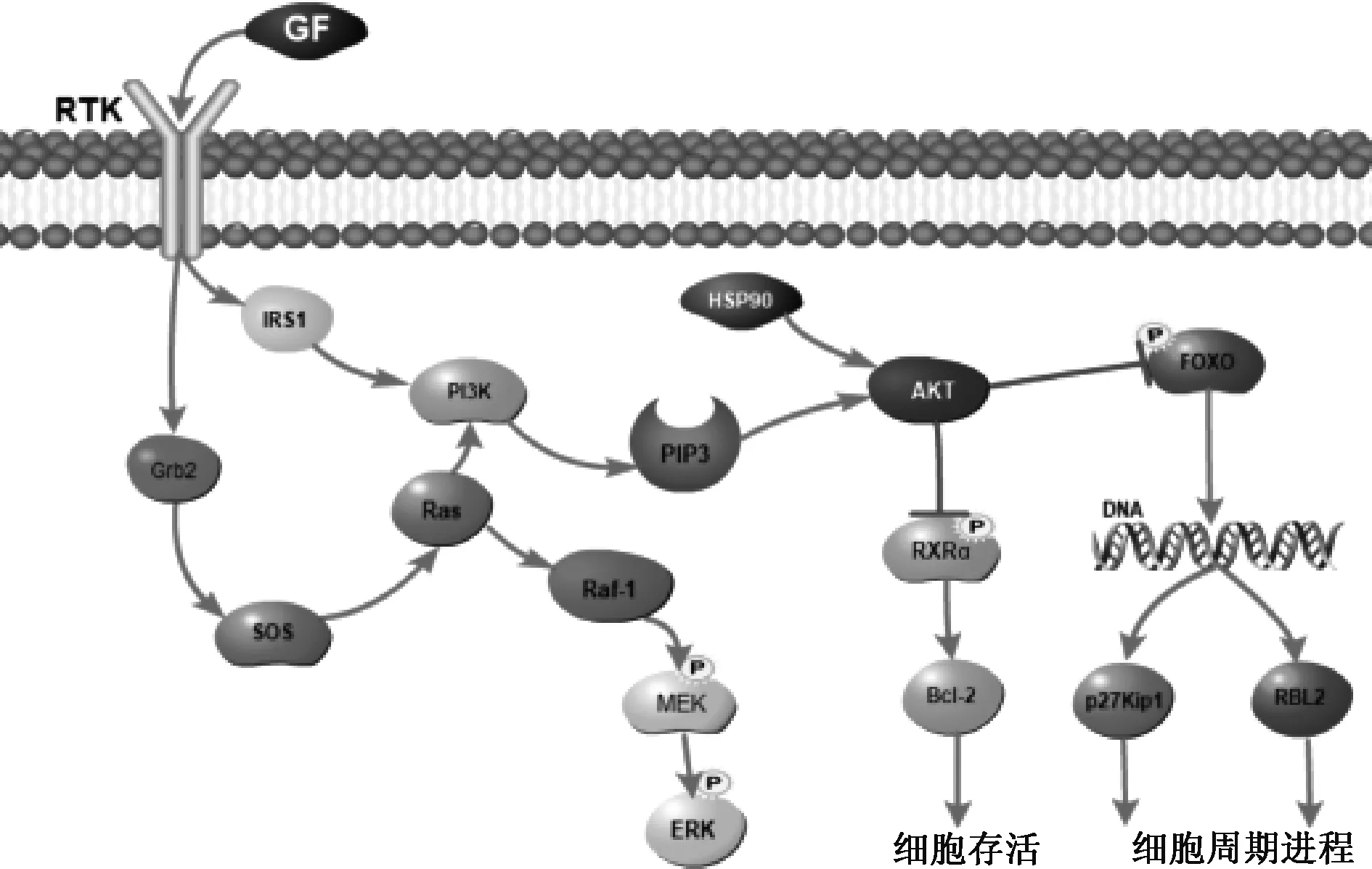
图5 PI3K-Akt信号通路图
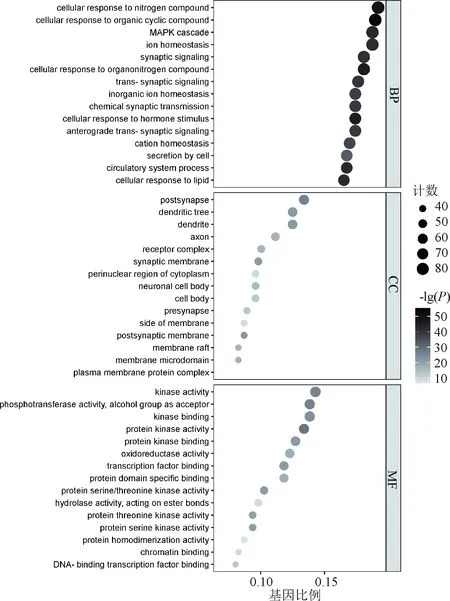
图6 GO功能富集分析部分结果图
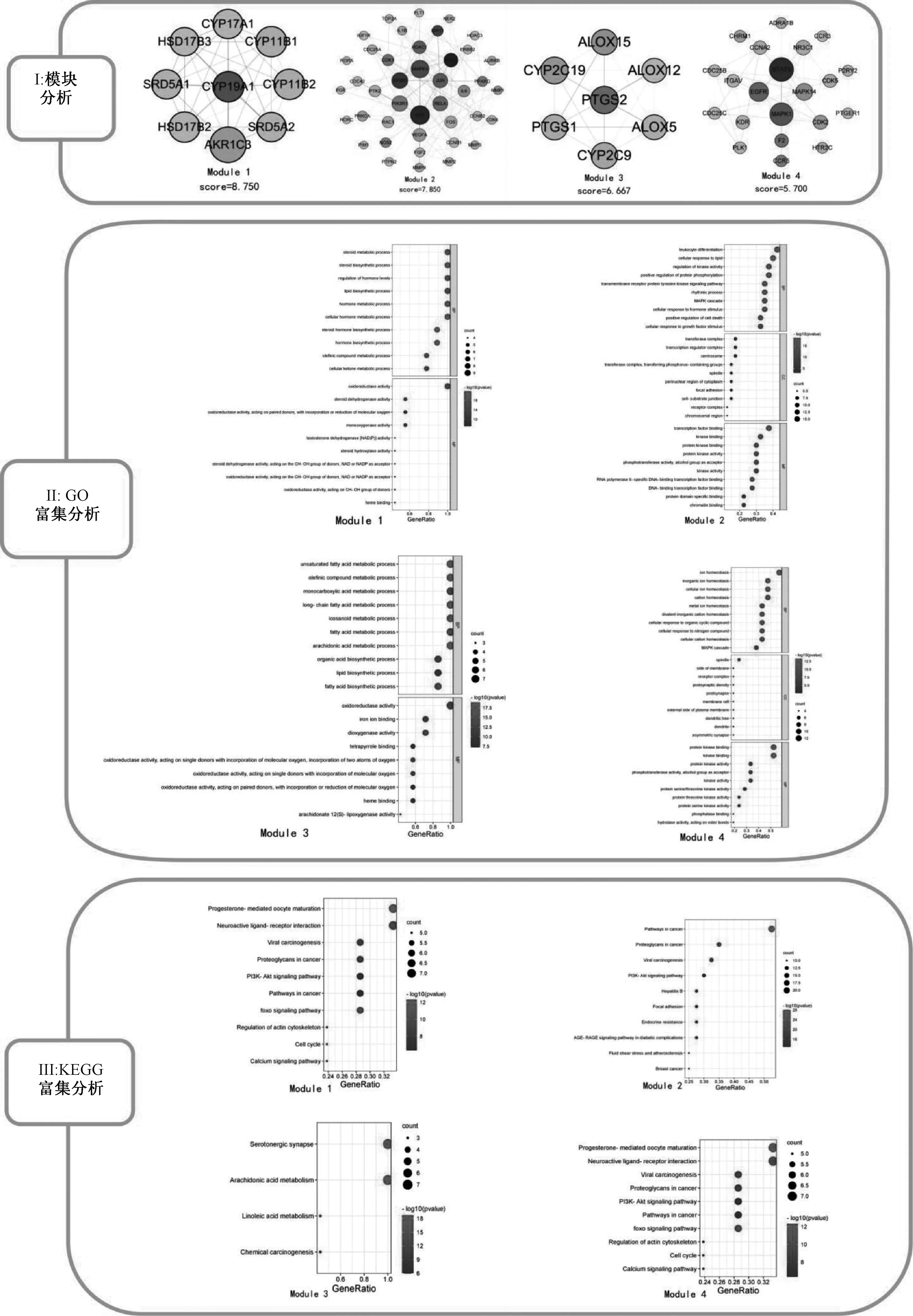
图7 模块分析与GO功能和KEGG通路富集分析结果图
2.5 “中药-化合物-靶点-通路”相互作用网络图
将整理出的13个核心靶点与其对应的化合物、药材和排序居前30位的KEGG通路的数据,载入Cytoscape 3.8.2软件中构建网络模型,得到“中药-化合物-靶点-通路”相互作用网络图,见图8;图中,六边形代表药物,箭头形代表化合物,圆形代表靶点,正方形代表通路。
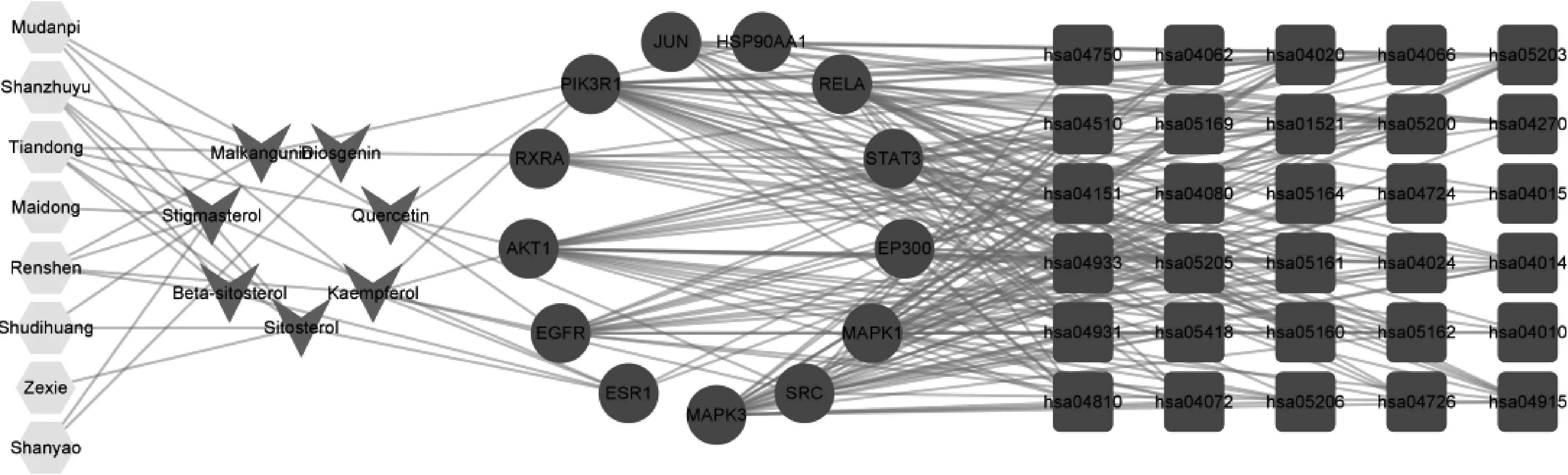
图8 “中药-化合物-靶点-通路”相互作用网络图
2.6 分子对接
为进一步探究人参固本口服液治疗乳腺癌的作用机制,选取SRC、HSP90AA1、PIK3R1、Akt1、EGFR和ESR1等6个核心靶点及其对应的山柰酚(kaempferol)、槲皮素(quercetin)、马尔肯久纳醇苯酯(malkangunin)、豆固醇(stigmasterol)、β-谷甾醇(beta-sitosterol)和谷甾醇(sitosterol)等6个活性化合物,用AutoDockTools和Vina软件进行分子对接,结果见表1。结果显示,最低结合能越小,表示其对接的效果越好,最低结合能<-20 929.26 J/mol表示具有良好的结合活性。利用PyMol对结果进行可视化,见图9。

A.山柰酚作用于SRC;B.槲皮素作用于SRC;C.马尔肯久纳醇苯酯作用于HSP90AA1;D.山柰酚作用于PIK3R1;E.槲皮素作用于PIK3R1;F.山柰酚作用于Akt1;G.槲皮素作用于Akt1;H.山柰酚作用于EGFR;I.槲皮素作用于EGFR;J.豆固醇作用于ESR1;K.β-谷甾醇作用于ESR1;L.山柰酚作用于ESR1;M.谷甾醇作用于ESR1
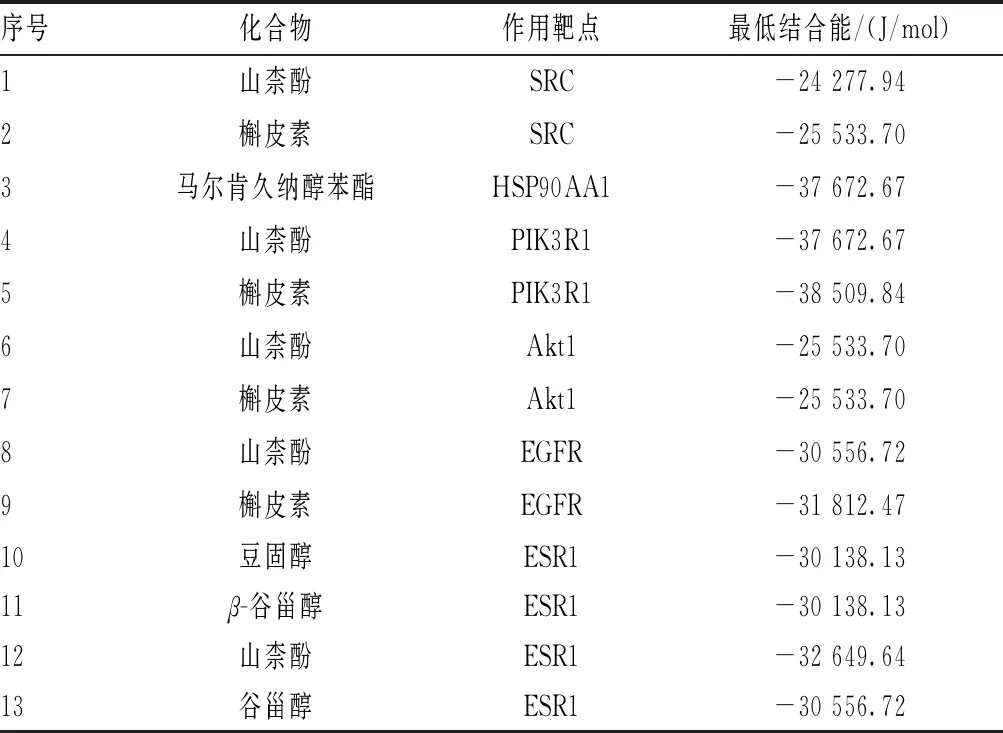
表1 化合物与作用靶点结合表
3 讨论
本研究通过靶点预测、网络构建和分子对接等方法,对人参固本口服液治疗乳腺癌的作用机制进行初步的研究和探讨。首先通过检索数据库和已有文献获得人参固本口服液中129个活性化合物,并对其进行靶点预测,共得到3 138个潜在作用靶点。“化合物-靶点”网络显示山柰酚、槲皮素、豆甾醇和栓菌酸的Degree值最高,提示其在人参固本口服液治疗乳腺癌的过程中发挥了重要作用。研究结果发现,山柰酚可以通过调控Akt/PI3K/糖原合成激酶3β信号通路对人炎性乳腺癌细胞株凋亡的促进作用[12];槲皮素可以通过阻止乳腺癌干细胞中表皮生长因子诱导的血管生成[13];谷甾醇可以抑制PI3K-Akt信号通路,逆转上皮-间质的转化,从而诱导乳腺癌细胞凋亡并抑制其转移[14]。
SRC、STAT3、HSP90AA1、PIK3R1、Akt1、EGFR和ESR1被鉴定为核心靶点。研究结果表明,SRC的活化和过度表达在调节肿瘤血管生成、生存、迁移及侵袭等方面有着重要作用,而乳腺癌组织中的SRC表达显著升高,且常存在异常活化[15];STAT3可以调控cyclin家族及MMP家族等细胞的细胞周期进程,且STAT3的表达上调也可能与乳腺癌的转移有关[16];HSP90AA1参与伴侣蛋白复合物的组装、蛋白质折叠、调节蛋白热反应和细胞内稳态等,而与正常的乳腺组织相比,乳腺癌组织中的HSP90AA1 mRNA高表达,且其高表达患者的总体生存期与无病生存期比低表达患者短[17]。
PI3K-Akt信号通路图中的Akt、HSP90和RXRα为人参固本口服液的关键靶点,FOXO在人参固本口服液中的度值也较高。根据信号通路图可知,药物作用于PI3K、Akt后,一方面能够抑制RXRα的磷酸化,从而抑制Bcl-2,提高细胞的存活率,另一方面能够抑制FOXO的磷酸化,激活p27Kip1和RBL2,推动细胞周期进程。并且有研究结果发现,过度激活PI3K-Akt信号通路后,可以引起一系列反应,包括细胞的生长、增殖和转移,从而与乳腺癌密切相关[18]。T淋巴细胞可以通过PI3K-Akt信号通路抑制乳腺癌的细胞增殖[19]。分子对接结果显示,化合物小分子配体与其对应蛋白受体对接的最低结合能均<-20 929.26 J/mol,说明结合情况较好,对应的配体与受体间结合较牢固,亲和力较高。
综上所述,本研究使用多种数据库和软件,运用网络药理学和分子对接方法,揭示了人参固本口服液治疗乳腺癌的潜在药理学机制,涉及多种成分、多个靶点与多条通路。本研究为人参固本口服液治疗乳腺癌及其他疾病的临床合理应用提供了借鉴和参考。但是,考虑到本研究的主要依据为数据分析,因此需要生物学实验及其他实践结果进一步验证本研究结果。

