磷酸肌酸钠联合果糖二磷酸钠通过miR-133b/ELAVL1分子轴缓解小儿病毒性心肌炎的机制研究Δ
蔡昌君,黄惠敏,桂冬梅,尹杨艳
(海南医学院第一附属医院儿科,海口 570100)
病毒性心肌炎是一种弥漫性或局限性的心肌病变,通常由嗜心肌病毒感染所致[1]。由于小儿免疫系统尚在发育,抵抗能力较差,因此极易被病毒感染,罹患病毒性心肌炎[2]。经过长期临床实践发现,磷酸肌酸钠和果糖二磷酸钠用于小儿病毒性心肌炎的治疗,可发挥良好的疗效[3-4]。也有临床研究结果证实,磷酸肌酸钠联合果糖二磷酸钠对小儿病毒性心肌炎的疗效更佳[5]。但鲜有研究探讨上述联合用药的分子机制。微RNA(miRNA)为广泛存在于机体中的非编码RNA,与人类的多种疾病密切相关[6]。作为疾病标志物,异常上调或下调的特定miRNA可能参与调控疾病的发生及发展过程,其中也不乏针对病毒性心肌炎的相关报道[7]。也有研究结果发现,调控机体中的miRNA是药物发挥作用的方式之一[8]。基于上述研究基础,柯萨奇病毒B组(CVB)作为引发病毒性心肌炎的病毒之一,已被广泛用于构建病毒性心肌炎模型[9]。心肌肌钙蛋白T(cTnT)为心肌肌肉收缩的调节蛋白,其浓度会在心肌受到损伤后显著升高;肌酸激酶同工酶(CK-MB)水平明显升高时,提示心肌损害;此外,心肌炎是以炎症性病变为主要表现的疾病,肿瘤坏死因子α(TNF-α)为涉及系统性炎症的细胞因子,白细胞介素6(IL-6)为机体抗感染免疫反应中起重要作用的淋巴因子,两者的水平也与心肌炎的病程密切相关。因此,本研究探讨了磷酸肌酸钠联合果糖二磷酸钠对小儿病毒性心肌炎心肌损伤标志物(cTnT和CK-MB)、炎症因子(TNF-α和IL-6)水平的影响,同时筛选出受磷酸肌酸钠联合果糖二磷酸钠影响显著的miRNA,并进一步通过柯萨奇病毒B组3型Nancy株(CVB3)感染心肌细胞,构建病毒性心肌炎细胞模型,从细胞水平探讨磷酸肌酸钠联合果糖二磷酸钠发挥治疗效果的分子机制,现报告如下。
1 资料与方法
1.1 资料来源
依据《病毒性心肌炎诊断标准》,将2018年1月至2020年1月就诊于我院的符合诊断标准的2~6周岁病毒性心肌炎患儿120例作为研究对象,主要临床表现为腹泻、发热、心悸和气促。诊断标准为血清柯萨奇病毒阳性,并符合以下辅助改变之一:(1)心功能不全;(2)心脏扩大,室壁运动弥漫性降低;(3)心电图检查显示,以R波为主的2个以上主要导联ST-T段改变,低电压(新生儿除外)出现异常Q波。纳入标准:年龄2~6周岁;无先天性心脏病或心脏畸形。排除标准:伴有严重器官功能障碍者;合并免疫系统疾病、代谢系统疾病者;其他类型心肌炎者。本研究获得我院伦理委员会审批通过(审批号:20171215076)。根据给药情况,将患儿分为磷酸肌酸钠组、果糖二磷酸钠组和磷酸肌酸钠+果糖二磷酸钠组,每组40例。磷酸肌酸钠组患儿平均年龄(11.23±2.73)岁;男性22例,女性18例。果糖二磷酸钠组患儿平均年龄(11.43±3.32)岁;男性27例,女性13例。磷酸肌酸钠+果糖二磷酸钠组患儿平均年龄(10.82±4.23)岁;男性16例,女性24例。三组患儿年龄、性别等资料相似,具备可比性。
1.2 治疗方法
(1)磷酸肌酸钠组患儿使用注射用磷酸肌酸钠[规格:0.5 g(以C4H8N3O5PNa2计)],1日1 g,静脉注射,分2次给药。(2)果糖二磷酸钠组患儿口服果糖二磷酸钠片[规格:0.25 g(以C6H11Na3O12P2计)],1日200 mg/kg,分2次给药。(3)磷酸肌酸钠+果糖二磷酸钠组患儿使用注射用磷酸肌酸钠静脉注射,并口服果糖二磷酸钠片,用法与用量同磷酸肌酸钠组、果糖二磷酸钠组。三组患儿均连续治疗3周。
1.3 观察指标
分别取治疗前后患儿清晨空腹状态静脉血,已酶联免疫吸附试验(ELISA)试剂盒说明书为指导处理患者血液样本,检测cTnT、CK-MB、TNF-α和IL-6水平,以及miRNA表达水平。
1.4 细胞实验方法
1.4.1 材料:(1)细胞。人心肌细胞(HCM,上海中乔新舟生物科技有限公司,货号为6200,品牌为Sciencell);CVB3病毒由中国医科院生物技术研究所提供。(2)仪器。ABI 7500型实时荧光定量聚合酶链反应(PCR)仪(北京安麦格贸易有限公司);GIS-500型凝胶成像分析仪(杭州谷峰科学仪器有限公司);HBS-1096A型酶标分析仪(上海研卉生物科技有限公司)。(3)药品与试剂。注射用磷酸肌酸钠(北京朋来制药有限公司,批准文号为国药准字H20068079);果糖二磷酸钠片(上海信谊天平药业有限公司,批准文号为国药准字H19991128)。miR-133b inhibitor、miR-133b mimics及pcDNA-ELAVL1由广州市锐博生物科技有限公司设计并合成。InvitrogenTMLipofectamineTM2000 Transfection Reagent(货号:11668-019)购自上海伟进生物科技有限公司。TRIzol法总RNA提取试剂盒(货号:CD-13433-ML),逆转录试剂盒(货号:CD-102539GM),总蛋白提取试剂盒(货号:CD-13559-ML),BCA蛋白法含量测试盒(货号:CDY-2798X-SJH),人cTnT ELISA试剂盒(货号:CD-101420-ELISA),人CK-MB ELISA试剂盒(货号:CD-101354-ELISA),人TNF-α ELISA试剂盒(货号:CD-102490-ELA),人IL-6 ELISA试剂盒(货号:CD-102483-ELA),CCK-8细胞活力检测试剂盒(货号:CDJ-1626C-SJH),均购自武汉纯度生物科技有限公司。anti-ELAVL1(货号:XGK97147),anti-GAPDH(货号:XGK104170),二抗(货号:XG-X10933),ECL化学发光试剂盒(货号:XG-X10548),均购自上海西格生物科技有限公司。双荧光素酶活性检测试剂盒(货号:C-8304)购自上海彩佑实业有限公司。
1.4.2 细胞培养、模型构建及转染:采用含10%胎牛血清的DMEM培养基在37 ℃、5%CO2培养箱中培养HCM,即为HCM组。待HCM出现搏动后以100 Tcid50作为实验接种浓度将CVB3作用于HCM,构建病毒性心肌炎模型细胞(CVB3-HCM),为CVB3组。待模型构建成功后,使用Lipofectamine 2000转染试剂将miR-133b inhibitor、miR-133b mimics和pcDNA-ELAVL1按实验分组需求分别转染至CVB3-HCM,即为miR-133b inhibitor组、miR-133b mimics组和OE-ELAVL1组,另设置阴性对照组(NC组);48 h后验证转染效率,转染成功即可用于后续实验。另外,采用磷酸肌酸钠和果糖二磷酸钠联合处理上述各组细胞,根据各组转染的载体不同,分为磷酸肌酸钠+果糖二磷酸钠处理无载体转染CVB3-HCM细胞(磷酸肌酸钠+果糖二磷酸钠组),磷酸肌酸钠+果糖二磷酸钠处理OE-ELAVL1组(磷酸肌酸钠+果糖二磷酸钠+OE-ELAVL1组)、磷酸肌酸钠+果糖二磷酸钠处理miR-133b inhibitor组(磷酸肌酸钠+果糖二磷酸钠+miR-133b inhibitor组),磷酸肌酸钠+果糖二磷酸钠处理同时转染miR-133b mimic和pcDNA-ELAVL1的CVB3-HCM细胞(磷酸肌酸钠+果糖二磷酸钠+miR-133b mimic+OE-ELAVL1组)。
1.4.3 CCK-8检测细胞毒性:用不同浓度磷酸肌酸钠或果糖二磷酸钠处理CVB3-HCM,通过细胞存活率确定磷酸肌酸钠和果糖二磷酸钠的细胞毒性。采用CCK-8检测细胞毒性,将浓度为5×103个/mL的CVB3-HCM接种于96孔板,于37 ℃、5%CO2下稳定24 h后,加入不同浓度磷酸肌酸钠(1、5、10、20和30 mmol/L)或果糖二磷酸钠(1、3、5、10和20 mg/mL)处理细胞24 h,再加入CCK-8孵育后于450 nm处测吸光度。
1.4.4 实时荧光定量反转录PCR(RT-qPCR)检测miR-133b水平:细胞中总RNA用Trizol法RNA提取试剂盒提取后,再用反转录试剂盒将其反转录为cDNA,而后进行扩增,条件为95 ℃、10 min,95 ℃、30 s,60 ℃、30 s,45个循环。引物序列如下,内参U6上游引物为5′-CTCGCTTCGGCAGCACA-3′,下游引物为5′-AACGCTTCACGAATTTGCGT-3′;miR-133b上游引物为5′-AAGAAAGATGCCCCCTGCTC-3′,下游引物为5′-GTAGCT GGTTGAAGGGGACC-3′。采用2-ΔΔCt法以U6为内参对miR-133b的相对表达量进行计算。
1.4.5 蛋白质印迹法检测ELAVL1的表达:细胞中的总蛋白用蛋白提取试剂盒提取后经BCA蛋白法含量测试盒检测浓度,然后将等量提取出的蛋白上样后用10%聚丙烯酰胺凝胶进行电泳分离,结束后转至PVDF膜上,用5%脱脂奶粉封闭2 h后加入1∶1 000一抗anti-ELAVL1后在4 ℃下孵育过夜。次日,去除一抗,加入1∶1 000二抗孵育1 h。孵育结束后,洗膜,加ECL发光试剂显影。
1.4.6 ELISA检测心肌损伤标志物及炎症因子水平:根据ELISA,处理人CVB3-HCM细胞,检测细胞心肌损伤标志物(cTnT和CK-MB)、炎症因子(TNF-α和IL-6)水平。
1.4.7 免疫荧光检测细胞焦亡:在室温(25 ℃)下用4%多聚甲醛缓冲液处理各实验组细胞20 min后加入1%的BSA和0.1%的Triton-X反应1 h,然后在4 ℃下用NLRP3及caspase-1抗体孵育过夜。次日洗脱一抗后加二抗处理1 h,并用DAPI对细胞核进行染色。染色结束后于荧光显微镜下拍照。
1.4.8 双荧光素酶报告基因实验验证miR-133b和ELAVL1的靶向关系:根据双荧光素酶活性检测试剂盒说明书,将miR-133b和ELAVL1结合片段的序列扩增后插入荧光素酶载体中构建野生型ELAVL1载体(ELAVL1-WT)、结合位点序列突变后插入荧光素酶载体中构建突变型ELAVL1载体(ELAVL1-MUT),而后将ELAVL1-WT或ELAVL1-MUT与miR-133b mimics分别转染至293T细胞中在37 ℃、5%CO2下培养48 h后检测荧光素酶活性。
1.5 统计学方法

2 结果
2.1 磷酸肌酸钠联合果糖二磷酸钠治疗小儿心肌炎的临床研究
与治疗前相比,治疗后磷酸肌酸钠组、果糖二磷酸钠组和磷酸肌酸钠+果糖二磷酸钠组患儿体内心肌损伤标志物(cTnT、CK-MB)和炎症因子(TNF-α、IL-6)水平显著降低,差异均有统计学意义(P<0.05),见表1。治疗前后患儿静脉血样本中异常表达的miRNA见图1,结果显示,miR-133b表达水平在每组治疗后均显著上调。
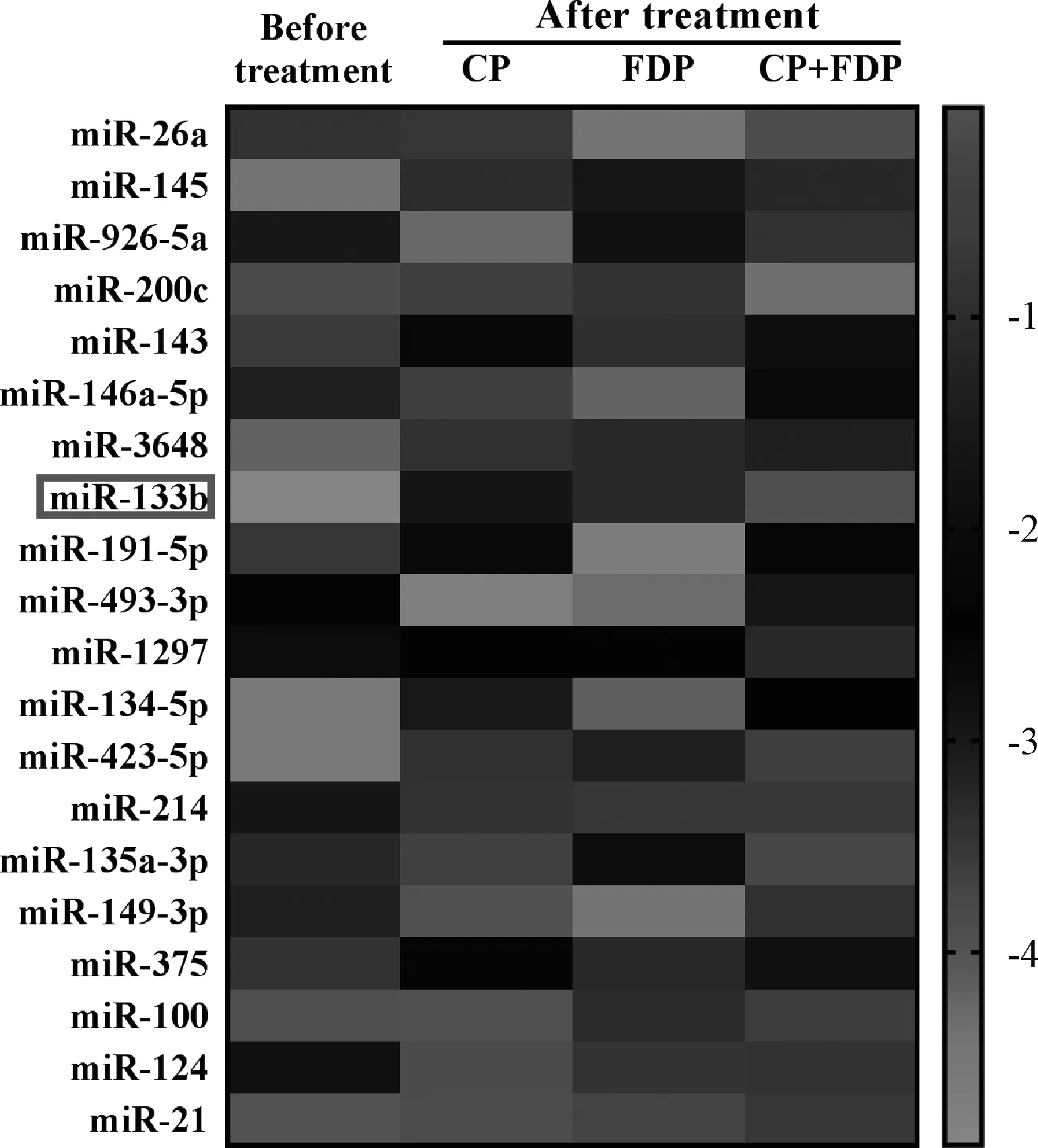
图1 病毒性心肌炎患儿经磷酸肌酸钠联合果糖二磷酸钠治疗前后miRNA表达谱
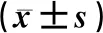
表1 三组患儿治疗前后心肌损伤标志物变化比较
2.2 磷酸肌酸钠联合果糖二磷酸钠通过miR-133b对CVB3-HCM的影响
采用RT-qPCR检测心肌细胞中miR-133b水平发现,与HCM组miR-133b水平(1.00±0.07)相比,CVB3组miR-133b水平(0.50±0.09)显著降低,磷酸肌酸钠+果糖二磷酸钠组CVB3-HCM中miR-133b水平(0.94±0.05)显著上调,三组的差异有统计学意义(F=41.66,P=0.000 3)。miR-133b inhibitor转染至CVB3-HCM后的RT-qPCR检测结果显示,与NC组miR-133b水平(1.02±0.04)相比,miR-133b inhibitor组miR-133b水平(0.03±0.06)显著降低,差异有统计学意义(t=17.53,P=0.000 062)。检测cTnT、CK-MB、TNF-α及IL-6水平发现,与CVB3组相比,心肌损伤标志物及炎症因子在磷酸肌酸钠+果糖二磷酸钠组CVB3-HCM中显著降低,但磷酸肌酸钠+果糖二磷酸钠+miR-133b inhibitor组CVB3-HCM中与CVB3组相近,见表2。免疫荧光染色结果显示,与CVB3组相比,磷酸肌酸钠+果糖二磷酸钠组CVB3-HCM中NLRP3及caspase-1显著被抑制,miR-133b inhibitor组的CVB3-HCM细胞焦亡标志物水平无显著变化,见图2。
表2 磷酸肌酸钠联合果糖二磷酸钠处理对心肌细胞损伤标志物及炎症因子水平的影响

图2 磷酸肌酸钠联合果糖二磷酸钠通过miR-133b对CVB3-HCM焦亡的影响
2.3 miR-133b与ELAVL1的靶向关系
ELAVL1(ELAV-like protein 1)与miR-133b的靶向结合位点见图3(A)。双荧光素酶报告基因实验结果显示,与NC组相比,miR-133b mimics组ELAVL1野生型载体(ELAVL1-WT)的荧光素酶活性显著降低,差异有统计学意义(P<0.05);但两组ELAVL1突变型载体(ELAVL1-MUT)的荧光素酶活性比较,差异无统计学意义(P>0.05),见表3。在CVB3-HCM中转染miR-133b mimics后的RT-qPCR检测结果显示,与NC组miR-133b水平(1.01±0.04)相比,miR-133b mimics组CVB3-HCM中miR-133b水平(2.28±0.22)显著升高,差异有统计学意义(t=9.86,P=0.000 6)。蛋白质印迹法检测结果发现,miR-133b mimics组ELAVL1蛋白水平显著低于NC组,见图3(B)。
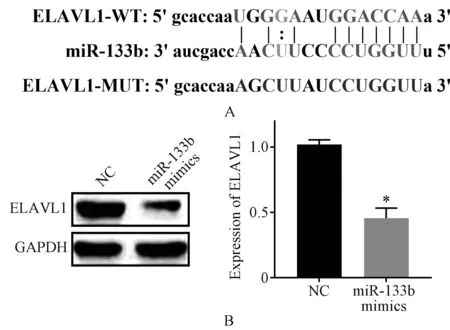
A.miR-133b和ELAVL1的结合位点;B.miR-133b对ELAVL1蛋白表达水平的影响

表3 双荧光素酶报告基因实验验证miR-133b与ELAVL1的靶向关系
2.4 磷酸肌酸钠联合果糖二磷酸钠通过miR-133b/ELAVL1分子轴对CVB3-HCM细胞损伤、炎症反应及细胞焦亡的影响
蛋白质印迹法检测ELAVL1蛋白水平结果显示,与CVB3组相比,磷酸肌酸钠+果糖二磷酸钠组CVB3-HCM中ELAVL1蛋白水平显著降低,磷酸肌酸钠+果糖二磷酸钠+OE-ELAVL1组中ELAVL1蛋白水平显著高于磷酸肌酸钠+果糖二磷酸钠组,磷酸肌酸钠+果糖二磷酸钠+OE-ELAVL1+miR-133b mimics组ELAVL1蛋白水平显著低于磷酸肌酸钠+果糖二磷酸钠+OE-ELAVL1组,上述差异均有统计学意义(P<0.05),见图4(A)。各组心肌损伤标志物、炎症因子及细胞焦亡结果显示,磷酸肌酸钠+果糖二磷酸钠组CVB3-HCM心肌细胞中cTnT、CK-MB、TNF-α和IL-6水平,NLRP3、caspase-1表达水平显著低于CVB3组;磷酸肌酸钠+果糖二磷酸钠+OE-ELAVL1组cTnT、CK-MB、TNF-α和IL-6水平,NLRP3、caspase-1表达水平显著高于磷酸肌酸钠+果糖二磷酸钠组;而磷酸肌酸钠+果糖二磷酸钠+OE-ELAVL1+miR-133b mimics组CVB3-HCM细胞损伤、炎症因子及细胞焦亡标志物水平均显著低于磷酸肌酸钠+果糖二磷酸钠+OE-ELAVL1组,上述差异均有统计学意义(P<0.05),见表4、图4(B)。
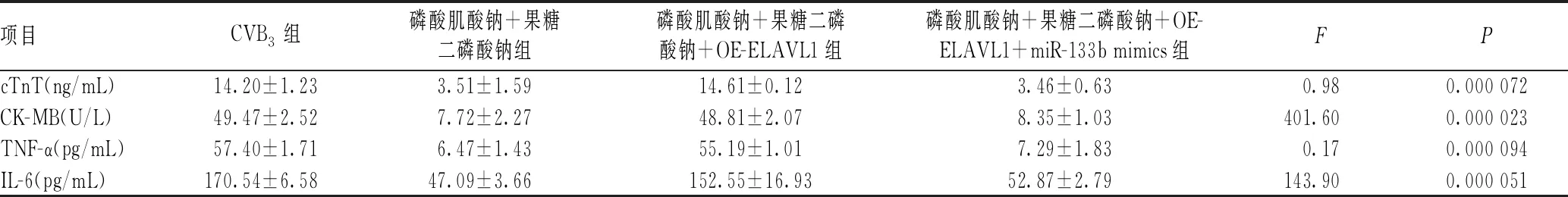
表4 磷酸肌酸钠联合果糖二磷酸钠通过miR-133b/ELAVL1分子轴对CVB3-HCM细胞损伤及炎症反应的影响
3 讨论
病毒性心肌炎为儿科常见的后天性心脏疾病,具有扩张型心肌病、预后差等多种不良影响[10]。在小儿病毒性心肌炎的治疗中,磷酸肌酸钠、果糖二磷酸钠及两者联合应用成为临床上较为常见的有效治疗方法[11-12]。尤其是磷酸肌酸钠联合果糖二磷酸钠的疗效得到了广泛的认可[13-14]。但对联合用药作用机制的研究缺失成为该治疗方案进一步推广中亟待解决的问题。本研究通过临床治疗肯定了磷酸肌酸钠联合果糖二磷酸钠的疗效,筛选出有可能参与药效发挥的miRNA,并在细胞水平对此机制加以验证。
本研究在临床水平和细胞水平的结果均证实,miR-133b在病毒性心肌炎患儿血液样本及CVB3感染的心肌细胞中表达显著下调,而经过磷酸肌酸钠联合果糖二磷酸钠治疗后miR-133b表达水平显著上调;后续细胞水平的实验结果也表明,敲降CVB3感染的心肌细胞中miR-133b后,磷酸肌酸钠联合果糖二磷酸钠可逆转CVB3所致细胞损伤、炎症反应及细胞焦亡的抑制作用。该结果不仅提示异常低表达的miR-133b有成为小儿病毒性心肌炎标志物的潜在可能性,也表明磷酸肌酸钠联合果糖二磷酸钠对小儿病毒性心肌炎的治疗作用可能是通过上调miR-133b表达,进而抑制病毒对心肌细胞的损伤。有研究结果提出,过表达miR-133b可减弱病毒对心肌炎患儿心肌细胞的损伤[15];过表达miR-133b能够有效降低细胞中IL-1β、IL-6及TNF-α水平,缓解炎症反应[16];细胞焦亡关键基因NLRP3是miR-133b的潜在下游靶基因[17]。上述研究也从多个角度进一步支撑了本研究结果。
miRNA通过调节下游靶基因参与细胞的生理过程已得到广泛证实,通过StarBase预测发现ELAVL1是miR-133b的靶基因之一,进一步采用双荧光素酶报告基因实验及蛋白质印迹法检测发现,miR-133b靶向负调控CVB3-HCM中ELAVL1蛋白。本研究中,miR-133b的靶基因ELAVL1被过表达后,磷酸肌酸钠联合果糖二磷酸钠对CVB3感染心肌细胞的治疗作用将被显著削弱,可见,ELAVL1在磷酸肌酸钠联合果糖二磷酸钠治疗小儿病毒性心肌炎中意义重大。ELAVL1是一种广泛表达的RNA结合蛋白,能够作为RNA调节因子,通过多种转录后机制介导多种蛋白的表达[18]。有研究结果表明,人肺上皮细胞中ELAVL1表达被抑制后,TNF-α、IL-6、IL-1β及IL-18等多种炎症因子的释放也随之减少;此外,与细胞焦亡相关的NLRP3、Gasdermin D及caspase-1蛋白水平也显著降低[19]。针对人心室肌细胞的研究结果也表明,敲除ELAVL1基因可通过抑制NLRP3、caspase-1和IL-1β,缓解高糖诱导的细胞焦亡[20]。以上结果与本研究一致,即过表达ELAVL1能够促进CVB3-HCM细胞焦亡和炎症反应。
综上所述,磷酸肌酸钠联合果糖二磷酸钠通过上调病毒性心肌炎心肌细胞中miR-133b的表达,抑制ELAVL1蛋白,从而缓解CVB3对心肌细胞的损伤,抑制炎症反应和细胞焦亡。本研究结果可为磷酸肌酸钠联合果糖二磷酸钠治疗小儿病毒性心肌炎提供分子机制方面的支持。

