食物中毒样品中大肠埃希氏菌的分离、检测和鉴定
◎ 龙 慧,龙永艳,王 伟,吴 葵,樊国印
(南昌市疾病预防控制中心,江西 南昌 330038)
大肠埃希氏菌是一种革兰氏阴性杆菌,有周生鞭毛、无芽孢、兼性厌氧,其广泛分布在人和温血动物肠道内[1]。误食被大肠埃希氏菌污染的食物,通常会引起腹泻、呕吐等症状,尤其是对于新生儿、老年人等免疫力较低的人群,在感染大肠埃希氏菌后不给予处理治疗,会严重影响患者的身体健康[2-3]。建立灵敏、准确的检测方法对于预防和控制大肠埃希氏菌引起的食品安全事件尤为重要。目前,《国家食品安全标准 食品微生物检验 大肠埃希氏菌计数》(GB 4789.38—2012)明确规定大肠埃希氏菌的检验方法,通过LST肉汤多管发酵进行检测,最少需要2 d才能对结果进行初步的判定,具有一定的滞后性,无法满足食物中毒样品快速检测的需求[4]。荧光定量PCR是通过扩增特定的靶基因实现指数放大,然后收集荧光信号构建标准曲线用于靶标定量,整个检测过程耗时短,且能够满足快速检测的需求,适用于食物中毒样品的应急检测[5-7]。荧光定量PCR主要分为染料法和探针法,染料法是对扩增后的双链DNA进行结合产生荧光信号,非特异性的扩增的二聚体会影响荧光信号造成假阳性[8-10]。
本研究使用探针法进行检测,选取大肠埃希氏菌的uidA基因设计引物和探针序列,构建荧光定量PCR检测体系并评价方法的检测性能,进一步应用建立的检测方法对食物中毒样本进行分析,并对检测为大肠埃希氏菌阳性的样本进行分离鉴定和药敏实验。这为荧光定量PCR用于食品中检测大肠埃希氏菌提供科学依据,能够及时掌握食源性大肠埃希氏菌的生化及耐药信息。
1 材料与方法
1.1 试剂和仪器
营养琼脂(北京陆桥技术股份有限公司)、脑心浸出液(北京路桥技术股份有限公司)、Premix Ex Taq™(TAKARA,宝日医生物技术有限公司)、革兰氏阴性菌细菌鉴定卡(梅里埃)、细菌药敏鉴定卡(梅里埃);高速冷冻离心机(赛默飞世尔科技)、恒温恒湿培养箱(上海一恒科技有限公司)、荧光定量PCR仪-CFX96 Touch[伯乐生命医学产品(上海)有限公司]。
1.2 实验方法
1.2.1 引物和探针设计
根据NCBⅠ数据库报道的大肠埃希氏菌特异性基因uidA序列,使用Beacon designer 8设计引物和探针,并利用NCBⅠ BLAST验证引物的特异性,确定不存在非目标菌的基因匹配,引物和探针序列委托通用生物(安徽)股份有限公司合成。
1.2.2 基因组DNA提取
细菌基因组DNA的提取采用水煮沸法。取菌悬液1 mL加入到1.5 mL无菌离心管中,放置在高速离心机中12 000 r·min-1离心3 min,去除上清液,然后加入1 mL PBS缓冲液重悬,12 000 r·min-1离心3 min,重复一次,最后重悬在500 μL超纯水中,获取菌悬液;将菌悬液放置在沸水中,煮沸15 min,使细菌破裂暴露出基因组DNA,然后放置在冰水浴中5 min,最后通过12 000 r·min-1离心5 min,上清液即为基因组DNA。
1.2.3 方法的建立和性能评价
根据Beacon designer 8软件提供的引物和探针Tm值,设置退火和延伸温度范围为55.0~65.0 ℃,进行梯度PCR,根据不同温度对应的相对荧光强度确定最佳的退火和延伸温度。qPCR扩增体系总体积为25 μL,包含 12.5 μL(2×)Premix Ex Taq™,0.5 μL 上游引物uidA-F(10 μmol·L-1)、0.5 μL 下 游 引 物uidA-R(10 μmol·L-1),0.5 μL 探针uidA-P(10 μmol·L-1),5 μL基因组DNA模板,6 μL超纯水;扩增程序,95 ℃预变性3 min,95 ℃变性15 s,57.0 ℃退火和延伸30 s,在退火和延伸阶段采集荧光信号。
取纯菌液按照2.3的方法提取基因组DNA,并进行梯度稀释,获取菌浓度为101~108CFU·mL-1的基因组DNA,然后对基因组DNA进行qPCR扩增,根据不同细菌浓度对应的Ct值建立标准曲线,确定线性相关性和扩增效率以及检测灵敏度。
选取2株目标菌、8株非目标菌的纯菌液,按照2.3的方法提取基因组DNA,通过qPCR扩增,验证该方法的特异性。
1.2.4 生化鉴定
取qPCR鉴定为大肠埃希氏菌的阳性样本进行分离培养,获取4株大肠埃希氏菌单菌落,然后接种在脑心浸出液中进行过夜培养得到菌悬液。将菌悬液进行稀释,使菌浓度大约在0.5麦氏单位,然后按照全自动细菌生化鉴定系统(VⅠTEK 2)要求进行操作。
1.2.5 药敏实验
取qPCR和生化鉴定为大肠埃希氏菌的菌悬液,将菌悬液稀释至浓度约为0.5麦氏单位,使用革兰氏阴性菌药敏卡片(AST-GN16)进行药敏实验,确定大肠埃希氏菌分离菌的耐药信息。
2 结果与分析
2.1 检测方法的建立
qPCR体系建立为快速灵敏的检测目标菌提供了基础,本研究成功建立了荧光定量PCR检测大肠埃希氏菌。退火温度优化的结果如图1所示,当温度为55.0~57.0 ℃时,RFU值逐渐增加,57.0~65.0 ℃时RFU值逐渐降低,根据优化结果,选取57.0 ℃为最佳退火温度。
qPCR扩增曲线结果如图2所示,扩增曲线为典型的S型曲线,基线期、指数期和平台期明显,曲线平滑无分叉现象,整个检测过程在2 h内完成,表明qPCR检测体系的成功建立。
2.2 方法检测限的评价
方法检测限是评价检测方法性能的重要指标,在最优条件下对不同浓度的目标菌进行检测,通过qPCR扩增结果,以不同细菌浓度对应的Ct值建立标准曲线,结果如图3所示,线性方程Y=-3.116X+42.85,扩增效率为109%,线性相关性R2=0.996 6,线性范围为10~108CFU·mL-1,检测灵敏度为10 CFU·mL-1。结果表明,本研究建立的qPCR检测体系,检测灵敏度高、线性范围宽,具有较好的扩增效率。
2.3 方法特异性评价
选取2株大肠埃希氏菌(ATCC 25922、ATCC 8739),8株非目标菌[鼠伤寒沙门氏菌(CMCC 50115)、副伤寒沙门氏菌(CMCC 80094)、肠炎沙门氏菌(ATCC 13076)、金黄色葡萄球菌(CMCC 26001)、金黄色葡萄球菌(CMCC 26003)、阪崎克罗诺杆菌(ATCC 29544)、蜡样芽孢杆菌(ATCC 11778)和铜绿假单胞菌(ATCC 9027)]检测特异性验证,检测结果如图4所示,uidA基因只能扩增大肠埃希氏菌,其他非目标菌无扩增曲线,结果表明,本研究建立的qPCR检测体系能够特异性检测大肠埃希氏菌。
2.4 大肠埃希氏菌的生化鉴定
根据VⅠTEK生化鉴定结果显示,进一步确定从食物中毒样品中分离的4株菌为大肠埃希氏菌。具体的生化鉴定结果如表1所示,大部分生化结果都相同,只有少数生化项目存在差异,其中分离株C2能够分解D-麦芽糖和蔗糖且酪氨酸芳胺酶阳性,分离株C3能够分解D-麦芽糖且γ-谷氨酰转移酶阴性,分离株C4能够分解D-麦芽糖和蔗糖。
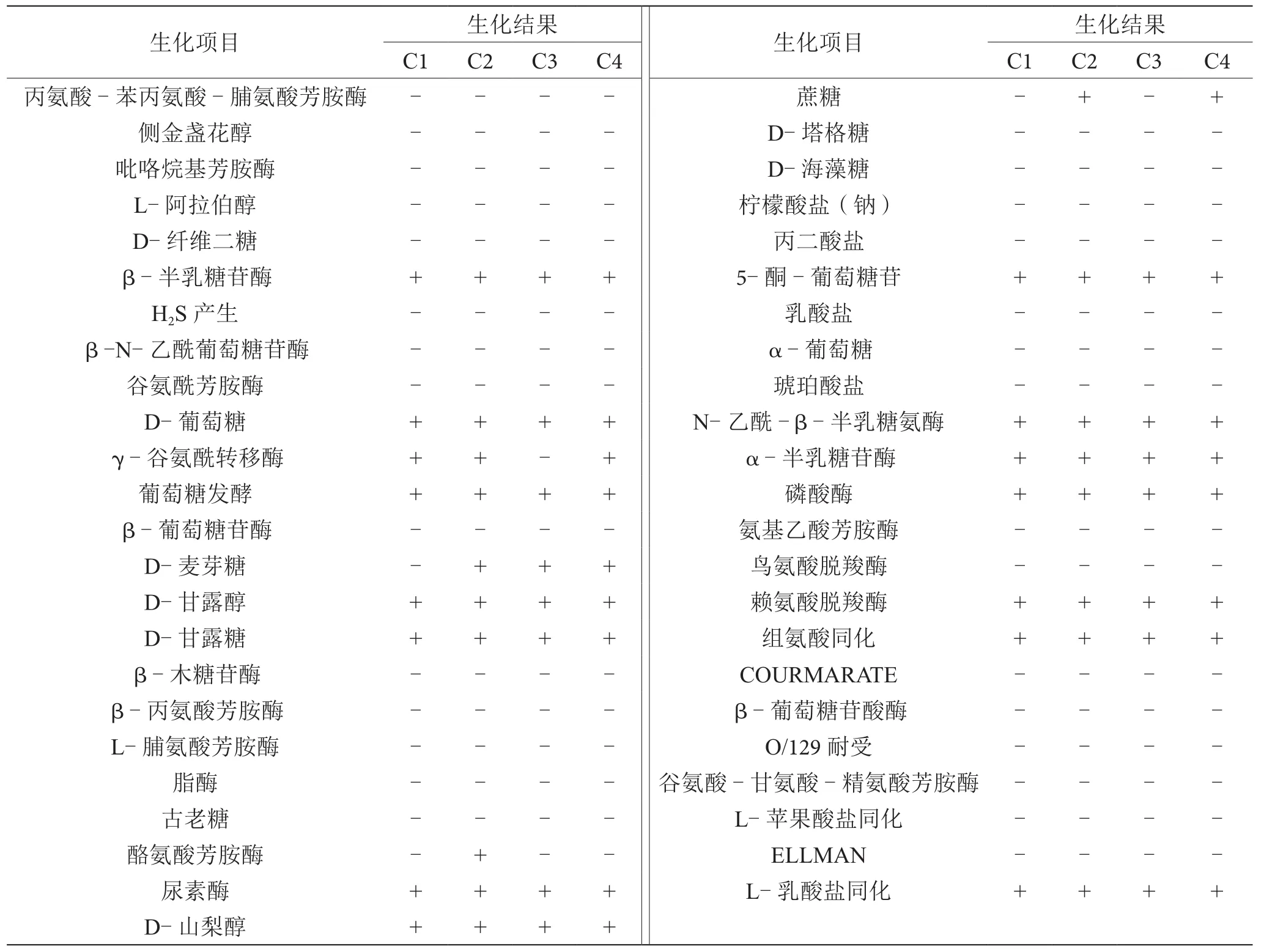
表1 生化鉴定结果表
2.5 大肠埃希氏菌药敏实验
大肠埃希氏菌药敏实验结果见表2。4株大肠埃希氏菌分离株均表现出对氨苄西林、阿莫西林-棒酸、哌拉西林-他唑巴坦、头孢唑啉、头孢西丁、头孢曲松、头孢匹美、氨曲南、厄他培南、亚氨培南、阿米卡星、环丙沙星、呋喃妥因和复方新诺明等抗生素耐药,对庆大霉素、妥布霉素、左旋氧氟沙星和替加环素等抗生素表现出不同的耐受情况,且不同分离株对一些抗生素的最低抑菌浓度(MⅠC)表现出不同。
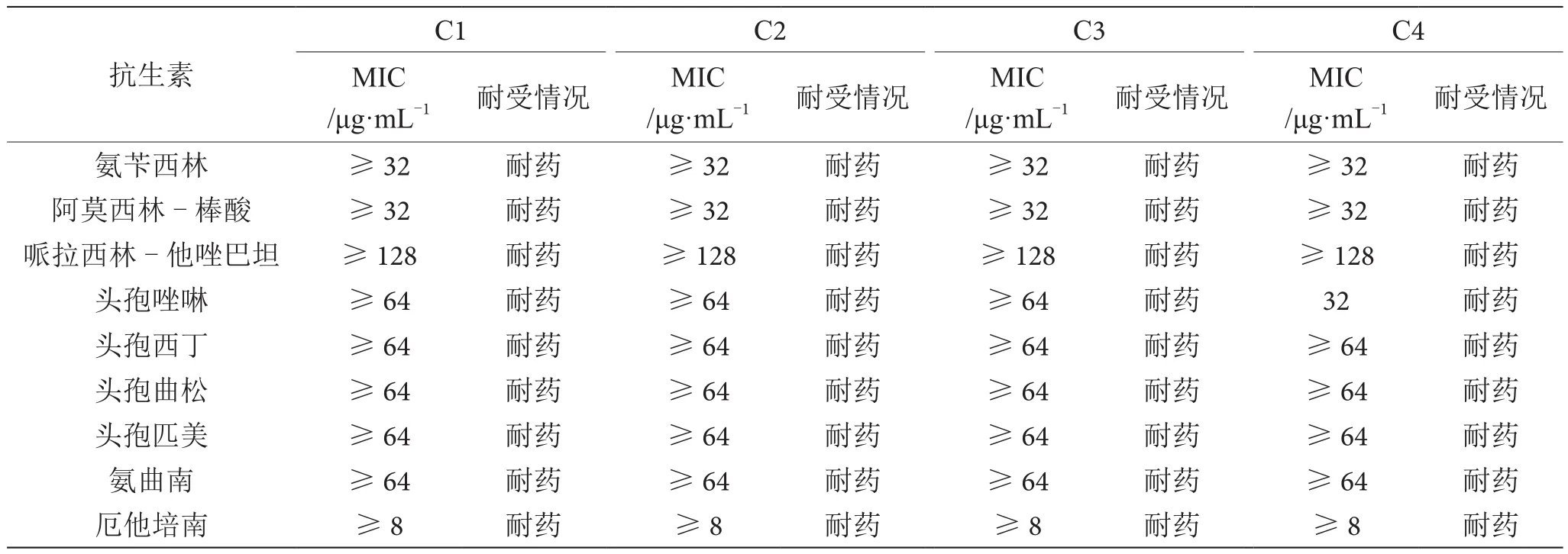
表2 药敏实验结果表
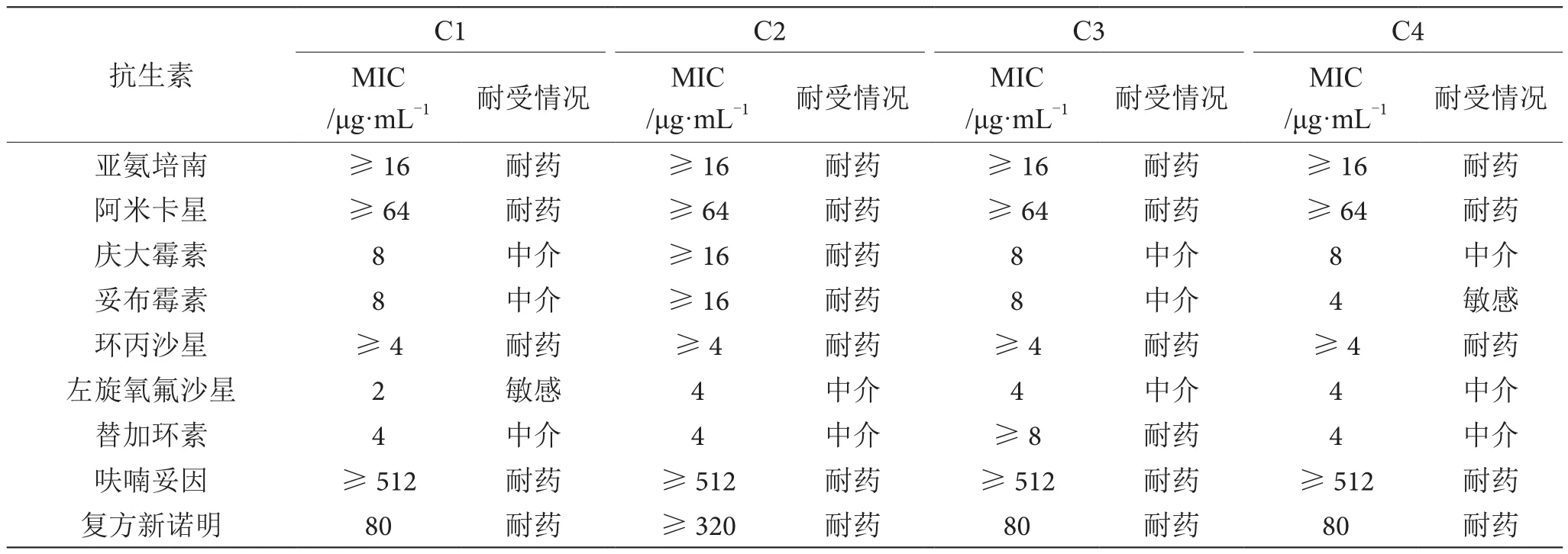
续表2
3 结论
本研究选取大肠埃希氏菌特异性基因uidA设计引物和探针序列,构建荧光定量PCR检测体系,实现灵敏、快速、准确的检测大肠埃希氏菌,检测限低至10 CFU·mL-1。使用本研究建立的荧光定量PCR检测体系对10份食物中毒样品进行分析,发现4份大肠埃希氏菌阳性样本,对阳性样本进行纯培养分离获取了4株大肠埃希氏菌。VⅠTEK生化鉴定进一步表明这4株分离株为典型的大肠埃希氏菌,而且这4株分离株的生化鉴定结果基本一致,比对样本来源信息发现,这4份样本的采样来自相同环境。药敏实验结果显示4株分离株对大部分的抗生素表现出相同的耐药情况,只有少部分存在差异。
大肠埃希氏菌是一种常见引发食物中毒的病原菌,人们误食被污染的食品后会引发一系列的疾病,建立快速准确的检测方法,对预防和控制由大肠埃希氏菌引发的食物中毒具有重要意义。进一步生化和药敏分析能够掌握中毒样品中大肠埃希氏菌的生物学特性,这为患者治疗提供了科学依据。

