儿童急性淋巴细胞白血病中RAS基因突变的检测及其临床意义
姚燕玲 王西阁 赵雪莲 李帅全 周玉洁 徐一卓
(郑州大学第三附属医院血液科,河南郑州 450052)
RAS信号通路控制着细胞增殖、分化与凋亡,当RAS基因突变时,细胞非依赖性增殖,转变为癌细胞[1-2]。RAS基因编码RAS蛋白,RAS蛋白分别与二磷酸鸟苷(guanosine diphosphate,GDP)、三磷酸鸟苷(guanosine triohosphate,GTP)结合,将促进生长的信号从细胞膜传递到细胞核,起到细胞“开关”的作用。生理情况下,鸟嘌呤核苷酸交换因子促进GDP向GTP转换,激活下游通路,使细胞增殖。GTP酶激活蛋白(GTPase-activating protein,GAP)可提高RAS蛋白的内在GTP酶活性,促进GTP水解为GDP。通过GAP引起的RAS活性失活是RAS等位基因致癌突变中最常见的体细胞突变靶点。RAS基因位点G61的致癌突变降低了RAS蛋白的内在GTP酶活性,而位点G12、G13通过空间位阻阻碍RAS与GAP之间形成范德华键,从而降低GTP水解水平[3-5]。近年来,随着基因测序技术日益精进,RAS基因得到越来越多的关注,如RAS基因突变常作为亚克隆发生在骨髓增生异常综合征疾病晚期;骨髓纤维化疾病中,RAS基因突变常与外周血单核细胞水平升高、血小板计数减低、骨髓原始细胞比例升高等有关,影响该病的总生存(overall survival,OS)率[6-7]。既往研究表明,在急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)患儿中,RAS基因突变与药物反应差、低无病生存率、高复发风险有关[8-9]。本研究使用二代测序方法,分析了ALL中RAS基因突变患儿的临床特征和实验室检查,及其对OS率的影响。
1 资料与方法
1.1 研究对象
回顾性收集2015年1月至2020年1月就诊于郑州大学第三附属医院并完成二代测序的初治ALL患儿120例的临床资料,其中男性65例(54.2%),女性55例(45.8%)。急性B淋巴细胞白血病(acute B lymphoblastic leukemia,B-ALL)105例,急性T淋巴细胞白血病(acute T lymphoblastic leukemia,T-ALL)15例。根据是否存在RAS基因突变分为RAS基因突变组和RAS基因阴性组。
1.2 RAS基因突变的检测
采集初治ALL患儿2 mL骨髓标本,用二代测序法检测RAS基因全外显子序列的单核苷酸变异、小片段插入/缺失,平均测序深度为2 000×,测序后原始数据进行生物信息学分析,筛选致病性基因突变位点。
1.3 免疫学分型
将患儿2 mL骨髓样本放入流式细胞仪中,设门分析异常细胞,应用单克隆抗体对白血病细胞表面抗原进行标记,根据免疫学标志进行分型。
1.4 染色体核型分析
取患儿2 mL骨髓标本放入肝素抗凝管中,进行植物血凝素短期培养后立即制片,收集有丝分裂的骨髓中期细胞,行吉姆萨染色并显带分析,放入染色体分析仪中,分析并描述染色体核型。
1.5 融合基因检测
取患儿2 mL骨髓标本,放入EDTA-K2抗凝管中,TRIzol法提取有核细胞RNA,使用基因扩增仪(杭州博日Life Pro扩增仪)、科研用ALL融合基因检测试剂盒(美国OMEGA公司生产),在多重巢式RT-PCR技术下,检测常见的15种融合基因,包括:MLL/AF4、SIL/TAL1、ETV6/RUNX1、dupMLL、MLL/ENT、E2A/PBX1、SET/CAN、BCR/ABL、TLS/ERG、E2A/HLF、CALM/AF10、HOX11L2、HOX11、MLL/AF10、NPM/ALK。
1.6 随访
随访截止时间为2021年4月30日,通过住院病历、门诊病历和电话获得患儿情况。OS期指自诊断日期至死亡或随访截止日期。
1.7 统计学分析
采用SPSS 26.0软件完成统计学分析。非正态分布计量资料采用中位数(四分位数间距)[M(P25,P75)]表示,组间比较采用Wilcoxon秩和检验;计数资料采用例数和百分率(%)表示,率的比较采用卡方检验或Fisher确切概率法。生存分析用Kaplan-Meier法,采用log-rank法进行单因素分析,将单因素分析中P<0.1的影响因素纳入Cox风险比例回归模型进行多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 RAS基因突变情况
120例ALL患儿中,RAS基因突变35例(29.2%),其中仅KRAS基因突变30例(25.0%),NRAS基因突变伴KRAS基因突变5例(4.2%)。RAS基因突变在B-ALL患儿中检出率为33.3%(35/105),未在T-ALL患儿中检出。全部(5/5)NRAS基因突变和57%(20/35)KRAS基因突变均发生于第12号密码子上,14%(5/35)KRAS基因突变发生于第13号密码子上,29%(10/35)KRAS基因突变发生于其他密码子上,未发现第61号密码子突变。
2.2 RAS基因突变组和RAS基因阴性组临床特征比较
RAS基因突变组与RAS基因阴性组在性别、诊断年龄、危险度分型、髓外浸润等方面差异均无统计学意义(P>0.05)。RAS基因突变组B-ALL比例、染色体核型异常比例高于RAS基因阴性组,初诊白细胞数计数低于RAS基因阴性组(P<0.05)。见表1。
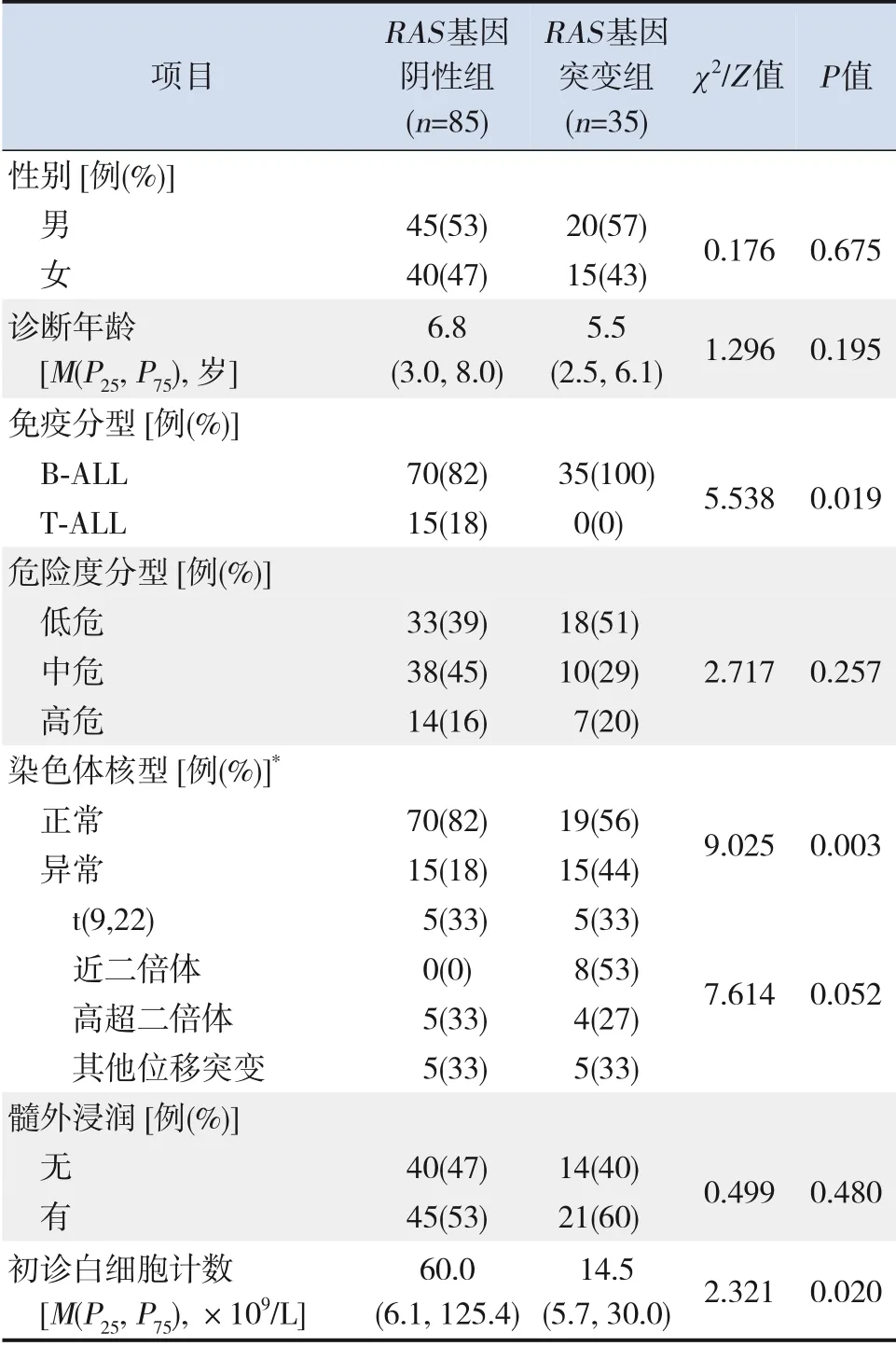
表1 RAS基因突变组和RAS基因阴性组临床特征比较
2.3 伴RAS基因突变ALL患儿预后的影响因素分析
中位随访时间为18(9,35)个月,失访11例(9.2%)。随访109例ALL患儿中,死亡16例(14.7%);5例(4.6%)患儿有中枢神经系统复发,其中伴RAS基因突变1例。RAS基因突变患儿2年OS率为54%±13%,低于RAS基因阴性患儿(89%±4%,χ2=5.422,P=0.020)(图1)。35例RAS基因突变患儿中位随访时间17.5(7.5,24.8)个月,失访9例。随访26例患儿中,死亡7例(27%),1例(4%)出现中枢神经系统复发。单因素分析显示,WT1基因过表达、初诊白细胞计数可影响伴RAS基因突变ALL患儿的预后(P<0.05),见表2。
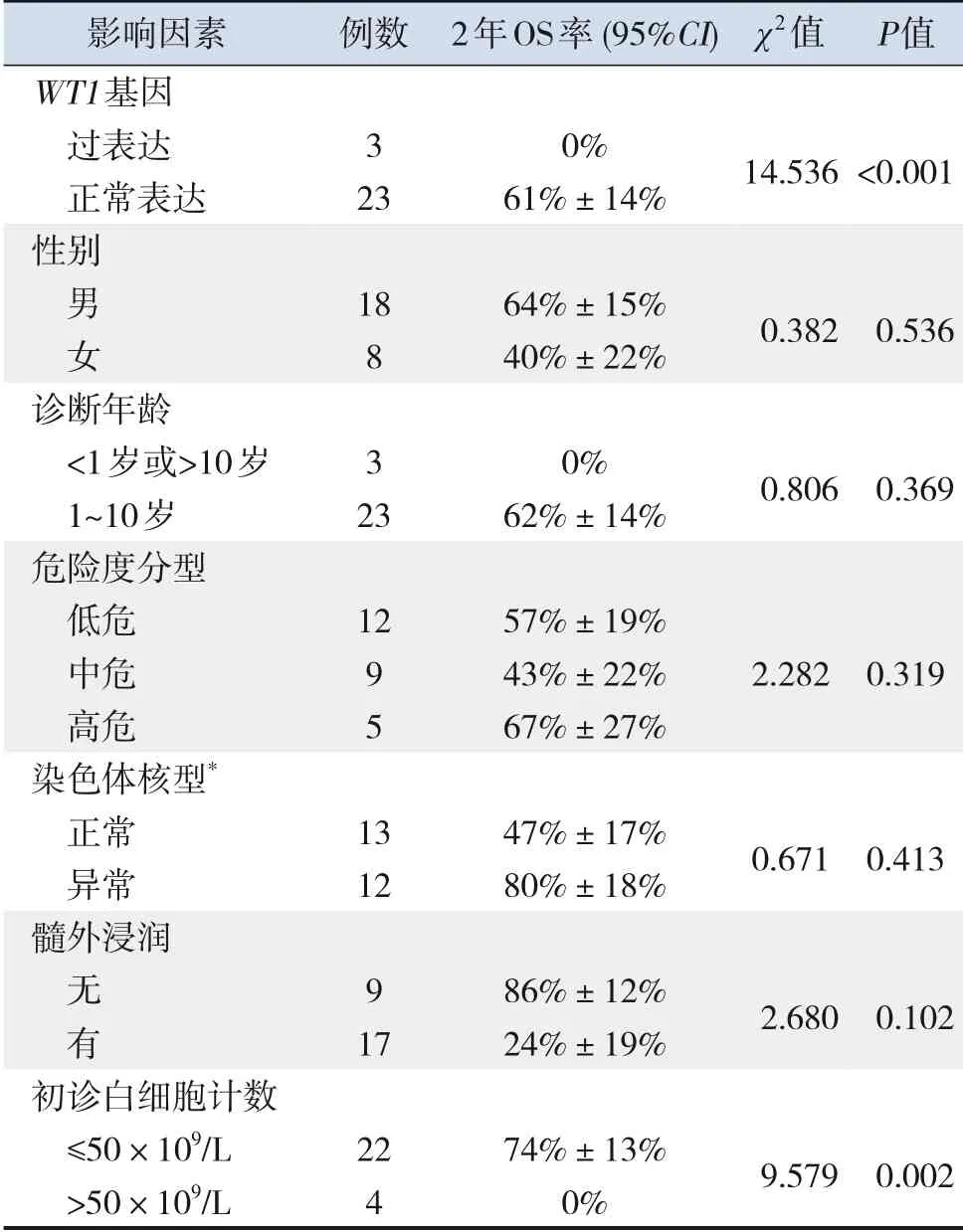
表2 影响伴RAS基因突变ALL患儿预后的单因素分析
将单因素分析中P<0.1的影响因素纳入Cox风险比例回归模型进行多因素分析显示,WT1基因过表达、初诊白细胞计数>50×109/L为伴RAS基因突 变ALL患儿预后不良的影响因素(P<0.05),见表3。

表3 影响伴RAS基因突变ALL患儿预后因素的Cox风险比例回归模型分析
3 讨论
RAS基因可分为3种:NRAS、KRAS、HRAS基因。Wiemels等[10]的研究中,RAS基因在191例ALL患儿中的检出率为20%。有报道称NRAS基因突变较常见,发生率为6%[8]。RAS基因点突变多见于第12、13、61号密码子[8,11]。本研究中仅KRAS基因突变检出率25.0%(30/120),NRAS基因突变检出率4.2%(5/120),多于第12、13号密码子发生点突变,与上述研究基本相符。
本研究中B-ALL患儿RAS基因突变率高于T-ALL患儿,和Wiemels等[12]研究基本一致,但另一项研究表明RAS基因突变率在B-ALL和T-ALL中无差异[10]。也有研究证实RAS基因突变在早期前体T-ALL中达到三分之二以上,而在非早期前体T-ALL中只有19%[13]。本研究并未在T-ALL中检出RAS基因突变。结果不一致的原因可能有:(1)患儿构成有差异;(2)样本量限制;(3)检测方法不同。既往研究表明,RAS基因突变患儿高危分型比例高于RAS基因未突变患儿[14],本研究中未得出有差异的结果。英国一项小规模研究纳入86例ALL患儿,结果显示,RAS基因突变与初诊白细胞计数较高等相关[15]。本研究中RAS基因突变患儿初诊白细胞数未明显升高,可能与患儿构成差异造成数据结果偏倚有关。我们分析初诊白细胞计数升高原因可能为:与其他正常儿童细胞相比,RAS基因在外周血白细胞、淋巴细胞和骨髓细胞中相对活化[16]。在超二倍体亚组中,RAS基因突变组的初诊白细胞计数高于RAS基因阴性组;在非超二倍体亚组中,RAS基因突变与初诊白细胞计数无关,这表明RAS基因和高超二倍体之间有极其强烈的关联[12]。Holmfeldt等[17]研究表明,ALL患者中,三分之二以上的单倍体患儿存在RAS基因突变,低亚二倍体和近二倍体患儿则较少发生RAS基因突变。本研究中,RAS基因突变患儿染色体核型多正常。造成结果不同的原因可能是不同队列的患儿构成比不同。
迄今所报道的RAS基因对预后的影响,尚存争议。美国一项纳入870例ALL患者的研究显示,RAS基因突变对无事件生存率、无病生存率或OS率无影响[11]。Zhang等[18]和Irving等[19]研究指出RAS基因突变常与ALL复发有关。但Case等[15]研究表明,儿童ALL诊断和复发时RAS基因突变率相似,意味着RAS基因突变不是ALL复发的危险因素。本研究得出,RAS基因突变可影响ALL患儿的OS率。伴RAS基因突变ALL患儿合并WT1基因过表达、初诊白细胞数计数>50×109/L时,预后更差。我们分析RAS基因突变影响预后的原因可能有:(1)RAS基因突变多与预后不良基因变异(IKZF1基因缺失、TP53基因突变、FLT3基因突变等)同时发生;(2)RAS基因突变在复发时常见;(3)RAS基因突变患儿对化疗药物耐药。既往研究已证实,伴RAS基因突变的患儿在体外对糖皮质激素的抵抗力更强[20]。在存活率更低的KRAS基因突变细胞中,对长春新碱治疗的敏感性可重复增加,相反,KRAS基因突变细胞对甲氨蝶呤有抗药性,且双KRAS基因密码子点突变的表达比单一KRAS基因密码子点突变的表达诱导了更高水平的MAPK磷酸化和更强的甲氨蝶呤抗药性,所以,MEK抑制剂等相关药物得到了越来越多的关注[21]。
综上所述,本研究表明RAS基因突变患儿多是B-ALL,初诊白细胞计数无明显升高,对化疗药物可能出现耐药性,预后不良。在患儿初治时即完善相关基因突变检查,明确有无RAS基因突变,对是否服用相关激酶抑制剂药物有一定指导意义。但本研究结果仍需要大样本多中心研究进一步证实。

